Hoofdstuk 7 – Experimenten
1. Zuren
1.1. Eigenschappen
1.1.1. Zuuraanslag op het oog
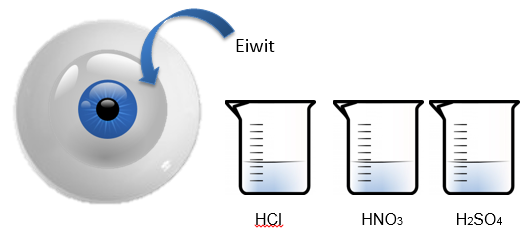
- Info:Wat gebeurt er als we eiwit laten reageren met HCl, HNO3 en H2SO4? We zien dat het gebruik van sterke zuren zorgt voor chemische reacties zoals neerslagvorming (eiwit + HCl). Dit is een irreversibel proces omdat de sterke zuren zorgen voor een hydrolyse van de peptidebindingen tussen de aminozuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: eiwit van rauw ei – 6 mol/l HCl – HNO3 10 mol/l – H2SO4 geconcentreerd
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.1.2. Eigenschappen van zuren vergelijken

- Info:Hoe sterk is azijnzuur? Het azijnzuur is een zwak zuur en ioniseert beperkt in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 15 ml Azijnzuur 0,05 mol/l – 15 ml HCl 0,05 mol/l – Na2CO3 0,4 mol/l 5 ml – CuCO3 0,5 g
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – zuursterkte – zwakke zuren
1.1.3. Geleidbaarheid bepalen van water, zuren en hydroxiden in blisterverpakking

- Info: Hoe verschilt de geleidbaarheid van water, zuren en basische oplossingen? We stellen vast dat zowel HCl als NaOH de elektrische stroom goed geleiden. Opgeloste zuren en basen geleiden de elektrische stroom door de aanwezigheid van ionen. (resp. door ionisatie en dissociatie).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Water – HCl oplossing 1 mol/l – NaOH oplossing 0,1 mol/l
- Thema: Anorganische stoffen
- Tijd: 25 min
- Begrippen: zuren – basen – geleidbaarheid
1.1.4. Hygroscopische werking van zwavelzuur

- Info: Wat gebeurt er als we geconcentreerd zwavelzuur toevoegen aan gehydrateerd kopersulfaat? Watervrij koper(II)sulfaat wordt gebruikt om sporen van water in sommige vloeistoffen aan te tonen, omdat het zout, na contact met water, de karakteristieke blauwe kleur verkrijgt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur – Kristallen CuSO4.5H2O
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.1.5. Verdunde en geconcentreerde zuren reageren verscheiden
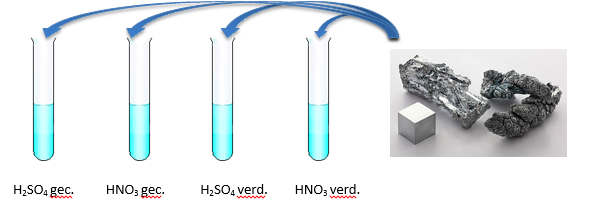
- Info: Wat neem je anders waar als je zink laat reageren met verdunde en geconcentreerde zuren? De reactie tussen zink en verdund zwavelzuur zorgt voor de vorming van een witte stof en een gas. Deze reactie is licht bruisend. Bij geconcentreerd zwavelzuur is de reactie heviger. Er ontstaat een schuimlaag dankzij de productie van het gas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zinkpoeder – Geconcentreerd zwavelzuur en salpeterzuur – H2SO4 1 mol/l en HNO3 1 mol/l
- Thema: Anorganische stoffen
- Tijd: 20 min
- Begrippen: zuren – corrosie
1.1.6. Verschil in zuursterkte van organische zuren
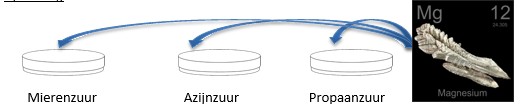
- Info: Reageert het ene zuur sneller dan het andere? En waarom? Het ene zuur is sterker dan het andere omdat er een verschil is in splitsingsgraad in water. Hoe hoger de splitsingsgraad, hoe sterker het zuur!
- Moeilijkheid: eenvoudig
- Chemische stoffen: mierenzuur – azijnzuur – propaanzuur – Mg-lint
- Thema: Anorganische stoffen
- Tijd: 20 min
- Begrippen: zuren – zuursterkte
1.1.7. Warmte-effecten bij verdunnen van zwavelzuur
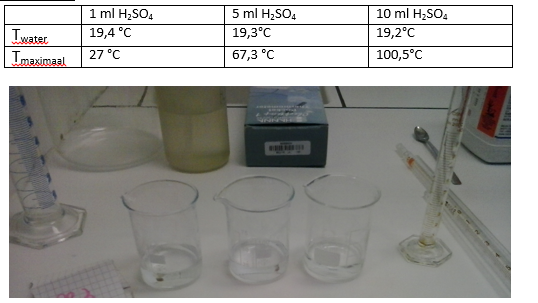
- Info: Wat zal er gebeuren als we geconcentreerd zwavelzuur toevoegen aan water? Wat nemen we waar?Hoe hoger de concentratie aan zwavelzuur, hoe sterker de reactie met water optreedt. Hierdoor komt er meer energie vrij. Dus de maximale temperatuur zal hoger zijn, indien je concentratie hoger is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Water – Geconcentreerd zwavelzuur
- Thema: Anorganische stoffen
- Tijd: 20 min
- Begrippen: zuren – corrosie – oploswarmte
1.1.8. Zijn alle zuren even sterk?

- Info: Zijn alle zuren even sterk? We kunnen besluiten dat HCl een sterker zuur is dan azijnzuur, de reactiesnelheid in deze ballon ligt immers hoger. Hieruit kunnen we afleiden dat zoutzuur een sterker zuur is dan azijnzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een HCl-oplossing en een azijnzuuroplossing, beide met een concentratie = 1 mol/liter. – 2 ballonnen, – 2 x eenzelfde hoeveelheid bakpoeder (NaHCO3)
- Thema: Anorganische stoffen
- Tijd: 20 min
- Begrippen: zuren – zuursterkte – sterke en zwakke zuren
1.1.9. Zuiver zand

- Info: Hoe kunnen we met een neutralisatiereactie zand maken? We gieten 20ml waterglas in een bekerglas (van plastiek). Hier voegen we het zoutzuur aan toe.Er vormt zich een dikke brij. We wegen af.
- Moeilijkheid: gemiddeld
- Chemische stoffen: zoutzuur 2mol/l (35ml) – waterglas (Na2SiO3) 37% (20ml) – water (50ml)
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: zuren – zuur-basereactie
1.1.10. Zuren als antioxidans

- Info: Hoe kunnen we het verkleuren van een gesneden appel tegen gaan door het gebruik van zuren?
- Moeilijkheid: gemiddeld
- Chemische stoffen: citroenzuuroplossing 10%, – HCl oplossing 0,1 mol/l, – ascorbinezuuroplossing 0,1%, – appel
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: zuren – anti-oxidans
1.1.11. Zuren op marmer

- Info: Hoe reageert marmer met een zuur? Hoewel allemaal zure oplossing werden gebruikt werd een verschil in sterkte van gasontwikkeling vastgesteld. Met sterk zure reinigers wordt bruisende werking vastgesteld.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een stuk marmer – een aantal zure huishoudproducten
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.1.12. Zuren oplossen in ijs en water
- Info: Wat gebeurt er als we zwavelzuur aan ijskoud water of ijs toevoegen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 200ml 9 mol/l H2SO4 – 100g ijs – 100ml ijskoud water
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – oploswarmte
1.1.13.Zuurheid van zuren en zouten

- Info: Hoe zuur zijn zuren en zouten? Magnesium gaat net iets feller reageren met azijnzuur, omdat azijnzuur een iets lagere pH heeft dan wijnsteenzuur. Bismuthnitraat geeft een zwak zure oplossing in water wat heel traag met magnesium reageert.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magnesiumlint – Azijnzuur – Wijnsteenzuur – AlCl3 gehydrateerd – Bi(NO3)3
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – zuursterkte
1.1.14. Inwerking van zuren op metalen
- Info: Hoe werken zuren in op metalen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: verdund HCl 6mol/l – verdund H2SO4 6mol/l – geconcentreerd salpeterzuur 12mol/l – kleine maatcilinder met 1 ml CuSO4-oplossing 1% – 1 koperplaatje – papier met mespunt ijzerpoeder – ijzernagels – zinkplaatjes – 3 aluminiumplaatjes
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zuren – zuursterkte – verdringingsreeks metalen
1.1.15. Zuren reageren met magnesium

- Info: Hoe werken zuren in opmagnesium?
- Moeilijkheid: eenvoudig
- Chemische stoffen: v 10 ml zoutzuur 1 mol/l – 10 ml mierenzuur gec – 1 spatelpunt citroenzuur – 3 stukjes Mg-lint
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zuren – zuursterkte – verdringingsreeks metalen
1.1.16. Zuren zijn elektrisch geleidend

- Info: Geleidt zuur elektriciteit in gedestilleerd water? Twee koolstofelektroden zijn geïntegreerd in een circuit tussen een batterij en een elektromotor. Beide elektroden mogen elkaar niet raken en in een lege beker steken. Voeg nu voldoende gedestilleerd water toe aan het bekerglas totdat beide koolstofelektroden bevochtigd zijn.
In de tweede stap wordt zoutzuur druppelsgewijs toegevoegd. - Moeilijkheid: eenvoudig
- Chemische stoffen: 20 druppels zoutzuur 0.1 mol/l – 100 ml water
- Thema: Anorganische stoffen -Elektrische geleidbaarheid
- Tijd: 15 min
- Begrippen: zuren – geleidbaarheid zuren
1.1.17. Zure regen
- Info: Hoe kun je het effect van zure regen nabootsen in een schaaltje? Het gevormde zwavelzuur is aan te duiden via het pH-indicatorpapier wat het zuur karakter aangeeft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 vol% H2O2 – 1mol/l HCl – Na2S2O5
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.2. Fosforzuur
1.2.1. Titratie van fosforzuur in cola

- Info: Hoeveel fosforzuur zit er in cola? Titratie met gestandaardiseerde oplossing van natriumhydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fft oplossing – Neutraalrood – Methyleenblauw – Cola – NaOH-oplossing 0,1M
- Thema: Anorganische stoffen
- Tijd: 25 min
- Begrippen: zuren – titratie
1.3. Salpeterzuur
1.3.1. Kwalitatief onderzoek van koper in munten

- Info: Hoe kunnen we d.m.v. NH3-oplossing en HNO3-oplossing aantonen dat er koper zit in een munt? Na aanbrengen van de salpeterzuuroplossing, lijken de munten properder te zijn. Wanneer we met het wattenstaafje met ammoniakoplossing over deze munten wrijven, wordt dit wattenstaafje blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen:HNO3-oplossing 1 keer verdund – NH3-oplossing 1 keer verdund
- Thema: Anorganische stoffen
- Tijd: 25 min
- Begrippen: zuren – identificatie koper
1.3.2. Passivering ijzeren nagels met geconcentreerd salpeterzuur

- Info: Wat gebeurt er als we ijzeren nagels in geconcentreerd salpeterzuur brengen? Ijzer lost niet op in geconcentreerd salpeterzuur maar wel in verdund salpeterzuur. Dit komt doordat de metalen hun oppervlak beschermen door een passiverende laag van de overeenkomstige nitraten te vormen. Wanneer water wordt toegevoegd om het mengsel te verdunnen verloopt de reactie plots zeer snel en ontstaan de bekende bruine nitreuze dampen.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Salpeterzuur – 3 ijzeren nagels
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zuren – complexreactie met salpeterzuur
1.3.3. Verdunde en geconcentreerde zuren reageren verscheiden

- Info: Wat neem je anders waar als je zink laat reageren met verdunde en geconcentreerde zuren? De reactie tussen zink en verdund zwavelzuur zorgt voor de vorming van een witte stof en een gas. Deze reactie is licht bruisend.Bij geconcentreerd zwavelzuur is de reactie heviger. Er ontstaat een schuimlaag dankzij de productie van het gas.Voor salpeterzuur geldt hetzelfde. Hoe sterker de concentratie, hoe heviger de reactie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zinkpoeder – Geconcentreerd zwavelzuur en salpeterzuur – H2SO4 1 mol/l en HNO3 1 mol/l
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zuren – corrosie – verdringingsreeks metalen
1.3.4. Zilveren snoepparels

- Info: Wat gebeurt er wanneer we snoepparels in een oplossing brengen? Zilver is een edel metaal en is hierdoor een (relatief) zwakke reductor. Zilver zal dus niet reageren met de meeste zure oplossingen. Het zal dus ook alleen zilverionen vormen in aanwezigheid van een sterke oxidator. Het nitraation aanwezig in salpeterzuur heeft de eigenschap dat het een sterke(re) oxidator is en dat het dus gemakkelijk met zilver reageert. Bij de reactie ontstaan zilverionen: Ag+. Als hieraan een oplossing van natriumchloride wordt toegevoegd, welke chloride-ionen bevat, slaat het slecht oplosbare zilverchloride neer onder vorm van een wit neerslag.
- Moeilijkheid: gemiddeld
- Chemische stoffen: zilveren snoepparels – salpeterzuur (65%) – natriumchloride (0,1 mol/l)
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zuren – corrosie – verdringingsreeks metalen
1.4. Koolzuur
1.4.1. Magische kleurenwissel in een spuit

- Info:De broomthymolblauwoplossing wordt bereid door O,1 g broomthymolblauw te brengen in 8 ml van een licht basische oplossing van NaOH (O,2M). Leng aan tot 50 ml. Verdun nu verder dit staal totdat een doorzichtige blauwe oplossing wordt bekomen.Breng niet te veel staal in de meetspuiten. Je hebt voldoende ruimte nodig om de gevormde CO2 in de vrije ruimte te laten bewegen.Het duur een tijdje eer de overgang van groen naar geel terug verschijnt. Schud tussen door.
- Moeilijkheid: gemiddeld
- Chemische stoffen: broomthymolblauw-indicatoroplossing – spuitwater
- Thema: Anorganische stoffen – chemisch evenwicht
- Tijd:20 min
- Begrippen: zuren – invloed druk op evenwichtsreactie
1.4.2. Maak koolzuur

- Info:Wat gebeurt er als uitgeademde lucht in water wordt gebracht? De indicator kleurt het water groen. Langzaam verandert de kleur naar geeloranje terwijl je erin blaast.
- Moeilijkheid: eenvoudig
- Chemische stoffen:50 ml water – 5 druppels universele indicator
- Thema: Anorganische stoffen
- Tijd:20 min
- Begrippen: zuren -identificatie – zuurheid koolzuur
1.5. Waterstofsulfide
1.5.1. Reacties met waterstofsulfide
- Info:Identificatiereacties van waterstofsulfide
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 1 mol/l – Pb(NO3)2 0,5 mol/l – KMnO4 0,01 mol/l – AgNO3 0,2 mol/l – H2SO4 1 mol/l – ZnS poeder
- Thema: Anorganische stoffen – neerslagreactie – redoxreactie
- Tijd:20 min
- Begrippen: zuren -identificatie – identificatiereactie
1.5.2. Vorming van waterstofsulfide

- Info:Hoe kunnen we waterstofsulfide bereiden en aantonen? De reactie tussen ijzersulfide en HCl zorgt voor een gas namelijk H2S. Het is een gasontwikkelingsreactie. Dit gas heeft een invloed op loodnitraat, deze stof wordt na de reactie met H2S omgezet naar loodsulfide en salpeterzuur. De vorming van het zout is waarneembaar door de zwarte neerslag.Het waterstofsulfide geeft eveneens een neerslag met zinksulfaat. Het gevormde ZnS is waarneembaar door de witgele neerslag.Het waterstofsulfide is tenslotte ook aan te tonen via de reductie van KMnO4. Hierdoor ontstaat zwavel en MnO2 wat waar te nemen is door de bruine neerslagvorming.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Ijzer(II)sulfide – Loodnitraat (0.1mol/l) – Zinksulfaat (0.1mol/l) – Kaliumpermanganaat (0.002 mol/l)
- Thema: Anorganische stoffen – neerslagreactie – redoxreactie
- Tijd:20 min
- Begrippen: zuren -identificatie – identificatiereactie
1.6. Zoutzuur
1.6.1. De reactie van calciumcarbonaat en zoutzuur

- Info:Wat gebeurt er als we calciumcarbonaat laten reageren met zoutzuur? Het koolzuur wordt ontwikkeld door de reactie tussen de kalk (calciumcarbonaat, CaCO3) en het zoutzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 2mol/l – CaCO3
- Thema: Anorganische stoffen – gasvorming
- Tijd:10 min
- Begrippen: zuren -identificatie – identificatiereactie
1.6.2. De reactie van waterglas met zoutzuur

- Info:Hoe kunnen we glas maken? Het witte materiaal dat je dus op de grenslaag tussen het waterglas en zoutzuur ziet ontstaan is zand.Als je maar een klein beetje zoutzuur voorzichtig toevoegt kun je zo een prop maken. Het gevormde SiO2 is dermate hygroscopisch dat het water volledig bindt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: natriumsilicaat (waterglas) – geconcentreerd HCl
- Thema: Anorganische stoffen – neerslagreactie
- Tijd: 30 min
- Begrippen: zuren -identificatie
1.6.3. Elektrochemische metaalbewerking

- Info:Hoe een gat maken met een potlood in een scheermesje? Als we de stroomkring aanzetten zien we dat de HCl onmiddellijk begint te bruisen. We voegen nog een paar keer HCl toe en zien dat in het scheermesje een deuk is gevormd op de plaats waar deze in contact stond met de grafietpunt van de potlood.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zoutzuur – Scheermesje
- Thema: Anorganische stoffen -redoxreactie
- Tijd: 30 min
- Begrippen: zuren – elektrochemie
1.6.4. Elektrolyse van waterstofchloride

- Info: Hoe kunnen we de elektrolyse van waterstofchloride aantonen? We zien dat aan beide polen gasbelletjes gevormd zullen worden. Aan de minpool zijn deze heviger dan aan de pluspool. We zullen ook lichtjes de geur van dichloor kunnen waarnemen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl-oplossing 1 mol/l
- Thema: Anorganische stoffen -redoxreactie
- Tijd: 20 min
- Begrippen: zuren – elektrolyse
1.6.5. Indicatorpatronen door gassen

- Info: De HCl damp die zwaarder is dan lucht, komt in contact met het oppervlak, lost daar op en reageert met de natronloog. De indicator slaat daarbij om naar de kleur in het zure pH-gebied. Door toevallige convectiestromen in de vloeistof ontstaan steeds andere kleurpatronen: meestal basisch, plaatselijk zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 17% HCl oplossing – 0,1 mol/l NaOH oplossing – 0,1% broonkresolgroen
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 20 min
- Begrippen: zuren – werking indicator
1.6.6. Salmiakrook in een doos

- Info: Kunnen we witte rook vormen met twee gassen? In de schoendoos wordt er witte rook gevormd, dit verdwijnt via het gat in de schoendoos. Er treedt een reactie op tussen ammoniak en zoutzuur, de gevormde witte rook is NH4Cl
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd ammoniak – Geconcentreerd zoutzuur
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 20 min
- Begrippen: zuren – reactie zuur en base
1.6.7. Zijn alle zuren even sterk?

- Info: Zijn alle zuren even sterk?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een HCl-oplossing en een azijnzuuroplossing – hoeveelheid bakpoeder (NaHCO3)
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 20 min
- Begrippen: zuren – zuursterkte
1.6.8. Zonsondergang
- Info: We zien dat er duidelijk vertroebeling optreedt. Dit is zo omdat er uiteindelijk zwavel wordt gevormd dat een neerslag is. Hierdoor wordt onze heldere oplossing troebel. Des te hoger de concentratie zoutzuur, des te sneller de neerslagvorming zichtbaar wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 g Na2S2O3 – HCl 2 mol/l 20 ml
- Thema: Anorganische stoffen – reactiesnelheid
- Tijd: 20 min
- Begrippen: zuren – invloed concentratie op reactiesnelheid
1.6.9. Zoutzuurwerking op peptidebindingen in de maag nabootsen

- Info: Hoe worden eiwitten ontleed in de maag? De ene oplossing blijft troebel, die met zoutzuur wordt helder, dit omdat het enzyme alleen werkt in zuur milieu
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magere kwark – Zoutzuur 1 mol/l – Pepsinogeen
- Thema: Anorganische stoffen – biochemie
- Tijd: 20 min
- Begrippen: zuren – invloed enzyme
1.6.10. Zoutzuur en water

- Info: Wat gebeurt er bij het samenvoegen van keukenzout en geconcentreerd zwavelzuur? HCl-dampen. Wanneer deze in contact komen met de indicator, verandert de indicator van een groene naar een roze kleur. Dit betekent dat de dampen zuur zijn. De witte neerslag in AgNO3 duidt op een reactie met chloride-ionen. Het vrijgekomen zuur is bijgevolg zoutzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: natriumchloride – universeelindicator oplossing – natriumhydroxide (0,1mol/l ) – zilvernitraat (1 mol/l) – zwavelzuur (9 mol/l )
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 30 min
- Begrippen: zuren – indicator – identificatie
1.6.11. Knalgas in een ei

- Info: Hoe kunnen we knalgas vormen in een ei?Er vormt zich een gas door reactie tussen zoutzuur en magnesium in de erlenmeyer. Dit gas stijgt en vult het ei.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Mg-lint – HCl
- Thema: Anorganische stoffen -redoxreactie
- Tijd: 30 min
- Begrippen: zuren – verbrandingsreactie
1.6.12. Zoutzuur en kalksteen

- Info: Waarom vernielt “zure regen” veel oude gebouwen? Zoutzuur reageert met kalksteen om kooldioxide te vormen tot calciumchloride . Het zuur verandert de in water onoplosbare kalksteen in een gas en een in water oplosbaar zout.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 stuk kalksteen – 10 ml zoutzuur 0.5 mol/l
- Thema: Anorganische stoffen -gasvormingsreactie
- Tijd: 10 min
- Begrippen: zuren – identificatie koolzuurgas
1.6.13. Maak zoutzuur

- Info: Hoe kun je zoutzuur maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10 ml gec zwavelzuur – 10 ml water – 10 g keukenzout – 10 druppels universele indicator
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 20 min
- Begrippen: zuren – sterk zuur reageert met zout
1.7. Zwalvelzuur
1.7.1. Geheimschrift met zwavelzuur

- Info: Onder invloed van het geconcentreerd zwavelzuur ontstaat een verkoling van het papier
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur; – dik papier
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.7.2. Hoe bekomen we de grootste zwarte slang uit suiker door middel van dehydratatie?

- Info: Hoe bekomen we de grootste zwarte slang uit suiker door middel van dehydratatie? De suiker wordt eerst bruin en later zwart. Het begint te borrelen en te roken. Er wordt eveneens een hoop hitte geproduceerd (exotherme reactie).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kristalsuiker (C12H22O11) – Geconcentreerd zwavelzuur (H2SO4)
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.7.3. Hygroscopische werking van zwavelzuur

- Info: Wat gebeurt er als we geconcentreerd zwavelzuur toevoegen aan gehydrateerd kopersulfaat? Zwavelzuur onttrekt het water van het gehydrateerd kopersulfaat. Hierdoor verliest het kopersulfaat zijn blauwe kleur!
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur – Kristallen CuSO4.5H2O
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
1.7.4. Inerte alkanen

- Info: Hoe reageren alkanen met zwavelzuur? We zien dat zuivere paraffine enkel C-C en C-H bindingen bevat, die te sterk zijn om door zwavelzuur verbroken te worden. Het kaarsenvet daarentegen zal een aantal waterstofbruggen in zijn bindingen hebben zitten, die gedeeltelijk gaan reageren met het zwavelzuur. Suiker bevat naast de C-H bindingen ook C-O-H bindingen, die nog zwakker zijn en die volledig met het zwavelzuur gaan reageren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Paraffine – Kristalsuiker – Geconcentreerd zwavelzuur – kaarsenvet van een theelichtje
- Thema: Anorganische stoffen – organische stoffen
- Tijd: 25 min
- Begrippen: zuren – alkanen
1.7.5. Reactie tussen mierenzuur en geconcentreerd zwavelzuur

- Info: Welk gas ontstaat bij het de ontleding van mierenzuur in een sterk zuur milieu? Bij deze verbranding komt zuiver CO vrij. Dit kan alleen bij de verbranding van mierenzuur gebeuren omdat deze de aldehydefunctie bezit waardoor het geoxideerd kan worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur – Mierenzuur
- Thema: Anorganische stoffen – organische stoffen
- Tijd: 25 min
- Begrippen: zuren – alkanen – identificatiereactie
1.7.6. Reactie van koperoxiden en zwavelzuur

- Info: Hoe reageert koperoxide met zwavelzuur? De reactie tussen CuO en H2SO4 doet CuSO4 en H2O ontstaan, waardoor de oplossing neutraal wordt. Dit kunnen we waarnemen door de blauwe kleur. Metaaloxiden en zuren geven zout en water
- Moeilijkheid: gemiddeld
- Chemische stoffen: H2SO4 0,1 mol/.l 20ml – 1 g CuO
- Thema: Anorganische stoffen – reactie met oxide en zuur
- Tijd: 25 min
- Begrippen: zuren -reactie oxide en zuur
1.7.7. Verdunde en geconcentreerde zuren reageren verscheiden

- Info: Wat neem je anders waar als je zink laat reageren met verdunde en geconcentreerde zuren? De reactie tussen zink en verdund zwavelzuur zorgt voor de vorming van een witte stof en een gas. Deze reactie is licht bruisend.Bij geconcentreerd zwavelzuur is de reactie heviger. Er ontstaat een schuimlaag dankzij de productie van het gas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zinkpoeder – Geconcentreerd zwavelzuur en salpeterzuur – H2SO4 1 mol/l en HNO3 1 mol/l
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zuren – zuursterkte – concentratie
1.7.8. Warmte-effect bij verdunnen van zwavelzuur

- Info: Wat zal er gebeuren als we geconcentreerd zwavelzuur toevoegen aan water? Wat nemen we waar? Hoe hoger de concentratie aan zwavelzuur, hoe sterker de reactie met water optreedt. Hierdoor komt er meer energie vrij. Dus de maximale temperatuur zal hoger zijn, indien je concentratie hoger is.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Geconcentreerd zwavelzuur
- Thema: Anorganische stoffen – thermodynamica
- Tijd: 15 min
- Begrippen: zuren – oploswarmte
1.7.9. Zuur oplossen in ijs en water

- Info: Wat gebeurt er als we zwavelzuur aan ijskoud water of ijs toevoegen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 200ml 9 mol/l H2SO4 – 100g ijs – 100ml ijskoud water
- Thema: Anorganische stoffen – thermodynamica
- Tijd: 15 min
- Begrippen: zuren – oploswarmte
1.7.10. Zwavelzuur en water endotherm en exotherm

- Info: Wat gebeurt er als we zwavelzuur aan ijskoud water of ijs toevoegen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 200ml 9 mol/l H2SO4 – 100g ijs – 100ml ijskoud water
- Thema: Anorganische stoffen – thermodynamica
- Tijd: 15 min
- Begrippen: zuren – oploswarmte
1.7.11. Piranha vloeistof

- Info: Hoe kan een spinazieblad in een vloeistof laten verdwijnen? Een Piranha-oplossing is een 7:3 mengsel van geconcentreerd zwavelzuur en een waterige oplossing van 30% waterstofperoxide, waarbij peroxomonozwavelzuur (Caro’s zuur) wordt gevormd.Het mengsel is een bijzonder krachtige oxidator die vrijwel alle organische moleculen wegoxideert en veel oppervlakken kan hydroxyleren (OH-groepen toevoegen).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerde H2SO4 – Geconcentreerde H202 (30%)
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zuren – corrosie
2. Hydroxiden
2.1. Eigenschappen
2.1.1. Amfotere eigenschappen van metaalhydroxiden

- Info: Hoe kunnen we de amfotere eigenschappen van metaalhydroxiden aantonen? We brengen 3cm zinkchloride oplossing in 2 verschillende proefbuizen. We voegen aan beide proefbuizen NaOH-oplossing toe tot er een gelatineuse neerslag wordt gevormd. We stellen vast dat de neerslag zowel onder invloed van de base als van het zuur oplost. Dit komt door de amfotere eigenschappen van het metaalhydroxide (zinkhydroxide). Hierdoor reageert het metaalhydroxide met zowel zuren als basen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,5 mol/l zinkdichloride – 1 mol/l NaOH – 1 mol/l HCl
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: hydroxide – amfotere stoffen
2.1.2. Geleidbaarheid water, zuren en hydroxiden in een blisterverpakking

- Info: Hoe verschilt de geleidbaarheid van water, zuren en basische oplossingen? We stellen vast dat zowel HCl als NaOH de elektrische stroom goed geleiden. Opgeloste zuren en basen geleiden de elektrische stroom door de aanwezigheid van ionen. (resp. door ionisatie en dissociatie).
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl oplossing 1 mol/l – NaOH oplossing 0,1 mol/l
- Thema: Anorganische stoffen – elektrische geleidbaarheid
- Tijd: 15 min
- Begrippen: hydroxide – elektrolyten
2.1.3. Hydrolyse van eiwitten

- Info: Wat gebeurt er wanneer we een haar onderdompelen in een base?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH-korrels
- Thema: Anorganische stoffen – biochemie
- Tijd: 15 min
- Begrippen: hydroxide – corrosie – eiwitten
2.1.4. Hygroscopische werking van loog

- Info: Wat gebeurt er wanneer we NaOH blootstellen aan lucht? We stellen vast dat de NaOH-pastillen vochtig zijn geworden. Dit komt doordat de NaOH-pastillen hygroscopisch of wateraantrekkend zijn: ze trekken waterdamp uit de lucht aan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH-pastillen
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: hydroxide – corrosie
2.1.5. Oplosbaarheid van hydroxiden

- Info: Hoe goed lossen de verschillende hydroxiden op?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ba(OH)2 – NaOH – KOH – Ca(OH)2 – Fe(OH)3
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen:hydroxide – oplosbaarheid
2.1.6. Opname van koolzuurgas door hydroxiden

- Info: Nemen hydroxiden CO2 op?
- Moeilijkheid: eenvoudig
- Chemische stoffen: KOH – NaOH – Ca(OH)2 – droogijs
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 15 min
- Begrippen:hydroxide – carbonaatvorming
2.1.7. Sealed bag experiment met hydroxiden

- Info: Hoe verloopt het gewicht bij het uitvoeren van een reactie in een sealed bag? We stellen vast dat vast dat de massa ongeveer constant blijft. Dit kunnen we verklaren door de wet van behoud van massa: de massa van een gesloten systeem (afsluitbare plastieken zak) constant zal blijven, ongeacht de processen die binnen het systeem plaatsvinden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 15ml 2mol/l NaOH – g droogijs
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 15 min
- Begrippen:hydroxide – wet van behoud van massa
2.1.8. Basische drankjes met rode koolsap

- Info: Hoe kunnen we kleurrijke drankjes maken met behulp van koolsap?
- Moeilijkheid: eenvoudig
- Chemische stoffen: rode kool – Afwasmiddel – Zout – Suiker – Soda – Azijn (7-8%) – Citroensap – ammoniak
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen:hydroxide – werking van zuur-baseindicator
2.1.9. Amfotere eigenschappen van metaalhydroxiden2

- Info: Hoe regeren metaalhydroxiden verschillend met zuren en basen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 100 ml 0.5 mol/l zinkchloride – 250 ml van 1.0 mol/l natriumhydroxide – 250 ml van 1.0 mol/l zoutzuur
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: hydroxide – amfotere stoffen
2.2. Ammoniak
2.2.1. Bepaling van het ammoniakgehalte in vensterreiniger door titratie

- Info: Hoeveel is het ammoniakgehalte in vensterreiniger? Titratie met een gestandaardiseerde zoutzuuroplossing
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniakoplossing 9,6-9,9% als ontvlekker – HCl-oplossing 0,1mol/l
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: hydroxide – titratie
2.2.2. Blauwe mist

- Info: Hoe kun je blauwkleurige mist maken? De lichtblauwe oplossing krijgt een korenbloemblauwe kleur door vorming van het Cu(NH3)42+ complex
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 80ml O,1 mol/l – NH3-oplossing 25%
- Thema: Anorganische stoffen – complexreactie
- Tijd: 15 min
- Begrippen: hydroxide – complexreactie
2.2.3. Blauwe rozen

- Info: Hoe kun je blauwkleurige mist maken? De lichtblauwe oplossing krijgt een korenbloemblauwe kleur door vorming van het Cu(NH3)42+ complex
- Moeilijkheid: eenvoudig
- Chemische stoffen: aceton – ammoniakoplossing 25% – rode half uitgebloeide rozen
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: hydroxide – zuur-base indicator
2.2.4. Dissociatie van ammoniak

- Info: Welk effect heeft verwarmen op een 5% ammoniakoplossing? We voegen aan een klein beetje ammoniakoplossing 50ml water en 10 druppels fenolftaleïne toe. We verdelen dit over 2 erlenmeyers. 1 van de twee erlenmeyers verwarmen we op de kookplaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5% ammoniakoplossing – Fenolftaleïne
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: hydroxide – sterkte van basen
2.2.5. Eigenschappen van ammoniak

- Info: Welke eigenschappen heeft ammoniak? Complexreactie, zuur-basereactie, identificatie
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH3 3 mol/l – Universele indicator – CuSO4 0,2 mol/l – Nessler’s reagens
- Thema: Anorganische stoffen – neutralisatiereactie – complexreactie
- Tijd: 25 min
- Begrippen: hydroxide – identificatiereactie
2.2.6. Endotherme reacties met de vorming van ammoniak

- Info: Endotherme reactie die spontaan verloopt door de vorming van gasvormig ammoniak
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl – Ba(OH)2.8H20
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 20 min
- Begrippen: hydroxide – endotherme reactie
2.2.7. Geheime koperboodschap

- Info: Hoe kunnen we een geheime koperboodschap schrijven? We stellen vast dat de kopersulfaatoplossing lichtblauw kleurt wanneer het in aanraking komt met ammoniak. Hierbij wordt koperhydroxide gevormd wat een blauwe kleur heeft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniak (3% is genoeg) – Zeer verdunde kopersulfaatoplossing
- Thema: Anorganische stoffen – complexreactie
- Tijd: 10 min
- Begrippen: hydroxide – identificatie
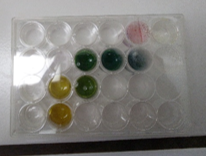
2.2.8. Neerslagreacties via een gas
- Info: Hoe kunnen we een koperamine complex eenvoudig aantonen? Complexvoming met ammoniak van koper(II)ionen
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4-oplossing (0,01 mol/l) – Geconcentreerde ammoniakoplossing
- Thema: Anorganische stoffen – complexreactie
- Tijd: 10 min
- Begrippen: hydroxide – identificatie
2.2.9. Diffusie van een gas via microschaal
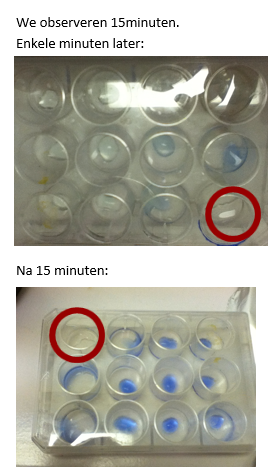
- Info: Hoe kunnen we diffusie aantonen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconc. NH3 – CuSO4 0,5 mol/l
- Thema: Anorganische stoffen – stofeigenschappen
- Tijd: 10 min
- Begrippen: hydroxide – diffusie
2.2.10. Diffusie aantonen met ammoniak aantonen met rode koolsap
- Info: Hoe kunnen we diffusie aantonen met rode koolsap en ammoniak? De ammoniak- en zoutzuurdeeltjes gaan zich geleidelijk aan verspreiden volgens een willekeurige beweging. Dit ten gevolge van de kinetische energie die ze bezitten. Omdat het rode koolsap een universele indicator is zullen we het diffusieproces van ammoniak goed kunnen waarnemen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rode koolsap – Geconcentreerd ammoniak – Enkele druppels van een zuur :In deze proef gebruiken we HCl
- Thema: Anorganische stoffen – stofeigenschappen
- Tijd: 10 min
- Begrippen: hydroxide – diffusie
2.2.11. Reacties in microschaal met ammoniak

- Info: Hoe reageren verschillende stoffen op ammoniak? Verschillende chemische reacties tonen de eigenschappen van ammoniak aan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniak (NH₃) 2 mol/l – Zoutzuur (HCl) 0,1 mol/l – Kopersulfaat (CuSO₄) 0,1 mol/l – Ijzer(II)sulfaat (FeSO₄) 0,1 mol/l – Ijzer(III)nitraat (Fe(NO₃)₃) 0,1 mol/l – Zinksulfaat (ZnSO₄) 0,1 mol/l – blister – Calciumchloride (CaCl2) – Indicator papier
- Thema: Anorganische stoffen – eigenschappen van ammoniak
- Tijd: 30 min
- Begrippen: hydroxide – identificatie
2.2.12. Oplosbaarheid van ammoniak in water

- Info: Hoe kunnen we aantonen dat ammoniak oplosbaar is in water? Het ammoniak zuigt het water naar boven. We krijgen een ammoniakfontein. Dat komt omdat het ammoniak zich wil vermengen met het water. Het gevolg is een onderdruk, waardoor het water wordt opgezogen.
- Moeilijkheid: eenvoudig
- Chemische stoffen:NaOH – NH4Cl
- Thema: Anorganische stoffen – eigenschappen van ammoniak
- Tijd: 30 min
- Begrippen: hydroxide – identificatie
2.2.13. Reactie van zinksulfaat met ammoniak

- Info: Wat wordt er gevormd wanneer zinksulfaat en ammoniak samen wordt gebracht? Bij het toevoegen van een weinig ammoniak aan de zinksulfaatoplossing ontstaat een witte neerslag. Verder toevoegen van de ammoniakoplossing zorgt ervoor dat de neerslag terug oplost.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zinksulfaat – ammoniak
- Thema: Anorganische stoffen – reactie zout en ammoniak
- Tijd: 20 min
- Begrippen: hydroxide – reacties anorganische stofklassen
2.2.14. Diffusie van ammoniakgas aantonen met koperionen
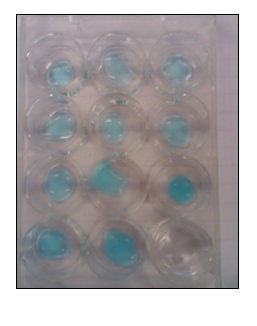
- Info: In het ammoniakexperiment worden de druppels CuSO4 geleidelijk donkerder blauw door vorming van Cu(OH)2 en dan donker blauw door vorming van Cu(NH3)42+. De kleur verandert en er ontstaat een patroon. Er ontstaat dus geen gelijkmatige verdeling. In het chloorexperiment vormen dijood met zetmeel zwarte complexen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: geconc NH3 – HCl 1 mol/l – KI 0,2 mol/l – CuSO4 0,5 mol/l – Zetmeeloplossing – Bleekwater
- Thema: Anorganische stoffen – complexreactie
- Tijd: 20 min
- Begrippen: hydroxide – diffusie
2.2.15. Een ammoniak fonteintje maken

- Info: Wat kunnen we zeggen over de oplosbaarheid van ammoniakgas in water? Het ammoniak zuigt het water naar boven. We krijgen een ammoniakfontein. Dat komt omdat het ammoniak zich wil vermengen met het water. Het gevolg is een onderdruk, waardoor het water wordt opgezogen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl (vast) – NaOH – oplossing (4 mol/l)
- Thema: Anorganische stoffen – oplosbaarheid gassen
- Tijd: 30 min
- Begrippen: hydroxide – oplosbaarheid
2.2.16. Reacties van ammoniak in een petrischaaltje

- Info: Hoe kunnen we een aantal eigenschappen van ammoniak visualiseren en gelijktijdig laten ontstaan?
- Moeilijkheid: eenvoudig
- Chemische stoffen: lakmoespapier – Ammoniak 1 mol/l – 0,1 mol/l HCl met universele indicator, – 0,1 mol/l kopersulfaat, – 0,1 mol/l ijzer(ll)sulfaat, – 0,1 mol/l ijzer(lll)nitraat, – 0,1 mol/l zinksulfaat,
- Thema: Anorganische stoffen – eigenschappen gas
- Tijd: 30 min
- Begrippen: hydroxide – eigenschappen ammoniak
2.3. Bariumhydroxide
2.3.1. De koudste coldpack

- Info: In welke verhouding moeten ammoniumchloride en bariumhydroxide bijeen worden gebracht om de sterkste endotherme reactie te bekomen? Een endotherme reactie is een reactie waarbij energie aan de omgeving wordt onttrokken. Hierbij moet voortdurend warmte worden toegevoegd om de dergelijke reactie te laten plaatsvinden. Bariumhydroxide en ammoniumchloride samen veroorzaken een endotherme reactie. Dat is te merken aan de temperatuursdaling.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniumchloride (NH4Cl) – Bariumhydroxide (Ba(OH)2. 8H2O)
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 10 min
- Begrippen: hydroxide – endotherme reactie
2.4. Calciumhydroxide
2.4.1. Bepaling van het oplosbaarheidsproduct van calciumhydroxide
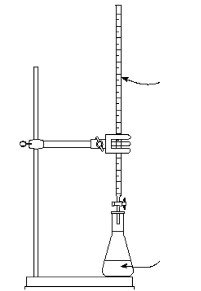
- Info: Hoe kunnen we het oplosbaarheidsproduct van calciumhydroxide met een kleine titratie bepalen. Titratie in een nunclonschaaltje
- Moeilijkheid: eenvoudig
- Chemische stoffen: verzadigde oplossing van calciumdihydroxide – fft 1% in ethanol 95% – 100 ml 0,1 mol/l HC
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 10 min
- Begrippen: hydroxide – titratie
2.4.2. Kalkwater als CO2 – indicator

- Info: Hoe kunnen we aantonen dat er meer koolstofdioxide zit in uitgeademde dan in ingeademde lucht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kalkwater
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 10 min
- Begrippen: hydroxide – identificatiereactie met kalkwater
2.5. Magnesiumhydroxide
2.5.1. Liesgangsche ringen met magnesium- en natriumhydroxide

- Info: Hoe kunnen we aantonen dat er meer koolstofdioxide zit in uitgeademde dan in ingeademde lucht?
- Moeilijkheid: gemiddeld
- Chemische stoffen:magnesiumchloride – gelatinepoeder – ammoniak geconc – natriumhydroxide
- Thema: Anorganische stoffen – chemisch evenwicht
- Tijd: 10 min
- Begrippen: hydroxide -liesegangse ringen – diffusie
2.6. Natriumhydroxide
2.6.1. Hydrolyse van eiwitten

- Info: Wat gebeurt er wanneer we een haar onderdompelen in een base?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH-korrels
- Thema: Anorganische stoffen – biochemie
- Tijd: 15 min
- Begrippen: hydroxide – corrosie – eiwitten
2.6.2. Hygroscopische werking van loog

- Info: Wat gebeurt er wanneer we NaOH blootstellen aan lucht? We stellen vast dat de NaOH-pastillen vochtig zijn geworden. Dit komt doordat de NaOH-pastillen hygroscopisch of wateraantrekkend zijn: ze trekken waterdamp uit de lucht aan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH-pastillen
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: hydroxide – corrosie
2.6.3. Reactie van loog en aluminium

- Info: Welk effect heeft natriumhydroxide (sterke base) op aluminium? We stellen vast het aluminium oplost in de NaOH-oplossing. Dit komt doordat Aluminium reageert met het NaOH.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1g NaOH-korrels (ontstopperkorrels) – Aluminiumfolie
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: hydroxide – vorming van waterstofgas
2.6.4. Thymolftaleïne oplossing als onzichtbare inkt

- Info: In een neutraal milieu is de boodschap niet zichtbaar. Door de boodschap te overschrijven met NaOH verschijnt de boodschap in blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: thymolftaleïne in druppelflesje (3 g op 97 ml ethanol 96%) – natriumhydroxideoplossing 1.0 M
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: hydroxide – zuur-base indicator
2.6.5. Reactie tussen natriumhydroxide, water en lucht

- Info: Hoe kunnen we de zuurgraad van uitgeademde lucht aantonen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Thymolftaleïne – Natriumhydroxide (NaOH) 1mol/l
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: hydroxide – zuur-base indicator
2.6.6. Reactie tussen ammoniumacetaat en loog

- Info: Welke stof wordt er gevormd bij het samenvoegen van ammoniumacetaat en loog? D.m.v. universeel indicatorpapier meten we een pH gelijk aan 10. De geur van ammoniak is waar te nemen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universeel indicatorpapier – Ammoniumacetaatoplossing verzadigd (CH3COONH4) – Natronloog 4 mol/l (NaOH)
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: hydroxide – reactie van zout en hydroxide
2.6.7. Het Plastic Blikje

- Info: Wat zal er overblijven wanneer een blikje wordt ondergedompeld in ontstopper? Er blijft een plastieken laag over na de reactie van het aluminium (van het blikje). Hierbij wordt aangetoond dat er een inwendige beschermlaag is in een blikje frisdrank en niet enkel een uitwendige beschermlaag (deze werd eraf geschuurd).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ontstopper (afvoerreiniger)
- Thema: Anorganische stoffen – eigenschappen hydroxiden
- Tijd: 15 min
- Begrippen: hydroxide – corrosie
3. Oxiden
3.1. Eitje bakken met calciumoxide

- Info: Calcium oxide reageert exothermisch met water en vormt Calciumdihydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ei – Calciumoxide
- Thema: Anorganische stoffen – thermodynamica
- Tijd: 15 min
- Begrippen:oxide – oploswarmte
3.2. Energie-uitwisseling door calciumoxide

- Info: Calcium oxide reageert exothermisch met water en vormt Calciumdihydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: water – calciumoxide
- Thema: Anorganische stoffen – thermodynamica
- Tijd: 15 min
- Begrippen:oxide – oploswarmte
3.3. Koolstofdioxide en waterig natriumhydroxide

- Info: Calcium oxide reageert exothermisch met water en vormt Calciumdihydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2 (g), 50 ml – NaOH(aq), 6 mol/l, 10 mL
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 15 min
- Begrippen:oxide – stofklassen – reactie oxide en hydroxide
3.4. Koolstofdioxide voorkomt branden

- Info: Wat als koolzuurgas zuurstofgas vervangt boven een brandende kaars? Geleidelijk dooft de kaars
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2 (g), 50 ml – kaarsje
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 15 min
- Begrippen:oxide -verbrandingsreactie
3.5. Omkeerbare omzetting van kopermetaal tot koperoxide en terug koper
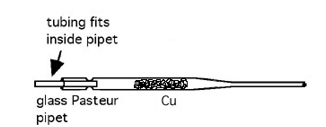
- Info:Verwarm de Cu-pipet gedurende 30s en blaas traag 60ml lucht door de pipet terwijl de pipet in de vlam blijft. De koper wordt zwart.Verbind de spuit met waterstofgas aan de pipet. Verhit de CuO-pipet en spuit traag waterstofgas in de pipet. Er ontstaan druppels water aan de wand van de pipet.
- Moeilijkheid: gemiddeld
- Chemische stoffen: wat koperpoeder of kleine stukjes – waterstofgas 50ml
- Thema: Anorganische stoffen – chemische reactie
- Tijd: 20 min
- Begrippen:oxide – stofklassen – wet van behoud van atomen
3.6. Reactie van koolzuurgas en water

- Info:Wat gebeurt er als we natriumcarbonaat en geconcentreerd zoutzuur bij elkaar mengen? Hoe kunnen we CO2 aantonen? Doordat CO2 met water gaat reageren tot een zuur, gaat de indicatoroplossing omslaan. Voordat zoutzuur aan de natriumcarbonaat werd toegevoegd, kleurde de universeel-indicator groen. Aangezien de petrischaal is afgedekt, kan het gas niet ontsnappen.Hierdoor reageert het gas met het gedemineraliseerd water met als gevolg dat de universeel-indicator in beperkte mate een rode kleur geeft aan de vloeistof. Dat is te wijten aan het feit dat koolzuur slecht oplosbaar is in water. De rode kleur wijst op een zure pH. Er is dus diwaterstofcarbonaat gevormd.Het kalkwater gaat reageren met koolstofdioxide tot water en zout.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Natriumcarbonaat – Geconcentreerd zoutzuur – Kalkwater
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 30 min
- Begrippen:oxide – stofklassen – identificatiereactie – zuur-base indicator
3.7. Reactie tussen mierenzuur en geconcentreerd zwavelzuur

- Info: Welk gas ontstaat bij het de ontleding van mierenzuur in een sterk zuur milieu? Bij deze verbranding komt zuiver CO vrij. Dit kan alleen bij de verbranding van mierenzuur gebeuren omdat deze de aldehydefunctie bezit waardoor het geoxideerd kan worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur – Mierenzuur
- Thema: Anorganische stoffen – organische stoffen
- Tijd: 25 min
- Begrippen: oxiden – alkanen – identificatiereactie
3.8. Reactie van koperoxiden en zwavelzuur

- Info: Hoe reageert koperoxide met zwavelzuur? De reactie tussen CuO en H2SO4 doet CuSO4 en H2O ontstaan, waardoor de oplossing neutraal wordt. Dit kunnen we waarnemen door de blauwe kleur. Metaaloxiden en zuren geven zout en water
- Moeilijkheid: gemiddeld
- Chemische stoffen: H2SO4 0,1 mol/.l 20ml – 1 g CuO
- Thema: Anorganische stoffen – reactie met oxide en zuur
- Tijd: 25 min
- Begrippen: oxiden -reactie oxide en zuur
3.9. Reacties met stikstofdioxide gas
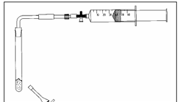
- Info: Hoe kunnen we in een kleine opstelling stikstofdioxide bereiden? Door reactie tussen bariumnitraat en ureum.
- Moeilijkheid: gemiddeld
- Chemische stoffen: bariumnitraat (watervrij) – ureumoplossing (c = 2 mol / l)
- Thema: Anorganische stoffen – organisch stoffen
- Tijd: 25 min
- Begrippen: oxiden – reactie met zout en ureum
3.10. Reductie van diijzertrioxide met waterstofgas

- Info: Wat gebeurt er als ijzer(III) in contact komt met waterstofgas? Het poeder wordt snel donker en er ontstaan druppels water aan de binnenkant van de pipet. Haal weg van de warmtebron en na afkoeling breng de magneet in de buurt van het ijzerpoeder.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 40ml waterstofgas – 0,25 g Fe2O3 – Magneet
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: oxiden – reactie metaaloxide en waterstofgas
3.11. Zuurgraad van koolstofdioxide

- Info: Wat gebeurt er als koolzuurgas in contact komt met ammoniakgas? Ammoniakgas neutraliseert het zure milieu bekomen door koolzuurgas.
- Moeilijkheid: gemiddeld
- Chemische stoffen: CO2 (g), 20 – 40 ml – universele indicator-oplossing, 10 ml (of rode kool sap oplossing) – geconcentreerde ammonia
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: oxiden – reactie niet-metaaloxide en ammoniak
3.12. Roest verwijderen met citroenzuur.

- Info: Hoe kan je corrosie verwijderen met citroenzuur? Citroenzuur is een zwak zuur, dit verwijdert de oxidelaag op de muntjes. Het zout versnelt het proces door zijn chloride ionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroensap of citroenzuur en zout – Bakje, bronzen muntjes
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: oxiden – reactie metaaloxide en zuur
3.13. SO2 in gedroogd fruit

- Info: Hoe kan SO2 aangetoond worden in gedroogd fruit?Bij de gedroogde rozijnen en abrikoos wordt het loodacetaat-papier bruin en er is een geur van rotte eieren. Dit is een aanwijzing voor de aanwezigheid voor SO2.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zn, – HCl 1 mol/l, H2O, l – loodacetaat-papier, – gedroogde abrikoos, gedroogde peer, gedroogde pruim,
- Thema: Anorganische stoffen – reactie stofklassen
- Tijd: 25 min
- Begrippen: oxiden – identificatiereactie
3.14. Reactie van zwaveldioxide met water

- Info: Wat gebeurt er als we natriumsulfiet en zwavelzuur bij elkaar mengen? Na toevoeging van het zwavelzuur aan de natriumsulfiet, vormt er zich een reactie waardoor er een gasvorming ontstaat. Aangezien de petrischaal is afgedekt, kan het gas niet ontsnappen.Hierdoor reageert het gas met het gedemineraliseerd water met als gevolg dat de universeel indicator rood/oranje kleurt. Dit wijst op een zeer zure pH.
Het betreffende kleurloze gas is zwaveldioxide en in reactie met water vormt het zwaveligzuur. - Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumsulfiet – Geconcentreerd zwavelzuur – Appel – Rode roos
- Thema: Anorganische stoffen – reactie stofklassen
- Tijd: 30 min
- Begrippen: oxiden – identificatiereactie – niet-metaaloxide
3.15. Luchtverontreiniging door zwaveldioxide
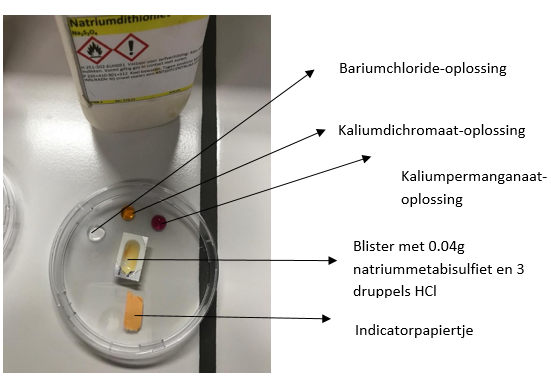
- Info: Hoe kan je luchtverontreiniging door SO2 aantonen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumdichromaat (2mol/l) – Kaliumpermanganaat (0,05mol/l) – Natriummetabisulfiet – Waterstofchloride (1mol/l) – Bariumchloride
- Thema: Anorganische stoffen – reactie stofklassen – redoxreacties
- Tijd: 30 min
- Begrippen: oxiden – identificatiereactie – niet-metaaloxide
3.16. Eigenschappen van oxiden

- Info: Hoe kan een metaaloxide bereid worden? Hoe kan je het gedrag van niet-metaaloxiden in water omschrijven? Hoe kan je het gedrag van metaaloxiden in water omschrijven?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Leidingwater – Stof die we uitademen – Broommethylblauw – Verbrandingsproduct van de eerste proef = magnesiumoxide (MgO) – Fenolftaleïne
- Thema: Anorganische stoffen – reactie stofklassen
- Tijd: 30 min
- Begrippen: oxiden – identificatiereactie – niet-metaaloxide – metaaloxide
3.17. Reactie van magnesiumoxide en water

- Info: Wat gebeurt er als een metaaloxide aan water wordt toegevoegd? Magnesium reageert met zuurstof om magnesiumoxide te vormen . Dit reageert met water om magnesiumhydroxide te vormen . Samen met water wordt een loog gevormd die de universele indicator blauw kleurt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 cm Mg-lint – 5 druppels universele indicatoroplossing – 20 ml water
- Thema: Anorganische stoffen – reactie stofklassen
- Tijd: 20 min
- Begrippen: oxiden – identificatiereactie -zuur-base indicator – metaaloxide
3.18. Reductie van koperoxide met houtskool

- Info: Wat gebeurt er als het metaaloxide van een edelmetaal wordt verhit met houtskool?De koolstof is minder edel dan koper . Er vindt dus een redoxreactie plaats.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 spatelpunten koperoxide – 2 spatelpunten houtskool
- Thema: Anorganische stoffen – reactie stofklassen – redoxreactie
- Tijd: 20 min
- Begrippen: oxiden – spanningsreeks
3.19. Reductie van koperoxide met ijzer

- Info: Wat gebeurt er als het metaaloxide van een edelmetaal wordt verhit met een minder edelmetaal? Het ijzer poeder ontbrandt door de warmte afkomstig van de gasbrander . Dit haalt de zuurstofgas uit het koper (II) oxide wanneer het brandt . Deze werkwijze maakt de koper (II) oxide in koper en ijzer poeder in ijzeroxide.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3,5 g koper(II)oxide – 2 g Fe-poeder
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: oxiden – spanningsreeks
3.20. Blussen met koolstofdioxide

- Info: Waarom wordt kooldioxide gebruikt om branden te blussen? Natriumwaterstofcarbonaat en zoutzuur reageren met elkaar. Het resultaat is kooldioxide . Kooldioxide heeft een hogere dichtheid dan lucht, dus de pneumatische kuip vult zich van onder naar boven. Ook de erlenmeyer voor het uitgieten van de kaarsvlam vult zich met kooldioxide . Het onzichtbare gas blijft in de erlenmeyer en kan als water worden
uitgegoten
.
Door de kooldioxide krijgt de kaarsvlam geen zuurstof meer en verstikt hij. - Moeilijkheid: eenvoudig
- Chemische stoffen: 3 lepels natriumbicarbonaat – 10 ml zoutzuur 0,5 mol/l
- Thema: Anorganische stoffen – gasvormingsreactie
- Tijd: 20 min
- Begrippen: oxiden – reactie met vorming van koolzuurgas
3.21. Productie van koolstofdioxide met sodafles

- Info: Waarom produceert de frisdrankautomaat “mineraalwater” met kooldioxide? De fles wordt gevuld met een liter water en in het frisdrankapparaat geschroefd.Door herhaaldelijk op de knop hierboven te drukken, wordt het proces van het bereiden van frisdrank gestart.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Frisdrankmachine – 1 l water – 1 koolzuurpatroon
- Thema: Anorganische stoffen – gasvormingsreactie
- Tijd: 20 min
- Begrippen: oxiden – reactie met vorming van koolzuurgas
3.22. Koolstofdioxidebestendig door kaars

- Info:De uitlaatgassen van de kaars worden door het kalkwater gezogen. Ze moeten kooldioxide bevatten omdat het kalkwater troebel wordt. De reactie tussen kooldioxide en kalkwater produceert in water onoplosbare kalksteen , die de troebelheid veroorzaakt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – 20 ml kalkwater
- Thema: Anorganische stoffen – gasvormingsreactie
- Tijd: 20 min
- Begrippen: oxiden – identificatiereactie van koolzuurgas
3.23. Broeikasgassen

- Info:Wat gebeurt er als mensen steeds meer kooldioxide in de atmosfeer uitstoten? Bij de reactie tussen natriumwaterstofcarbonaat en zoutzuur ontstaat onder meer kooldioxide (CO 2 ). Dit gas bedekt het aquarium als een soort dak. Licht dringt er doorheen, de warmtestralen worden terug in het aquarium gereflecteerd. Dit effect is ook bekend in kassen of wintertuinen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 30 g bakpoeder – 20 druppels HCl 0,5 mol/l
- Thema: Anorganische stoffen – eigenschappen koolzuurgas
- Tijd: 30 min
- Begrippen: oxiden – identificatiereactie van koolzuurgas
3.24. Koolstofdioxide detecteren

- Info:Hoe kun je koolstofdioxide detecteren? De reactie tussen zoutzuur en kalksteen produceert kooldioxide en calciumchloride .
De kooldioxide kan worden gedetecteerd met behulp van het kalkwater. Er ontstaat calciumcarbonaat – kalksteen! - Moeilijkheid: eenvoudig
- Chemische stoffen: 2 stukken kalksteen – 20 ml kalkwater – zoutzuuroplossing 0.1 mol/l
- Thema: Anorganische stoffen – eigenschappen koolzuurgas
- Tijd: 20 min
- Begrippen: oxiden – identificatiereactie van koolzuurgas
3.25. Bereiding van stikstofoxiden en zure regen

- Info:Hoe kun je chemie van zure regen aantonen? Verbrandingsprocessen produceren stikstofoxiden, die aanleiding kunnen geven tot zure regen. Stikstofoxiden lossen gemakkelijk op in regenwater en in oppervlakte water. Dit kan op microschaal worden aangetoond. Een bekertje gevuld met water en universeelindicator wordt in een plastic zakje gebracht met druksluiting.
- Moeilijkheid: eenvoudig
- Chemische stoffen: FeSO4.7H2O oplossing: 13,5 g FeSO4.7H2O oplossen in 36 ml gedestilleerd water en 4 ml geconcentreerd zwavelzuur toevoegen. – NaNO2
- Thema: Anorganische stoffen – eigenschappen stikstofoxiden
- Tijd: 20 min
- Begrippen: oxiden – identificatiereactie van stikstofoxiden – niet-metaaloxide
3.26. Reacties met zwaveldioxide

- Info: Hoe kunnen we neutralisaties en redoxreacties visualiseren in een petrischaaltje?Verschillende reacties met zwaveldioxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1g Na2S2O5 – 1mol/l HCl – 0,1mol/l NaOH + universele indicatorvloeistof – 1 mol/l BaCl2 – 0,02mol/l KMnO4 – 0,1 mol/l I2 – Blauw lakmoespapier – Rode kool
- Thema: Anorganische stoffen – redoxreacties – neutralisatiereacties
- Tijd: 20 min
- Begrippen: oxiden – identificatiereactie van zwaveldioxiden – niet-metaaloxide
4. Peroxiden
4.1. Blauw en oranje

- Info: Op welke manier katalyseren Cu(II)ionen de reactie tussen tartraat en zuurstofwater? Het tartraat reduceert Cu2+ tot het rode Cu+. Vervolgens wordt het Cu+ door het waterstofperoxide terug geoxideerd. Een deel van het tartraat valt daarbij uiteen in koolzuurgas en mierenzuur. Met soda wordt het aldus ontstane al te zure milieu wat geneutraliseerd waardoor ook weer het koper actief kan worden.
Uiteindelijk oxideert het peroxide al het tartraat. Op het eind kan men ook zwart koper(II)oxide in de beker waarnemen. - Moeilijkheid: gemiddeld
- Chemische stoffen: 110 ml ged. water (H2O) – 0,1 g Koper(II)sulfaat (CuSO4•5H2O) – 2,7 g Kaliumnatriumtartraat (KNaC4H4O6•4H2O) – 5 ml Waterstofperoxide 30% (H2O2) – 1 g Natriumcarbonaat (Na2CO3•nH2O) – KI oplossing 0,1 mol/l -CuSO4-oplossing 0,1 mol/l – Verzadigde Na2S2O3 oplossing
- Thema: Anorganische stoffen – redoxreacties – chemisch evenwicht
- Tijd: 30 min
- Begrippen: peroxiden – oscillerende reactie
4.2. Oscillerende reactie volgens Briggs

- Info: Welke kleurenwissel gebeurt er bij Briggs reactie? Tijdens de interactie van proces 1 met reactie B, kan de amberkleur waargenomen worden; de interactie van proces 2 met reactie B, leidt tot de donkerblauwe kleur.
- Moeilijkheid: gemiddeld
- Chemische stoffen: zetmeeloplossing 1% – vast malonzuur – H2O2 30% – aminosulfonzuur vast – mangaansulfaat vast – Natriumjodaat vast
- Thema: Anorganische stoffen – redoxreacties – chemisch evenwicht
- Tijd: 30 min
- Begrippen: peroxiden – oscillerende reactie
4.3. Bloedijs

- Info: Hoe kunnen we ijs maken met bloed? Het waterstofperoxide ontleedt zich in water en zuurstof. De vrijgekomen zuurstof heeft een sterk oxiderende kracht. De eiwitten in het bloed houden die zuurstof vast. Hierdoor krijgen we schuim. Je moet bloed gebruiken en niet gewoon eiwitten. Bij bloed zit er naast eiwitten ook Fe3+ ionen aanwezig. Deze hebben een katalyserende werking waardoor de reactie kan plaatsvinden.
- Moeilijkheid: gemiddeld
- Chemische stoffen:Bloed – Waterstofperoxide 30%
- Thema: Anorganische stoffen – redoxreacties
- Tijd: 30 min
- Begrippen: peroxiden – complexreactie
4.4. Een chemische vlag

- Info: Hoe zijn verschillende kleuren van magnesiumverbindingen boven elkaar te vormen?
- Moeilijkheid: gemiddeld
- Chemische stoffen: OplossingA: 500 ml NaOH 6M – OplossingB: 20 ml H2O2 0.1% – Azijnzuur – KMnO4
- Thema: Anorganische stoffen – redoxreacties
- Tijd: 30 min
- Begrippen: peroxiden – verschillende oxidatiegetallen van mangaan
4.5. Exotherme reactie met gedroogde gist

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van gist.Het gist bevat namelijk het catalase enzyme. Deze ontbinding is exotherm
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 pakketje of koffielepel gedroogde gist – 5% H202
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties – mechanische energie – katalysator
4.6. Inhibitiereacties bij ontleden van zuurstofwater

- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen en vertragen? Katalyserende en inhiberende werking op ontleding van zuurstofwater
- Moeilijkheid: gemiddeld
- Chemische stoffen: 0.1 mol/l Fe(NO3)3.9H2O – 30% H2O2 – 0.1 mol/l Na3PO4.10H2O
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties – inhibitor – katalysator
4.7. Maak de meeste olifantenpasta

- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen? Katalyserende en inhiberende werking op ontleding van zuurstofwater
- Moeilijkheid: gemiddeld
- Chemische stoffen: KI-oplossing (10 g in 10 ml water); – detergent; – gedestilleerd water; – H2O2 (30%).
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
4.8. Maak de mooiste instant cappuccino

- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen? Exotherme reactie waarbij het detergent zorgt voor het schuim. De kaliumpermanganaat kristallen blijven op het schuim drijven en zorgen voor het bovenste laagje van de cappuccino.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KMnO4, H2O2 30 % (5 ml) , vloeibaar detergent
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
4.9. Negatieve katalyse
- Info: Hoe beïnvloeden fosfaationen de ontleding van zuurstofwater gekatalyseerd door ijzerionen? Ijzer(III) ionen werken als katalysator bij de ontleding van waterstoperoxide. Fosfaten bouwen met de ijzer(III)ionen een complex, zodat het niet meer katalytisch actief is. Dit geldt eveneens met Mn(IV). Om deze reden wordt fosforzuur toegevoegd voor de stabilisering van H2O2
- Moeilijkheid: gemiddeld
- Chemische stoffen: Waterstofperoxide-oplossing (10%) – Fosforzuuroplossing (10%) – Geconcentreerde FeCl3-oplossing
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
4.10. Olifantenpasta voor kinderen

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van gist.Het gist bevat namelijk het katalase enzym. Deze ontbinding is exotherm. Het gevormde zuurstofgas doet de oplossing schuimen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10% H202 oplossing (eventueel te bekomen bij de apotheker. Let wel dat de oplossing redelijk vers is en minstens een 6% H2O2 )bevat – Actieve gist – Vloeibaar afwasmiddel
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 20 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
4.11. Omgekeerde regenboog

- Info: Hoe vormt H2O2 een omgekeerde regenboog? In het bekerglas met de katalysator verloopt de kleuromslag blauw-groen-geel-oranje-rood binnen een minuut, in het bekerglas zonder katalysator duurt dat veel langer (een kwartier tot een uur). Dit experiment toont niet alleen aan dat een katalysator de reactie versnelt, maar laat ook zien dat de niet-gekatalyseerde reactie binnen afzienbare tijd verloopt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: natriumthiosulfaat (Na2S2O3 x 5 H2O) – natriumacetaat (CH3COONa x 3 H2O ) – natriumhydroxide (NaOH) – universeelindicator – ammoniummolybdaat (NH4Mo7O24 x 4 H2O) – waterstofperoxide 30%
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: peroxiden – katalysator – oscillerende reactie
4.12. Pulserend schuimwijnglas

- Info: Hoe kunnen we een schuimwijn maken die blijft schuimen? In het experiment blijft het vrijgekomen zuurstof in oplossing. Als de oplossing in een verzadigde toestand het zuurstofgas bezit, schuimt het plotseling en komt een grote hoeveelheid vrij. Het verzadigingspunt wordt nu niet meer bereikt. Indien een nieuwe oververzadiging wordt bereikt komt terug gas vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)chloride – Zoutzuur (2mol/l) – Waterstofperoxide (10%)
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: peroxiden – katalysator – oscillerende reactie
4.13. Geest in een fles

- Info: Hoe kunnen we een geest in een fles oproepen met simpel materiaal uit het labo? Mangaandioxide treedt op als katalysator en versnelt de ontleding van waterstofperoxide waarbij gas en warmte ontstaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: H2O2 (30%) – Mangaandioxide
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: peroxiden – katalysator – ontledingsreactie
4.14. Piranha vloeistof

- Info: Hoe kan een spinazieblad in een vloeistof laten verdwijnen? Een Piranha-oplossing is een 7:3 mengsel van geconcentreerd zwavelzuur en een waterige oplossing van 30% waterstofperoxide, waarbij peroxomonozwavelzuur (Caro’s zuur) wordt gevormd.Het mengsel is een bijzonder krachtige oxidator die vrijwel alle organische moleculen wegoxideert en veel oppervlakken kan hydroxyleren (OH-groepen toevoegen).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerde H2SO4 – Geconcentreerde H202 (30%)
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zuren – corrosie
5. Zouten
5.1. Algemeen
5.1.1. Eigenschappen van elementen uit groep IIa

- Info: Neerslagreacties met de aardalkalimetalen op een geplastificeerd papier
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mg(NO3)2 0,5 mol/l – Ca(NO3)2 0,5 mol/l – Sr(NO3)2 0,5 mol/l – Ba(NO3)2 0,5 mol/l – NaOH 1 mol/l – KF 0,5 mol/l – NaCl 0,5 mol/l – KBr 0,2 mol/l – KI 0,2 mol/l – Na2CO3 0,5 mol/l – Na2SO4 0,5 mol/l
- Thema: Anorganische stoffen –neerslagreacties
- Tijd: 35 min
- Begrippen: zouten– neerslagen
5.1.2. Reacties met halogeniden

- Info: Neerslagreacties met de halogeniden op een geplastificeerd papier
- Moeilijkheid: eenvoudig
- Chemische stoffen: AgNO3 0,1 mol/l – LiBr 1 mol/l – Ca(NO3)2 0,5 mol/l – NaF 0,5 mol/l – NaCl 0,2 mol/l – KBr 0,2 mol/l – KI 0,2 mol/l
- Thema: Anorganische stoffen –neerslagreacties
- Tijd: 35 min
- Begrippen: zouten– neerslagen
5.1.3. Zuurheid van zuren en zouten

- Info: Hoe zuur zijn zuren en zouten? Als het azijnzuur volledig droog is, zal het indicatorpapier een ongewone kleur krijgen namelijk paars. Men zou een rode kleur verwachten. Wanneer magnesiumlint wordt toegevoegd ontstaan er luchtbellen in plaats van waterstofgasvorming. Met toevoeging van water is duidelijk een verschil waarneembaar.De laatste test gebeurt met stoffen die niet gerekend worden met de zuren, maar ze geven wel zure eigenschappen in water. Bismuthnitraat geeft een zwak zure oplossing in water wat heel traag met magnesium reageert.Magnesium gaat net iets feller reageren met azijnzuur, omdat azijnzuur een iets lagere pH heeft dan wijnsteenzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magnesiumlint – Azijnzuur – Wijnsteenzuur – AlCl3 gehydrateerd – Bi(NO3)3
- Thema: Anorganische stoffen –neerslagreacties
- Tijd: 35 min
- Begrippen: zouten– zuursterkte van zouten
5.1.4. Diffusie van zouten in water

- Info: Hoe verdelen zouten zich in water?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumpermanganaat – Kopersulfaat – Methyleenblauwoplossing – Natriumcarbonaat – Calciumcarbonaat
- Thema: Anorganische stoffen –stofeigenschappen
- Tijd: 35 min
- Begrippen: zouten– diffusie in water
5.1.5. pH van zoutoplossingen
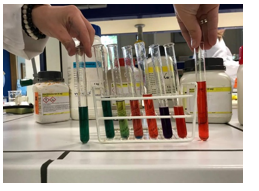
- Info: Hoe reageren zouten in een waterige oplossing? NaCl is afkomstig van een sterk zuur en sterke baseNa2CO3 is afkomstig van een zwak zuur en een sterke base: reageert basisch.NaHCO3 is afkomstig van een zwak zuur en een sterke base: reageert licht basisch.Na-acetaat is afkomstig van een zwak zuur en een sterke base: reageert zwak basisch. NH4Cl: is afkomstig van een zwakke base en een sterk zuur: reageert zuur
- Moeilijkheid: eenvoudig
- Chemische stoffen: verschillende zouten: ijzerchloride, natriumcarbonaat, ammoniumchloride, natriumchloride, natriumwaterstofsulfaat, natriumwaterstofcarbonaat, natriumacetaat, kopersulfaat
- Thema: Anorganische stoffen –neutralisatiereactie
- Tijd: 35 min
- Begrippen: zouten– zuursterkte van zouten
5.1.6. Watergehalte bepalen in gehydrateerde zouten

- Info: Hoe bepalen we het watergehalte van gehydrateerd kopersulfaat? Na het verwarmen wordt het gehydrateerd kopersulfaat wit.Tijdens het verwarmen ontstaat condens. Het verkregen wit poeder is watervrij kopersulfaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gehydrateerd kopersulfaat (CuSO4.5H2O)
- Thema: Anorganische stoffen – chemisch rekenen
- Tijd: 35 min
- Begrippen: zouten– kristalwater
5.2. Aluminiumzouten
5.2.1. Schuimvorming

- Info: Hoe kunnen we aantonen dat aluminiumkaliumsulfaat een protonendonor is? Donor van protonen aan natriumwaterstofcarbonaat
- Moeilijkheid: eenvoudig
- Chemische stoffen:Aluminiumkaliumsulfaat – Natriumwaterstofcarbonaat – Gedestilleerd water
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: zouten– protonendonor
5.2.2.De reactie tussen aluminiumsulfaat en natriumhydroxide

- Info: Wat wordt er gevormd wanneer aluminiumsulfaat en natriumhydroxide samen wordt gebracht? Bij de reactie tussen natriumhydroxide en aluminiumsulfaat wordt er een neerslag gevormd van aluminiumhydroxide.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Aluminiumsulfaat – natriumhydroxide
- Thema: Anorganische stoffen – reacties tussen zout en sterke base
- Tijd: 15 min
- Begrippen: zouten– sterke base verdrijft zwakke base uit zouten
5.3. Ammoniumzouten
5.3.1. Geleidbaarheid beïnvloeden door temperatuur

- Info: Hoe kunnen we de geleidbaarheid van ammoniumchloride beïnvloeden door temperatuurdaling? Zuiver water is niet geleidend. Indien hierin een zout zoals salmiak is opgelost gaan de vrije ionen geleiding veroorzaken.Wordt het water bevroren dan gaan de ionen niet meer vrij kunnen bewegen en vermindert de geleiding.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Demi water (20ml) – ammoniumchloride (10g) – Zout
- Thema: Anorganische stoffen – elektrische geleiding zouten
- Tijd: 15 min
- Begrippen: zouten– geleiding zouten
5.3.2. Kun je schrijven op glas?

- Info: Hoe kunnen we op glas schrijven? Het water verdampt en ammoniumchloride slaat neer, en blijft achter op het glas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: penseel; – geconcentreerde oplossing van ammoniumchloride in water; – vloeibare zeep.
- Thema: Anorganische stoffen – stofeigenschappen
- Tijd: 15 min
- Begrippen: zouten– verzadigde oplossing
5.3.3. Cold en hot packs

- Info: Welke zouten zijn te gebruiken voor het maken van een coldpack
- Moeilijkheid: eenvoudig
- Chemische stoffen:10 g NH4NO3 – 10 g CaCl2 – 10 g MgSO4
- Thema: Anorganische stoffen – thermodynamica
- Tijd: 15 min
- Begrippen: zouten– enthalpie – oplosbaarheidswarmte
5.3.4. Ammoniumchloride nevel vormen

- Info: Hoe kunnen NH4Cl nevel vormen? We stellen vast dat er witte ammoniumchloride wordt gevormd doordat de gec. Ammoniak en gec. HCl met elkaar reageren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gec. NH3 – Gec. HCl
- Thema: Anorganische stoffen – reacties stofklassen
- Tijd: 15 min
- Begrippen: zouten– enthalpie – zoutvorming uit zuur en base
5.3.5. Productie van twee gassen uit ammoniumchloride

- Info: Welke gassen ontstaan er als we ammoniumchloride verhitten? Een deel van het ammoniumchloride ontleedt. De gevormde ammoniak, lichter dan lucht, stijgt in de reageerbuis omhoog en kleurt het indicatorpapier blauw. De ammoniak verdwijnt uit de buis. Na enige tijd v erzamelt zich steeds meer HCl in de buis. Dat vormt voor een deel met nog aanwezig ammoniak weer salmiak en dat zichtbaar wordt als neerslag in de buis. Daarna krijgt waterstofchloride de kans langs de rand van de buis te ontsnappen, waarbij het gas het indicatorpapier rood kleurt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ammoniumchloride
- Thema: Anorganische stoffen – ontledingsreactie
- Tijd: 15 min
- Begrippen: zouten– enthalpie – ontleden van zout
5.3.6. Koperen spiegel bereiden

- Info: Hoe kunnen we een fijn koperlaagje vormen? Ammoniumchloride ontleedt met warmte. Op koper bevindt zich altijd een dun laagje koper(I) dat samen met het ontstane waterstofchloride wat koper(I)chloride vormt. Het koper(I)chloride ontleedt op de hete glaswand koper(II)chloride en koper: de koperspiegel
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 g ammoniumchloride (NH4Cl) – 0,5 g koperpoeder of -vijlsel (Cu)
- Thema: Anorganische stoffen – reacties met zouten
- Tijd: 15 min
- Begrippen: zouten– enthalpie – ontleden van zout
5.3.7. Walmende kousen

- Info: Hoe kunnen we een walm van damp vrijzetten uit sokken? Reactie ammoniak en zoutzuur
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH3 oplossing half verdund – HCl oplossing half verdund
- Thema: Anorganische stoffen – reacties stofklassen
- Tijd: 15 min
- Begrippen: zouten– enthalpie – zoutvorming uit zuur en base
5.3.8. Zelfgemaakte sneeuw

- Info: Hoe kunnen we binnen zelf sneeuw maken ondanks een warme temperatuur? Om het polymeer nog sterker absorberend te maken, wordt tijdens het polymerisatieproces wat acrylzuur toegevoegd waardoor een echt netwerk ontstaat.
Bij het opnemen van vocht zullen de natriumionen, die opgesloten zitten in de holtes tussen de polymeerketens, sterk hydrateren. Door de aantrekking door de carboxylaatanionen kunnen de natriumionen niet ontsnappen, maar komen ze wel op een grotere afstand van de negatief geladen groepen te zitten. Door de afstoting tussen de negatieve ladingen zal de polymeerketen zich strekken zodat de holtes in het netwerk groter worden en meer water kan geabsorbeerd worden. - Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumpolyacrylaat – Water
- Thema: Anorganische stoffen – kunststoffen
- Tijd: 15 min
- Begrippen: zouten– opnemen van vocht door polymeer
5.3.9. Ammoniumchloride
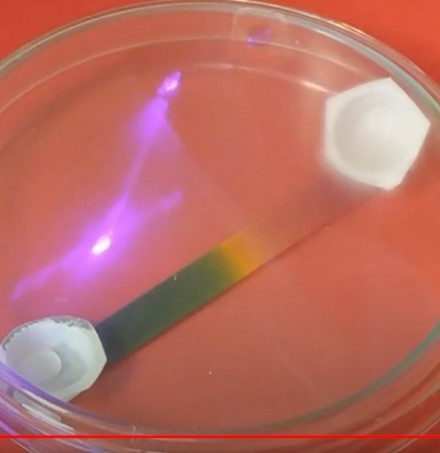
- Info: Hoe kun je een pH-gradiënt maken met zoutzuur en ammoniak?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerde HCl – 2 mol/l ammoniak – pH-indicatorpapier
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: zouten– werking van een zuur-base indicator
5.4. Bariumzouten
5.4.1. Bengaals vuur

- Info: Hoe kun je suiker hevig laten branden? Chloraten zijn zwakke oxidantia. Dit stijgt bij toevoeging van zwavelzuur. Het gevormde waterstofchloraat oxideert suiker waarbij een sterke exotherme reactie ontstaat met vorming van koolzuurgas en water.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KClO3- Suiker Ba(NO3)2 of Sr(NO3)2 of Cu(NO3)2 – H2SO4 gec
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zouten– bereiding buskruit
5.4.2. Sterretjes onder water

- Info: Branden sterretjes onder water? De sparkler-bundel brandt in de lucht met een zeer heldere vlam en sterke rondvliegende vonken. Bij het onderdompelen van de brandende sterretjes verdwijnen de vonken, in plaats daarvan zie je een heldere vlam, een heldere gloed , onder water . Er kan een heftige gasontwikkeling worden waargenomen. Het water wordt donkergrijszwart. Boven het water is een gele vlam te zien, die dooft zodra de sterretjes worden verbrand.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 10 sterretjes – Kleurloos plakband – Aansteker
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zouten– verbrandingsreactie
5.5. Calciumzouten
5.5.1. Brandend water

- Info: Kunnen we water laten branden? Ethanol vormt met calciumacetaat een gel: een verschijningsvorm van materie die het midden houdt tussen een vaste stof en een vloeistof. Een gel bestaat uit een netwerk van lange ketens (vaak polymeren) ondergedompeld in vloeistof. Beide componenten horen bij elkaar: de vloeistof zorgt ervoor dat het netwerk niet in elkaar klapt, terwijl het netwerk ervoor zorgt dat de vloeistof niet wegloopt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 50 ml ethanol 95% – 3 g calciumacetaat – diverse zouten, vb natrium- en bariumchloride
- Thema: Anorganische stoffen – bouw van atomen
- Tijd: 25 min
- Begrippen: zouten– vlamproef
5.5.2. Calciumcarbonaatfraktalen in kalkwater

- Info: Bij de reactie tussen calciumcarbonaat met zoutzuur ontstaat koolstofdioxide. Deze stijgt omhoog en bedekt ook het oppervlak van het kalkwater. Dit koolstofdioxide komt in contact met het verzadigde kalkwater en vormt hier een laag calciumcarbonaat.
- Moeilijkheid: gemiddeld
- Chemische stoffen: calciumcarbonaat – verzadigd kalkwater – zoutzuur 4M
- Thema: Anorganische stoffen – reacties tussen anorganische stofklassen
- Tijd: 25 min
- Begrippen: zouten– vorming van koolzuurgas
5.5.3. De gekleurde vlam

- Info: Kunnen we water laten branden? Ethanol vormt met calciumacetaat een gel: een verschijningsvorm van materie die het midden houdt tussen een vaste stof en een vloeistof. Een gel bestaat uit een netwerk van lange ketens (vaak polymeren) ondergedompeld in vloeistof. Beide componenten horen bij elkaar: de vloeistof zorgt ervoor dat het netwerk niet in elkaar klapt, terwijl het netwerk ervoor zorgt dat de vloeistof niet wegloopt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 100 ml ethanol 96%, – 4 gram calciumacetaat monohydraat – 14 ml water – Verschillende zouten (NaCl, CuSO4)
- Thema: Anorganische stoffen – bouw van atomen
- Tijd: 25 min
- Begrippen: zouten– vlamproef
5.5.4. De gekleurde vlam in een gel

- Info:Kunnen we water laten branden? Los 4 g calciumacetaat H2O op in ca. 14 ml water en breng dit in een 150 ml bekerglas of een glazen potje. Vul een tweede bekerglas met 100 ml ethanol. Voeg de beide oplossingen samen in een porseleinen schaal (eventueel een paar maal heen en weer schenken). Er ontstaat een gelatineuze massa.
- Moeilijkheid: gemiddeld
- Chemische stoffen: ethanol 96%, – calciumacetaat monohydraat- Verschillende zouten (NaCl, CuSO4)
- Thema: anorganische stoffen – bouw van atomen
- Tijd: 25 min
- Begrippen: zouten– vlamproef
5.5.5. Koolstof uit eierschalen

- Info: Op welke manier kunnen we koolstof bereiden uit eierschalen? Eierschalen bevatten calciumcarbonaat. Dit gaat met magnesium koolstof vormen. Het wit licht dat tijdens de verbranding ontstaat, is afkomstig van het magnesium en de oranje vonkjes zijn afkomstig van het calciumcarbonaat in de eierschalen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Droge eierschalen – Magnesiumpoeder – Zoutzuur 1mol/l
- Thema: anorganische stoffen– redoxreactie
- Tijd: 15 min
- Begrippen: zouten – verdringingsreactie metalen
5.5.6. Maak de hoogste zouttoren

- Info: Hoe kan ik binnen 20 minuten de hoogste natriumacetaattoren verkrijgen door maximaal 10 gram natriumacetaat te gebruiken? De oplosbaarheid van natriumacetaat is ca 76g/100ml bij het kookpunt van water. Beneden de 50°C kristalliseert het trihydraat van dit zout. Als er in de oplossing geen entkristal aanwezig is, ontstaat een onderkoelde oplossing. Kristallisatie blijft achterwege. Als kristallisatie optreedt dankzij een of andere aanzet (zoals een entkristal of trilling), dan gaat deze sneller naarmate de onderkoeling groter is.
- Moeilijkheid: gemiddeld
- Chemische stoffen: natriumacetaat ( max. 10 g per beurt; 250g in totaal) – gedemineraliseerd water
- Thema: anorganische stoffen – neerslagreactie
- Tijd: 15 min
- Begrippen: zouten –oververzadigde oplossing
5.5.7. Maken van een aanmaakblokje

- Info: Hoe maak je een aanmaakblokje? De ethanol en calciumacetaat vormen een gel. Een gel is een verschijningsvorm die de materie in het midden houdt tussen een vaste stof en een vloeistof.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Calciumacetaat – Ethanol – Water
- Thema: anorganische stoffen – neerslagreactie
- Tijd: 20 min
- Begrippen: zouten – gelvorming – oververzadigde oplossing
5.5.8. Neerslag van calciumfosfaat

- Info: Hoe beïnvloedt natriumcitraat de reactie tussen een calciumchlorideoplossing, water en een kaliumfosfaatoplossing ? De citraationen bouwen met de calciumionen een stabiel complex. De concentratie van de vrije Ca-ionen daalt hierdoor zo sterk dat het oplosbaarheidsproduct van calciumfosfaat niet wordt overschreden waardoor neerslagvorming uitblijft.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Water – Calciumchloride dihydraat – Kaliumfosfaat – Natriumcitraat
- Thema: anorganische stoffen – neerslagreactie
- Tijd: 20 min
- Begrippen: zouten – oplosbaarheid
5.5.9. Plooi een bot met azijn

- Info: Hoe kunnen we botten plooien, week maken? In een bot zit kalk en collageen. De kalk zorgt voor de hardheid van een bot, het collageen zorgt voor de elasticiteit van een bot. Kalk lost langzaam op in azijn, maar collageen niet. Na een week is een groot deel van de kalk uit het bot opgelost en dus verliest het bot zijn hardheid. Collageen lost niet op in azijn en het bot verliest daardoor niet zijn elasticiteit. Je kunt het bot dat een week in de azijn heeft gezeten buigen, omdat de kalk is opgelost en het overgebleven collageen flexibel is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kippenbot – Azijn
- Thema: anorganische stoffen – reactie zuur en zout
- Tijd: 15 min
- Begrippen: zouten – vorming van koolstofdioxide
5.5.10. Verlicht het lokaal met de kleurrijkste gelkaarsjes

- Info: Welke zouten kan je aan een brandbare gel toevoegen om zoveel mogelijk kleuren te bekomen? Ethanol vormt met calciumacetaat een gel: een verschijningsvorm van materie die het midden houdt tussen een vaste stof en een vloeistof. Een gel bestaat uit een netwerk van lange ketens (vaak polymeren) ondergedompeld in vloeistof. Beide componenten horen bij elkaar: de vloeistof zorgt ervoor dat het netwerk niet in elkaar klapt, terwijl het netwerk ervoor zorgt dat de vloeistof niet wegloopt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanol; – calciumacetaatmonohydraat; – metaalzouten
- Thema: anorganische stoffen – neerslagreactie
- Tijd: 20 min
- Begrippen: zouten– gelvorming – oververzadigde oplossing – vlamproef
5.5.11. Vriespunt verlagen door calciumchloride

- Info: Welke invloed heeft calciumchloride op het vriespunt van water? Calciumchloride zorgt voor een zeer grote vriespuntdaling. Dit door de aanwezigheid van 2 chloorionen. Doordat dit veel minder milieuvriendelijk is, gebruiken strooidiensten calciumchloride enkel bij zeer steng vriesweer.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ijsblokjes, – vast calciumchloride
- Thema: anorganische stoffen– thermodynamica
- Tijd: 20 min
- Begrippen: oploswarmte – zouten
5.5.12. Samenstelling van eierschalen, mosselschelpen en krijt

- Info: Hoe kan je CO2 uit eierschalen, mosselschelpen en krijt bekomen? Aangezien eischalen hoofdzakelijk calciumcarbonaat (kalk) bevatten is er bij bemesting een duidelijk pH effect waarneembaar. Bij standaard carbonaatkalk meststof is het effect van korte duur doordat het zeer geconcentreerd is. Bij eierschalen daarentegen zit het calciumcarbonaat veel fijner in de schalen waardoor het effect over een langer tijd gespreid wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Krijt – Mosselschelpen – Eierschalen – HCl (10%) – Azijnzuur (25%)
- Thema: anorganische stoffen– reactie zout en zuur
- Tijd: 25 min
- Begrippen: oploswarmte – zouten – vorming koolstofdioxide
5.6. Chroomzouten
5.6.1. Chromaatkristallen (proeven niet uitvoeren in de klas wegens chroomverbinding)

- Info: Wat zal er gebeuren met de gele oplossing van ammoniumdichromaat, water en sterke ammoniak als men het enkele dagen in een petrischaaltje laat staan? In een ammonium(di)chromaatoplossing ontstaat een evenwicht tussen chromaat en dichromaat, al naar gelang de ammoniakconcentratie. Door toevoegen van ammonia verschuift het evenwicht naar rechts. Door de overmaat ammonia veranderen de oranje dichromaationen overwegend in gele chromaationen. Bij het indrogen verdampt er ammoniak en schuift het evenwicht weer naar links: de oranje dichromaationen worden gevormd.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 2 ml ged. water (H2O); – 0,1 g ammoniumdichromaat ((NH4)2Cr2O7); – 2 ml ammoniak 25% (NH3 (aq)).
- Thema: anorganische stoffen– reactie zout en base
- Tijd: 25 min
- Begrippen: zouten – kristallisatie
5.6.2. De alcoholtest (proeven niet uitvoeren in de klas wegens chroomverbinding)

- Info: Wat zal er gebeuren als ethanol in contact komt met kaliumdichromaat? Na een minuut ontstaat een groene kleur van Cr3+ in de dichromaatoplossing welke geleidelijkaan de oranje kleur omzet naar geel-groen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 5% K2Cr2O7 oplossing – H2SO4 geconcentreerd – Ethanol 97%
- Thema: anorganische stoffen– redoxreactie – organische stoffen
- Tijd: 25 min
- Begrippen: zouten – identificatie ethanol
5.6.3. De kloppende druppel (proeven niet uitvoeren in de klas wegens chroomverbinding)

- Info: Breng de kwik op een petrischaaltje. Overgiet het met de zwavelzuuroplossing totdat de kwik onder staat. Breng nu een nagel zodat deze steekt in het zwavelzuur en juist contact maakt met de kwik. De kwikdruppel begint plots te trillen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 1.5 ml kwik – 6 mol/l H2SO4 – 0.1 mol/l K2Cr2O7
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 15 min
- Begrippen: zouten – oscillerende reactie
5.6.4. Elektroforese (proeven niet uitvoeren in de klas wegens chroomverbinding)
- Info: Door de complexering van het koper(II)ion met ammoniak K = 7,1 10-14 is de concentratie te laag om met het chromaation een neerslag te vormen. Bij het ompolen zullen de kleuren door diffusie niet meer geheel mengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: agar-agar – Kaliumnitraat – 0.1 mol/l kopersulfaat – 0.1 mol/l kaliumchromaat – Geconcentreerd ammoniak
- Thema: anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zouten – endo-energetische reactie – elektrolyse
5.6.5. Geheime boodschap met ammoniumdichromaat (proeven niet uitvoeren in de klas wegens chroomverbinding)

- Info: Hoe kan men stikstofgas verkrijgen uit ammoniumdichromaat? Door het verwarmen van ammoniumdichromaat, ontstaat er door ontleding stikstofgas, chroomoxide en water.
- Moeilijkheid: gemiddeld
- Chemische stoffen: ammoniumdichromaat – gedestilleerd water
- Thema: anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zouten – gasvorming door redoxreactie
5.6.6. Liesegangsche ring met koperchromaat (proeven niet uitvoeren in de klas wegens chroomverbinding)

- Info: Hoe kan men met een chroomzout een reeks Liesegangse ringen worden gevormd? Door reactie tussen koperzout en een chromaatzout
- Moeilijkheid: gemiddeld
- Chemische stoffen: natriumsilicaat – kaliumchromaat – azijnzuuroplossing – kopersulfaat
- Thema: anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zouten –Liesegangse ringen
5.6.7. Liesegangsche ringen (proeven niet uitvoeren in de klas wegens chroomverbinding)

- Info: Wat gebeurt er als we in een mengsel van kaliumdichromaat en gelatinepoeder na geleren een druppel zilverchloride oplossing brengen? Als de chromaationen bevattende gel eenmaal vast is plaatsen we de zilvernitraat oplossing boven op de gel. De zilverionen diffunderen in de gel waar ze in contact komen met de chromaationen. Het gevormde zilverchromaat slaat neer
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine poeder – Kaliumdichromaat – Zilvernitraatoplossing 1 mol/l
- Thema: anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zouten –Liesegangse ringen
5.6.8. Maken van een verkeerslicht

- Info: Water en alcohol worden in verhouding 1:1 gemengd. Met roeren wordt zo lang kaliumcarbonaat toegevoegd tot een verzadigde oplossing ontstaat. Er vormt hierbij een alcoholische fase af van de verzadigde oplossing. Een spatelpunt kopersulfaat vormt de waterige fase blauw. Enkele korrels kaliumdichromaat zorgt voor een groen mengkleur.De alcoholische fase wordt met een spatelpunt methylrood gekleurd. De petroleumether met sudanIII zorgt voor de derde kleur.
- Moeilijkheid: gemiddeld
- Chemische stoffen: kaliumcarbonaat – kopersulfaatpentahydraat – kaliumdichromaat – methylrood – sudanIII
- Thema: anorganische stoffen – chemische reacties – complexreacties – redoxreacties
- Tijd:30 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.7. Ijzerzouten
5.7.1. Bewegingen in een petrischaal

- Info: Vul de petrischaal half met water. Breng aan één kant een spatelpunt K4Fe(CN)6, aan een andere zijde een spatelpunt NH4SCN en aan een derde zijde de FeCl3. Er ontstaat een rode en een blauwe linie en ook geen verkleuring.
- Moeilijkheid: gemiddeld
- Chemische stoffen: K4Fe(CN)6 – NH4SCN – FeCl3
- Thema: anorganische stoffen – chemische reacties – complexreacties – redoxreacties
- Tijd:30 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.7.2. Gekleurd geheimschrift

- Info: Verschillende kleuren door complexvorming met ijzerzouten
- Moeilijkheid: eenvoudig
- Chemische stoffen: sproeier – K4Fe(CN)6 – NH4SCN – FeCl3.6H2O
- Thema: anorganische stoffen – chemische reacties – complexreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.7.3. De eigenschappen van Fe(II) en Fe(III)-zouten

- Info: Verschillende kleuren en reacties met de verschillende ijzerzouten met OG +II en +III
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1 mol/l – KMnO4 0,01 mol/l – KI 0,2 mol/l – FeSO4 0,2 mol/l – Fe(NO3)3 0,2 mol/l – AgNO3 0,2 mol/l – KSCN 0,1 mol/ – Zetmeel 1% vers
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.7.4. De paarse kleurfles

- Info:Waarom verdwijnt de paarse kleur? Waarom keert de kleur terug als je met de fles schudt? Cysteïne (een aminozuur met een thiolgroep)heeft als systematische naam (2R)-2-amino-3-sulfanylpropaanzuur. In de reactie gaat het om twee complexen waarvan er een een kleur heeft:het cysteïne-Fe2+ complex is kleurloos, het cysteïne-Fe3+ complex paarsblauw. Cysteïne reduceert Fe(III) tot Fe(II). Daarbij ontstaat cystine, Cys-S-S-Cys.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Cysteïne – NaHCO3 (= bakpoeder) – 1M FeCl3x 6 H2O-oplossing
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.7.5. Groei van kristallen door osmose

- Info: De ferrocyanide ionen en de koperionen reageren ter vorming van een colloïdaal half permeabel membraan rond de kopersulfaat kristallen.Water beweegt door het membraan als de kopersulfaatcellen oplossen wat een verhoging van osmotische druk geeft in het membraan en de cellen doet vergroten.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 100ml 3% K4Fe(CN)6.3H20 – 6-8 kleine kristallen kopersulfaat (kopspeld groot)
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.7.6.Ijzerevenwicht

- Info: Complexreacties met ijzer(III)ionen met vorming van verschillende kleuren
- Moeilijkheid: gemiddeld
- Chemische stoffen: FeCl3 0.2 g/100 ml – KSCN 0.2 g/100 ml – K4Fe(CN)6 1g/100 ml – tanninezuur 0.2 g/100 ml – salicylzuur 0.2 g/100 ml – EDTA 2g/100 ml
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.7.7. Inhibitiereacties bij ontleden van zuurstofwater

- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen en vertragen? Katalyserende en inhiberende werking op ontleding van zuurstofwater
- Moeilijkheid: gemiddeld
- Chemische stoffen: 0.1 mol/l Fe(NO3)3.9H2O – 30% H2O2 – 0.1 mol/l Na3PO4.10H2O
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: zouten – exo-energetische reacties – inhibitor – katalysator
5.7.8. Kunstbloed

- Info: Hoe kun je kunstbloed maken? Vormen van ijzerthiocyanaat-oplossing geeft de bloedkleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen:KSCN – FeCl3
- Thema: anorganische stoffen – reacties -complexreactie
- Tijd:10 min
- Begrippen: zouten – onderscheid fysisch en chemisch – kleurverandering
5.7.9. Negatieve katalyse

- Info: Hoe beïnvloeden fosfaationen de ontleding van zuurstofwater gekatalyseerd door ijzerionen? Ijzer(III) ionen werken als katalysator bij de ontleding van waterstoperoxide. Fosfaten bouwen met de ijzer(III)ionen een complex, zodat het niet meer katalytisch actief is. Dit geldt eveneens met Mn(IV). Om deze reden wordt fosforzuur toegevoegd voor de stabilisering van H2O2
- Moeilijkheid: gemiddeld
- Chemische stoffen: Waterstofperoxide-oplossing (10%) – Fosforzuuroplossing (10%) – Geconcentreerde FeCl3-oplossing
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: zouten – peroxiden – exo-energetische reacties –katalysator
5.7.10. Omkeerbare reactie onder invloed van licht

- Info:Kunnen we een stof laten ontkleuren door er licht op te schijnen ? Thionine is een organische verbinding die in twee vormen kan voorkomen: een kleurloze gereduceerde vorm, en een paarse, geoxideerde vorm. Het kan gebruikt worden als een redoxindicator. Wanneer een reductor, zoals Fe2+-ionen, toegevoegd wordt aan een zure thionine-oplossing, dan wordt deze omgezet in de kleurloze gereduceerde vorm, terwijl Fe2+ geoxideerd wordt naar Fe3+.
- Moeilijkheid: moeilijk
- Chemische stoffen: FeSO4.7H2O, 2,0 g – H2SO4-oplossing, 1 mol.l-1 – thionine-oplossing 0,001 mol.l-1
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd 30 min
- Begrippen: zouten – endo-energetische reacties – fotolyse – omkeerbare reactie
5.7.11. Synthese van Pruisisch blauw

- Info:Wat gebeurt er als we een oplossing van ijzerchloride en kaliumhexacyanoferraat samenvoegen? Pruisisch blauw is vooral bekend als een blauw pigment dat gebruikt wordt in verf en vroeger in blauwdrukken. Het staat bekend onder veel verschillende chemisch namen IJzer (III) ferrocyanide, ferri ferrocyanide, IJzer (III) hexacyanoferraat, en ferrihexacyanoferraat. Pruisisch blauw kan ook als complexvormer (chelaat) optreden en wordt soms gebruikt als antidotum bij vergiftigingsgevallen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzertrichloride – Kaliumhexacyanoferraat (ll)
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd 30 min
- Begrippen: zouten – endo-energetische reacties – fotolyse – omkeerbare reactie
5.7.12. Thermochemie

- Info: Hoe kunnen we fotochemische reacties van Tris(oxalate)iron (III) verkrijgen? Het tris(oxalato)ferrate(III)-ion wordt gemaakt door oxaalzuur en ijzer(III)nitraat samen te voegen. Het tris(oxalato)ferrate(III)-ion is gevoelig aan licht. Als het licht observeert ondergaat het een fotoreductie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fe(C2O4)33-
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: zouten – endo-energetische reacties – fotolyse- thermochemie
5.7.13. Thixotropie

- Info: Hoe kunnen we het bloedwonder van Napels nadoen? Door een tik te geven vervloeit de gel spontaan. Terug stil laten staan zorgt terug voor gel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzer(III)chloridehexahydraat – calciumcarbonaat – NaCl – water
- Thema: anorganische stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen: zouten – endo-energetische reacties – thixotropie
5.7.14. Reacties met ijzerverbindingen

- Info: Welke verbindingen kunnen met ijzer-ionen gevormd worden? Reeks van complex-, neerslag- en redoxreacties
- Moeilijkheid:gemiddeld
- Chemische stoffen: 0,5 cm magnesiumlint – NaOH-oplossing 0,4mol/l – gedemineraliseerd water – HCl-oplossing 1 mol/l – H2O2-oplossing 20 vol% – Na2S2O3-oplossing 0,5 mol/l – K4Fe(CN)6.3H2O-oplossing 0,1 mol/l – KSCN-oplossing 0,1 mol/l – magneet
- Thema: anorganische stoffen – neerslagreacties – redoxreacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten
5.7.15. Ijzersulfaat in zuur en basisch milieu

- Info: Hoe reageert ijzersulfaat wanneer we deze in een basische en zure oplossing brengen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzersulfaat – natronloog = natriumhydroxide – zoutzuur
- Thema: anorganische stoffen – neerslagreacties
- Tijd: 20 min
- Begrippen: zouten – reacties in milieus
5.7.16. Ijzernitraat in zuur en basisch milieu

- Info: Wat gebeurt er als we ijzernitraatoplossing in een zuur of in een base milieu brengen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universeel indicatorpapier – Ijzer(III)nitraatoplossing 0,1 mol/l (Fe(No3)3.9H2O) – Zoutzuur 1 mol/l (HCl) – Natronloog 1 mol/l (NaOH)
- Thema: anorganische stoffen – neerslagreacties
- Tijd: 20 min
- Begrippen: zouten – reacties in milieus
5.8. Kaliumzouten
5.8.1. Bengaals vuur

- Info: Hoe kun je suiker hevig laten branden? Chloraten zijn zwakke oxidantia. Dit stijgt bij toevoeging van zwavelzuur. Het gevormde waterstofchloraat oxideert suiker waarbij een sterke exotherme reactie ontstaat met vorming van koolzuurgas en water.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KClO3 – Suiker – Ba(NO3)2 of Sr(NO3)2 of Cu(NO3)2 – H2SO4 gec
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: zouten – exo-energetische reacties – warmte- buskruit
5.8.2. Vuur schrijven

- Info: Kunnen we met vuur schijven?
- Moeilijkheid: eenvoudig
- Chemische stoffen: KClO3
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: zouten – exo-energetische reacties – warmte- buskruit – verbrandingsreactie
5.8.3. De geest in een fles

- Info: Hoe kunnen we een geest in een fles oproepen met simpel materiaal uit het labo? Mangaandioxide treedt op als katalysator en versnelt de ontleding van waterstofperoxide waarbij gas en warmte ontstaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: H2O2 (30%) – Mangaandioxide
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: zouten – peroxiden – katalysator – ontledingsreactie
5.8.4. Kaliumchloraat en rode fosfor

- Info: Waarom bevat een luciferkop kaliumchloraat en het wrijvingsoppervlak fosfor? Waarom worden beide stoffen apart van elkaar opgeslagen? Het kaliumchloraat is een zeer goede zuurstofdispenser , die met de meeste organische brandbare materialen (zoals meel , poedersuiker heftig reageert, puddingpoeder). Samen met rode fosfor wordt een ontvlambaar mengsel gevormd, dat in vergelijkbare vorm in lucifers wordt gebruikt. Het mengsel ontsteekt zelfs bij lichte wrijving
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 spatelpunt kaliumchloraat – 1 spatelpunt rode fosfor
- Thema: anorganische stoffen – enkelvoudige stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: zouten – peroxiden – katalysator – ontledingsreactie
5.8.5. Kaliumchloraat en houtskool

- Info: Wat gebeurt er als je houtskool laat reageren met kaliumchloraat in plaats van een gummibeertje? Kaliumchloraat ontleedt bij verhitting boven 550 ° C tot kaliumchloride en zuurstof .De zuurstof bevordert de verbranding van houtskool, die dan helder oplicht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 stukje houtskool – 1 spatelpunt kaliumchloraat
- Thema: anorganische stoffen – enkelvoudige stoffen – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: zouten – peroxiden – katalysator
5.8.6. Rood Bengaals vuur

- Info: Hoe maak je rood Bengaals vuur? Het mengsel brandt af met een sterke rookontwikkeling met een intens rode vlamkleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 6 g kaliumchloraat – 3 g sucrose – 3 g strontiumnitraat
- Thema: anorganische stoffen – enkelvoudige stoffen – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: zouten – peroxiden – vlamproef – bereiding buskruit
5.8.7. Groen Bengaals vuur

- Info: Hoe maak je groen Bengaals vuur? Het mengsel brandt af met een sterke rook en een intens groene kleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 6 g kaliumchloraat – 3 g sucrose – 3 g bariumnitraat
- Thema: anorganische stoffen – enkelvoudige stoffen – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: zouten – peroxiden – vlamproef – bereiding buskruit
5.9. Kobaltzouten
5.9.1.Een geactiveerd complex (proef niet uitvoeren in de klas wegens kobaltverbinding)

- Info: Wat gebeurt er met de paars gekleurde oplossing van natriumkaliumtartraat en waterstofperoxide als we kobaltchloride toevoegen? Het Co2+ dient als katalysator en wordt tijdelijk geoxideerd tot Co3+ en dan terug tot Co2+.Bij de reactie ontstaan O2 en CO2 en zorgen in de oplossing voor een troebel.Indien de proef uitgevoerd wordt bij lage temperatuur, is de groene kleur langer zichtbaar
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200 ml natriumkaliumtartraat 0,3 mol/l; – 65 ml 6% H2O2; – 15ml CoCl2 oplossing 0,3 mol/l.
- Thema: anorganische stoffen – redoxreactie – chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – oscillerende reactie
- Info:Toevoeging van water verandert de blauwe alcoholische oplossing van CoCl2 van blauw naar paars. Toevoeging van KCl aan de ethanol CoCl2 oplossing veroorzaakt ook een verandering van blauw naar paars. Sterke dehydraterende condities zijn nodig om een blauw CoCl42- te bekomen van paars Co(H20)62+
- Moeilijkheid: gemiddeld
- Chemische stoffen: CoCl2 waterige oplossing 0,1 mol/l – CoCl2 ethanoloplossing 0,1 mol/l – Geconc HCl – Gec H2SO4 – KCl 0,1 mol/l – KCl poeder
- Thema: anorganische stoffen – redoxreactie – chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – invloeden op chemisch evenwicht
5.9.3. Liesegangsche ring met hexaaminokobalt (proef niet uitvoeren in de klas wegens kobaltverbinding)

- Info: Op welke manier ontstaan Liesegangse ringen? Reactie met vorming van een kobaltcomplex waar afhankelijk van concentratie een afzetting gebeurt
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine – CoCl2 – Geconcentreerde ammoniak
- Thema: anorganische stoffen – liesegangse ringen- chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – diffusie
5.9.4. Nauwkeurige thermometer (proef niet uitvoeren in de klas wegens kobaltverbinding)

- Info: Wat is de temperatuur waarbij de oplossing van kleur verandert?
- Moeilijkheid: gemiddeld
- Chemische stoffen: CoCl2.6H2O 1 mol/l – Ethanol
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – invloed van temperatuur
5.9.5. Pulserende schuimwijn (proef niet uitvoeren in de klas wegens kobaltverbinding)

- Info: Hoe kunnen we een schuimwijn maken die blijft schuimen? In het experiment blijft het vrijgekomen zuurstof in oplossing. Als de oplossing in een verzadigde toestand het zuurstofgas bezit, schuimt het plotseling en komt een grote hoeveelheid vrij. Het verzadigingspunt wordt nu niet meer bereikt. Indien een nieuwe oververzadiging wordt bereikt komt terug gas vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)chloride – Zoutzuur (2mol/l) – Waterstofperoxide (10%)
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: zouten – peroxiden – katalysator – oscillerende reactie
5.9.6. Kobaltcomplexen (proef niet uitvoeren in de klas wegens kobaltverbinding)

- Info: Welke complexen kan je met kobaltionen vormen? Kobalt(II)chloride vormt een complex als er water wordt toegevoegd. Als er ander stof (bv. zoutzuur of aceton) wordt toegevoegd, gaan het complex verdwijnen omdat er in verhouding minder water aanwezig is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: CoCl2-oplossing 0,5 mol/l – aceton – geconcentreerd zoutzuur (c > 40 %)
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: zouten – katalysator – invloeden op chemisch evenwicht
5.9.7. Reactie tussen kobaltchloride en water (proef niet uitvoeren in de klas wegens kobaltverbinding)

- Info: Wat gebeurt wanneer kobaltchloride onttrokken wordt van water en omgekeerd? Wanneer kobaltchloride hexa aqua wordt verwarmd boven de bunsenbrander zien we dat de kobalchloridepoeder licht blauw kleurt. Wanneer er na deze bevinding terug water aan wordt toegevoegd, zien we dat de poeder terug roze wordt.
Kobalt(II)chloride werkt als indicator voor het aantonen van water. - Moeilijkheid: eenvoudig
- Chemische stoffen: Kobaltchloride – Water
- Thema: anorganische stoffen – energetische aspecten – gehydrateerd zout
- Tijd: 20 min
- Begrippen: zouten – chemisch rekenen – kristalwater
5.10. Koperzouten
5.10.1. Blauwe mist

- Info: Hoe kun je blauwkleurige mist maken? De lichtblauwe oplossing krijgt een korenbloemblauwe kleur door vorming van het Cu(NH3)42+ complex
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 80ml O,1 mol/l – NH3-oplossing 25%
- Thema: Anorganische stoffen – complexreactie
- Tijd: 15 min
- Begrippen: zouten – hydroxide – complexreactie
5.10.2. Complexvorming met citroenzuur

- Info: Hoe kunnen we een neerslag vormen met citroenzuur? Door het toevoegen van het citroenzuur verkrijgen we een vertroebeling van de oplossingen. Als we vervolgens de NaOH-oplossing toevoegen gaan we het citroenzuur neutraliseren waardoor de vertroebeling verdwijnt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing 1 mol/l, – kopersulfaatoplossing 0,1 mol/l, – ijzer(III)oplossing 0,1 mol/l, – NaOH oplossing 3 mol/l
- Thema: Anorganische stoffen – neerslagreacties
- Tijd: 15 min
- Begrippen: zouten – invloeden op neerslagvorming
5.10.3. Daniëllcel

- Info: Hoe maken we een batterij? We maken de Daniëllcel met halfreacties met koper en zink.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kopersulfaat (CuSO4) – Zinksulfaat (ZnSO4) – Kaliumchloride (KCl)
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zouten – galvanische cel
5.10.4. Diffusie van een gas via microschaal
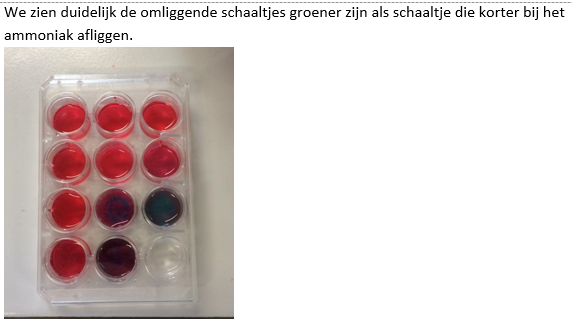
- Info: Hoe kunnen we diffusie aantonen met rode koolsap en ammoniak? De ammoniak- en zoutzuurdeeltjes gaan zich geleidelijk aan verspreiden volgens een willekeurige beweging. Dit ten gevolge van de kinetische energie die ze bezitten. Omdat het rode koolsap een universele indicator is zullen we het diffusieproces van ammoniak goed kunnen waarnemen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rode koolsap – Geconcentreerd ammoniak – Enkele druppels van een zuur :In deze proef gebruiken we HCl
- Thema: Anorganische stoffen – stofeigenschappen
- Tijd: 10 min
- Begrippen: zouten hydroxide – diffusie
5.10.5. Elektroforese

- Info: Door de complexering van het koper(II)ion met ammoniak K = 7,1 10-14 is de concentratie te laag om met het chromaation een neerslag te vormen. Bij het ompolen zullen de kleuren door diffusie niet meer geheel mengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: agar-agar – Kaliumnitraat – 0.1 mol/l kopersulfaat – 0.1 mol/l kaliumchromaat – Geconcentreerd ammoniak
- Thema: anorganische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: zouten – endo-energetische reactie – elektrolyse
5.10.6. Geheime koperboodschap

- Info: Hoe kunnen we een geheime koperboodschap schrijven? We stellen vast dat de kopersulfaatoplossing lichtblauw kleurt wanneer het in aanraking komt met ammoniak. Hierbij wordt koperhydroxide gevormd wat een blauwe kleur heeft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniak (3% is genoeg) – Zeer verdunde kopersulfaatoplossing
- Thema: Anorganische stoffen – complexreactie
- Tijd: 10 min
- Begrippen: zouten – hydroxide – identificatie
5.10.7. Groei van kristallen door osmose

- Info: De ferrocyanide ionen en de koperionen reageren ter vorming van een colloïdaal half permeabel membraan rond de kopersulfaat kristallen.Water beweegt door het membraan als de kopersulfaatcellen oplossen wat een verhoging van osmotische druk geeft in het membraan en de cellen doet vergroten.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 100ml 3% K4Fe(CN)6.3H20 – 6-8 kleine kristallen kopersulfaat (kopspeld groot)
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.10.8. Klein oerwoud in een bekerglas

- Info: Wat gebeurt er als we geel bloedloogzout en kopersulfaat in water samenvoegen? Het kopersulfaat verandert onmiddellijk van kleur, van blauw naar bruin, als het in de oplossing valt: koperhexacyanofereraat (II). Na ca. 20 minuten heeft zich op de bodem een soort “plant” . De oorspronkelijke bedekte kopersulfaatkristallen hebben zich omgezet in een bruine verbinding.
- Moeilijkheid: gemiddeld
- Chemische stoffen:Geel bloedloogzout (K4Fe(CN)6) – Kopersulfaat (CuSO4.5H2O)
- Thema: anorganische stoffen – chemische reacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.10.9. Koperen takken

- Info: Verdringingsreactie met afzetting van Cu.
- Moeilijkheid: gemiddeld
- Chemische stoffen: fijn ijzerwol – kopersulfaatoplossing 10%
- Thema: anorganische stoffen – chemische reacties – redoxreactie
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – verdringingsreactie van metalen
5.10.10. Neerslagreactie via een gas

- Info: Hoe kunnen we een koperamine complex eenvoudig aantonen? Complexvorming tussen ammoniak en koper(II)sulfaatoplossing
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4-oplossing (0,01 mol/l) – Geconcentreerde ammoniakoplossing
- Thema: anorganische stoffen – complexreactie
- Tijd: 10 min
- Begrippen: zouten – identificatie koper(II)-ionen
5.10.11. Pulserende schuimwijn

- Info: Hoe kunnen we een schuimwijn maken die blijft schuimen? In het experiment blijft het vrijgekomen zuurstof in oplossing. Als de oplossing in een verzadigde toestand het zuurstofgas bezit, schuimt het plotseling en komt een grote hoeveelheid vrij. Het verzadigingspunt wordt nu niet meer bereikt. Indien een nieuwe oververzadiging wordt bereikt komt terug gas vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)chloride – Zoutzuur (2mol/l) – Waterstofperoxide (10%)
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: zouten – peroxiden – katalysator – oscillerende reactie
5.10.12. Spiegel in koper

- Info: Hoe kunnen we een fijn koperlaagje vormen? Ammoniumchloride ontleedt met warmte. Op koper bevindt zich altijd een dun laagje koper(I) dat samen met het ontstane waterstofchloride wat koper(I)chloride vormt. Het koper(I)chloride ontleedt op de hete glaswand koper(II)chloride en koper: de koperspiegel
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 g ammoniumchloride (NH4Cl) – 0,5 g koperpoeder of -vijlsel (Cu)
- Thema: Anorganische stoffen – reacties met zouten
- Tijd: 15 min
- Begrippen: zouten– enthalpie – ontleden van zout
5.10.13. Reactie kopersulfaat, kaliumjodide,natriumthiosulfaat

- Info: Wat wordt er gevormd wanneer kopersulfaat, kaliumjodide en natriumthiosulfaat samen wordt gebracht? Bij de reactie tussen kaliumjodide, koper(II)sulfaat en natriumthiosulfaat zien we dat er eerst een oranje, troebele oplossing ontstaat, maar dat wanneer we deze gaan verwarmen in een warmwaterbad dat deze helder wordt.Bij het samenvoegen ontstaat een bruine suspensie. Bij verwarmen ontwijkt een paarse damp, de oplossing wordt bruin en de neerslag is vuilwit. De paarse damp is te verklaren door verdamping van dijood. Bij toevoegen van natriumthiosulfaat verdwijnt de bruine kleur van de oplossing en blijft de vuilwitte neerslag achter.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kopersulfaat – kaliumjodide – natriumthiosulfaat
- Thema: Anorganische stoffen – reacties met zouten – neerslagreactie – complexreactie – redoxreactie
- Tijd: 25 min
- Begrippen: zouten– enthalpie – complexreactie – oxidans
5.10.14. Reactie kopersulfaat en natriumhydroxide

- Info: Welke kleur ontstaat er bij het samenvoegen van kopersulfaat en natriumhydroxide? Het gaat hier om een reactie tussen een zout en een base. De sterke base (NaOH) verdrijft de zwakke base (Cu2+-ionen) uit zijn zouten.
Welke reactiesoorten komen we tegen? - Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)sulfaatoplossing 0,1 mol/l (CuSO4.5H2O) – Natronloog 1 mol/l (NaOH)
- Thema: Anorganische stoffen – reacties met zouten – neerslagreactie
- Tijd: 15 min
- Begrippen: zouten
5.10.15. Kopercomplexen

- Info: Welke complexen kan koper vormen? Als koperchloride reageert met geconcentreerd zoutzuur, gaat een complex gevormd worden dat voor de kleurverandering zorgt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: verzadigde CuCl2-oplossing – geconcentreerd zoutzuur (c > 40 %)
- Thema: Anorganische stoffen – reacties met zouten – complexreactie
- Tijd: 15 min
- Begrippen: zouten
5.10.16. Vorming van het eenwaardig koperion

- Info: Hoe kunnen we eenwaardig koper vormen? Redoxreactie tussen jodide en koper(II)-verbinding
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10% kopersulfaatoplossing – 10% kaliumjodide oplossing
- Thema: Anorganische stoffen – reacties met zouten – redoxreactie
- Tijd: 15 min
- Begrippen: zouten – oxidatiegetallen
5.10.17. Vorming van CuI

- Info: Wat gebeurt bij samenvoegen van kopersulfaatoplossing met kaliumjodide?
- Moeilijkheid: eenvoudig
- Chemische stoffen: KI oplossing 0,1 mol/l – CuSO4-oplossing 0,1 mol/l – Verzadigde Na2S2O3 oplossing
- Thema: Anorganische stoffen – reacties met zouten – redoxreactie
- Tijd: 15 min
- Begrippen: zouten – oxidatiegetallen
5.10.18. Kopersulfaatkristallen bereiden
- Info: Wat zal er zich vormen wanneer kopersulfaatpentahydraatoplossing in zowel water als ethanol wordt uitgedampt? Het kristalliseren uit de waterige oplossing levert CuSO4.5H2O kristallen op. Het uitdampen van ethanol levert CuSO4 poeder op, wit van kleur. Er heeft zich een kristallisatie plaatsgevonden waarbij er kopersulfaat kristallen zijn ontstaan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 . 5 H2O – Water
- Thema: Anorganische stoffen – scheidingstechnieken
- Tijd: 15 min
- Begrippen: zouten – kristallisatie
5.10.19. Reacties met kopersulfaat
- Info: Hoe kun je verschillende kleurveranderingen bekomen met een kopersulfaatoplossing?
- Moeilijkheid: eenvoudig
- Chemische stoffen: kopersulfaatpentahydraat – magnesiumpoeder – NaOH-oplossing 0,4 mol/l – KI-oplossing 0,5 mol/l -Na2S2O3 0,1 mol/l – NaCl-verzadigde oplossing – NH3-oplossing 1 mol/l
- Thema: Anorganische stoffen – redoxreacties – neerslagreacties
- Tijd: 25 min
- Begrippen: zouten -redoxreacties – complexreacties
5.11. Kwikzouten
5.11.1. Kwikschimmel op aluminium

- Info: Een aluminiumlegering van kwikatomen tussen aluminiumatomen. Hierdoor valt de oxidewerking weg en kunnen de Al-metalen corroderen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aluminiumfolie – HgCl2-oplossing 10%
- Thema: Anorganische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: zouten -redoxreacties -verdringingsreeks metalen
5.12. Loodzouten
5.12.1. Diffusiesnelheid van ionen door neerslagreactie

- Info: Wat gebeurt er als we lood(II)acetaat en natriumsulfide in een petrischaaltje met water samenvoegen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Lood(II)acetaat – Natriumsulfide
- Thema: Anorganische stoffen – neerslagreactie
- Tijd: 25 min
- Begrippen: zouten – diffusie
5.12.2. Gouden glitters

- Info: Hoe kunnen we een gouden sneeuwlandschap maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 ml gedestilleerd water (H2O); – 30 mg loodnitraat (Pb(NO3)2); – 30 mg kaliumjodide (KI)
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.12.3. Looddijodide tornado

- Info: Hoe maken we goudgele sneeuw? De oplosbaarheid van het looddijodide bedraagt bij kamertemperatuur ongeveer 1 mmol/l. In een warm waterbad lost de neerslag zich op. Na afkoeling kristalliseert de oplossing terug uit en vormen zich mooie kristallen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Oplossing van kaliumjodide (KI); – Oplossing van loodnitraat, Pb(NO3)2.
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.12.4. Gouden sneeuw

- Info: Hoe kunnen we een gouden sneeuwlandschap maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 ml gedestilleerd water (H2O); – 30 mg loodnitraat (Pb(NO3)2); – 30 mg kaliumjodide (KI)
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.12.5. Neerslag in stappen

- Info: Hoe kunnen uit neerslagen nieuwe neerslagen ontstaan? In feite wordt hier het verschil in oplosbaarheid aangetoond van de verschillende zouten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 mol/l Pb(NO3)2 – 1 mol/l NaCl – 1 mol/l KI – 1 mol/l Na2S
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.12.6. Reacties met loodionen
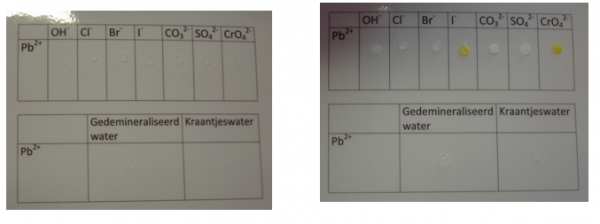
- Info: Hoe kunnen neerslagen ontstaan met lood(II)ionen? We maken verschillende lood(II)neerslagen in proefbuis
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1 mol/l – Pb(NO3)2 0,5 mol/l – KI 0,2 mol/l – NaCl 0,5 mol/l – KBr 0,2 mol/l – Na2CO3 0,5 mol/l – Na2SO4 0,5 mol/l – K2CrO4 0,2 mol/l
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.12.7. Reactie tussen looddinitraat en zoutzuur

- Info: Welke reactiesoort vindt plaats als we loodnitraat samenbrengen met zoutzuur. Wat gebeurt er als we het mengsel verwarmen? Met 1 druppel zoutzuur ontstaat een weinig wit neerslag, dat bij schudden verdwijnt. Met meer zoutzuur ontstaat weer een wit neerslag, dat bij schudden niet verdwijnt, maar bij verwarmen wel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Loodnitraatoplossing 0,1 mol/l – Zoutzuur 4 mol/l
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.13. Natriumzouten
5.13.1. Minder voorkomende natriumzouten
5.13.1.1. Chemische tuin ontwerpen

- Info: Kunnen we een chemische tuin maken door met zoutkristallen te laten reageren met waterglas? We zien na toevoegen van de metaalkristallen aan de silicaatoplossing dat er draadvormige structuren, neerslagen, worden gevormd. Dit is een traag proces. Dit is de reactie tussen metaalionen met silicaationen ter vorming van gekleurde silicaten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: natriumsilicaatoplossing (Na2O3Si) (waterglas) – Co(NO3)2.6H2O(s): cobalt(II)nitraat – Fe(NO3)3.9H2O(s): ijzer(III)nitraat – Mg(NO3)2.6H2O(s): magnesiumnitraat – MnSO4.7H2O(s): mangaan(II)sulfaat – Ni(NO3)2.6H2O(s):: nikkel(II)nitraat – warm gedeïoniseerd water
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – oplsbaarheid – diffusie
5.13.1.2. De reactie van waterglas en zoutzuur

- Info:Hoe kunnen we glas maken? Het witte materiaal dat je dus op de grenslaag tussen het waterglas en zoutzuur ziet ontstaan is zand.Als je maar een klein beetje zoutzuur voorzichtig toevoegt kun je zo een prop maken. Het gevormde SiO2 is dermate hygroscopisch dat het water volledig bindt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: natriumsilicaat (waterglas) – geconcentreerd HCl
- Thema: Anorganische stoffen – neerslagreactie
- Tijd: 30 min
- Begrippen: zouten – zuren -identificatie
5.13.1.3. Heet ijs

- Info:Hoe kunnen we zelf een “ijsblok” op 1 seconde maken?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Natriumacetaat
- Thema: Anorganische stoffen – neerslagreactie
- Tijd: 30 min
- Begrippen: zouten – oplosbaarheid
5.13.1.4. Hoe bekomen we de hoogst mogelijke stuiterende stuiterbal?

- Info: Doe 20 ml waterglas in het plastic bekertje. Voeg 10 ml ethanol toe.Meng het mengsel m.b.v. de spatel en maak een gelijkmatige cirkelvormige beweging.. Als het mengsel vast wordt , kneed tot een bal.
- Moeilijkheid: eenvoudig
- Chemische stoffen:waterglas (natriumsilicaat) – ethanol (95%) (alcohol)
- Thema: anorganische stoffen – chemische reacties
- Tijd: 25 min
- Begrippen: zouten – katalysator – stofvorming
5.13.1.5. Maak de origineelste chemische tuin

- Info: Kunnen we een chemische tuin maken door met zoutkristallen te laten reageren met waterglas? We zien na toevoegen van de metaalkristallen aan de silicaatoplossing dat er draadvormige structuren, neerslagen, worden gevormd. Dit is een traag proces. Dit is de reactie tussen metaalionen met silicaationen ter vorming van gekleurde silicaten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Oplossing van natriumsilicaat ( 15 massaprocent) – Aluminiumsulfaat – Ijzer(II)chloride
- – ijzer(III)chloride – Koper(II)sulfaat – Kobaltdichloride – Magnesiumchloride – Mangaan(II)chloride – Nikkeldinitraat – Cadmiumnitraat – Water
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: zouten – stofveranderingen – oplosbaarheid – diffusie
5.13.1.6. Reactie tussen natriumsulfiet, zwavelzuur en kaliumjodaat
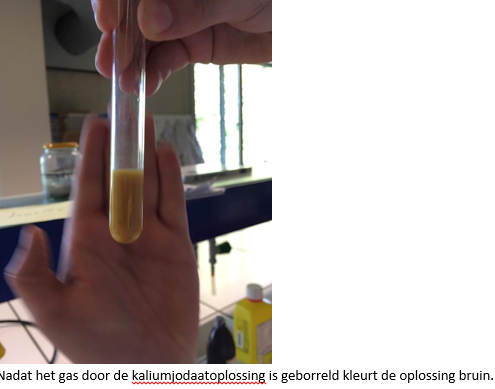
- Info: Welke reactie treedt erop tussen het gas van een natriumsulfiet, zwavelzuur oplossing en een kaliumjodaat oplossing? Redoxreacties die elkaar opvolgen
- Moeilijkheid:gemiddeld
- Chemische stoffen: Natriumsulfiet 0,1 mol/liter – Zwavelzuur 2 mol/liter – Kaliumjodaat 0,05 mol/liter
- Thema: anorganische stoffen – chemische reacties – redoxreacties
- Tijd:25 min
- Begrippen: zouten – stofveranderingen – oplosbaarheid – diffusie
5.13.2. Bakpoeder
5.13.2.1. Bereiding van koolzuurgas

- Info: Welke reactie treedt erop tussen het bakpoeder en tafelazijn
- Moeilijkheid:gemiddeld
- Chemische stoffen: 0,22 g vast NaHCO3 – 5ml azijn of 1M HCl
- Thema: anorganische stoffen – chemische reacties – reactie tussen zuur en zout
- Tijd:25 min
- Begrippen: zouten – vorming van koolstofdioxide
5.13.2.2. Construeer het strafste blusapparaat

- Info: Hoe kun je koolzuurgas maken om vuur te blussen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – gasvorming
5.13.2.3. De faraoslang

- Info: Hoe word je slangenbezweerder? Tijdens het verhitten treedt er een analyse van suiker op. Er ontstaat koolstof. We voegen hier bakpoeder aan toe zodat de slang zal groeien. Tot slot voegen we ethanol toe zodat de temperatuur zal stijgen en de analyse van suiker optreedt. Er zijn verschillende factoren die de grootte van de slang beïnvloeden, bijvoorbeeld de verdelingsgraad van het bakpoeder
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Bakpoeder – Ethanol
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: zouten – activeringsenergie – katalysator – warmte – exo-energetische reactie
5.13.2.4. Endotherme reactie met zure hosties

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen met een zure hostie? Meten van temperatuur bij toevoegen aan inhoud van een zure hostie.
- Moeilijkheid: eenvoudig
- Chemische stoffen:bakpoeder – wijnsteenzuur
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
5.13.2.5. Juiste verhouding tussen bakpoeder en tafelazijn

- Info: Is er een verhouding tussen enerzijds de reagentia en anderzijds de reactieproducten? Wanneer 2 of meer reagentia met elkaar reageren, gebeurt dat steeds in een vaste massaverhouding. In een andere stofverhouding zal minstens een van de reagentia overblijven. Deze stof is in overmaat aanwezig. Het reagens dat het minst aanwezig is, is het limiterende reagens.Dit is de wet van Proust of de wet van de constante massaverhoudingen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: anorganische stoffen – chemische reacties
- Tijd: 10 min
- Begrippen: zouten – wet van constante massaverhouding
5.13.2.6. Lanceer de sterkste bakpoederraket

- Info: Hoe kan je een raket het hoogst omhoog laten schieten door gebruik te maken van slechts 1 bruistablet?
- Moeilijkheid: eenvoudig
- Chemische stoffen: -bruistablet;
- Thema: anorganische stoffen – chemische reacties
- Tijd:25 min
- Begrippen: zouten – onderscheid fysisch en chemisch – gasvorming
5.13.2.7. Maak de meest kronkelende faraoslang

- Info: Hoe kan je de hoogste faraoslang maken met maximaal 20 gram vaste stof. (benodigdheden: bloemsuiker, ethanol en natriumbicarbonaat op een bedje van zand)
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Bakpoeder – Ethanol
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: zouten – activeringsenergie – katalysator – warmte – exo-energetische reactie
5.13.2.8. Reactie tussen bakpoeder en citroenzuur

- Info: Welke soort energetische reactie vindt plaats tussen bakpoeder en citroenzuur? Deze chemische reactie is een endo-energetische reactie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bakpoeder – Citroenzuur – water
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: zouten – activeringsenergie – katalysator – warmte – endo-energetische reactie
5.13.2.9. Rennie maken

- Info: Hoe kunnen we zelf tabletten tegen maagzuur maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1g Na2CO3 – 1g CaCl2
- Thema: anorganische stoffen – chemische reacties – energetische aspecten – neutralisatiereactie
- Tijd: 25 min
- Begrippen: zouten – warmte – endo-energetische reactie
5.13.2.10. Spontane endotherme reactie

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en citroenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd. Deze chemische reactie is een endo-energetische reactie.In het proefje is de vorming van het koolzuurgas de oorzaak van de voorstuwing
- Chemische stoffen: bakpoeder – vast citroenzuur watervrij
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
5.13.2.11. Welk gas ontstaat er door de thermolyse van bakpoeder?

- Info: Welk gas ontstaat er door thermolyse van bakpoeder? Aantonen dat koolstofdioxide ontstaat
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder (NaHCO3) – kalkwater
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: zouten – endo-energetische reacties – thermolyse – ontledingsreactie – identificatie koolstofdioxide
5.13.2.12. Exploderende bonbons

- Info: Wat ontstaat er wanneer je suiker, citroenzuur en bakpoeder samenvoegt? Er wordt CO2 gevormd door reactie tussen bakpoeder en citroenzuur indien contact met water. Hierdoor knettert het in de mond.Bakpoeder vormt CO2 wanneer het in contact komt met water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Citroenzuur – Bakpoeder
- Thema: chemische reacties – anorganische stoffen
- Tijd: 20 min
- Begrippen: zouten – vorming van koolstofdioxide
5.13.2.13. Dansende rozijnen

- Info: Hoe kunnen we rozijnen laten dansen? Eerst bruist het mengsel hevig en zien we een hevige gasvorming. Na enkele ogenblikken stijgen de rozijnen en dalen ze weer. Zolang als er gas aanwezig is, blijven de rozijnen deze beweging maken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rozijnen – halve eetlepel soda – ¼ bekertje azijn
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen: zouten – vorming van koolstofdioxide – massadichtheid
5.13.3. Keukenzout
5.13.3.1. Bereiding van keukenzout met soda

- Info: Hoe kunnen we keukenzout bereiden uit soda? Het CO2 gas verdwijnt, het water verdampt door kristallisatie. Er ontstaan NaCl kristallen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: soda (Na2CO3) – HCl 2mol/l
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen – reactie zout en zuur
- Tijd: 20 min
- Begrippen: zouten – kristallisatie
5.13.3.2. Keukenzout en regeneratiezout

- Info: Wat gebeurt er als we een oplossing maken van keukenzout en water en een oplossing van zout voor in een ontkalker en water? De oplossing met keukenzout is licht troebel, terwijl de ander oplossing klaar is
- Moeilijkheid: eenvoudig
- Chemische stoffen: Keukenzout – Zout voor een ontkalker
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen – reactie zout en zuur
- Tijd: 20 min
- Begrippen: zouten – kristallisatie – oplosbaarheid
5.13.3.3. Salz bringt mineralwasser zum sprudeln

- Info: Hoe kunnen we aantonen dat er in bruiswater dat lang openstaat nog steeds een gas aanwezig is? Het opgeloste koolstofdioxide is apolair. Het lost toch op in water omdat het ingesloten wordt. Het gehydrateerde gas wordt vrijgezet bij concurrentie van toegevoegde stoffen zoals keukenzout. De van der Waalskrachten zijn zwakker dan de iondipoolkrachten tussen zoutionen en waterdipolen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Keukenzout (5g) – Demi water (100ml) – bruiswater
- Thema: chemische reacties – anorganische stoffen
- Tijd: 20 min
- Begrippen: zouten – kristallisatie – aantonen van koolstofdioxide
5.13.3.4. Word de strafste zoutstrooier

- Info: Wat is de laagst mogelijke temperatuur dat je kan verkrijgen met 40 g ijs en max 10 g zout ? We voegen zout toe, we lossen iets op. Dat kan alleen in de vloeistof, in ijs lost zout niet of nauwelijks op. De oplossing heeft nu een belangrijke thermodynamische eigenschap.Hij heeft een nog grotere wanorde, een grotere entropie, dan zuiver water.
- Moeilijkheid: eenvoudig
- Chemische stoffen:40 g ijs (2 kg voor heel de groep) – 10 g keukenzout (200 g voor heel de groep)
- Thema: chemische reacties – anorganische stoffen – thermodynamica
- Tijd: 20 min
- Begrippen: zouten – oploswarmte
5.13.4. Soda
5.13.4.1. Bereiding van keukenzout met soda

- Info: Hoe kunnen we keukenzout bereiden uit soda? Het CO2 gas verdwijnt, het water verdampt door kristallisatie. Er ontstaan NaCl kristallen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: soda (Na2CO3) – HCl 2mol/l
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen – reactie zout en zuur
- Tijd: 20 min
- Begrippen: zouten – kristallisatie
5.13.4.2. Bereiding van rennie

- Info: Hoe kunnen we zelf tabletten tegen maagzuur maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1g Na2CO3 – 1g CaCl2
- Thema: anorganische stoffen – chemische reacties – energetische aspecten – neutralisatiereactie
- Tijd: 25 min
- Begrippen: zouten – warmte – endo-energetische reactie
5.13.4.3. Aluminium “lost op” in soda

- Info: Kan Aluminium “oplossen” in een soda-oplossing? Als je ziet dat het folie langzaam opgelost wordt en de oplossing voorzichtig zwenkt kun je goed zien dat er heel kleine waterstof-belletjes naar het oppervlak stijgen. Het folie wordt aan de randen eerst donker, dan doorzichtig en valt daar dan uit elkaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2CO3 – water – Aluminiumfolie
- Thema: anorganische stoffen – chemische reacties – redoxreactie
- Tijd: 25 min
- Begrippen: zouten – reactie metaal en zout
5.14. Nitrieten
5.14.1. Kleuren na elkaar

- Info: Hoe laten we een stof meermaals van kleur veranderen? erwijl fenol reageert met NaN02 en geconcentreerd H2S04, verschaft het een diep groene of blauwe kleur die bij verdunnen met water in rood verandert. terwijl de gegenereerde alkaline samen met de oorspronkelijke groene of blauwe NaOH-kleur wordt hersteld. Deze reactie wordt aangeduid als Liebermann’s nitrosoreactie en wordt gebruikt als een test voor fenol.
- Moeilijkheid: gemiddeld
- Chemische stoffen: geconcentreerd zwavelzuur – natriumnitriet – fenol
- Thema: anorganische stoffen – chemische reacties – redoxreactie
- Tijd: 25 min
- Begrippen: zouten
5.14.2. Variërend bruisen

- Info: Hoe kunnen we een pulserende gasoplossing maken? Het oscilleren van het bruisen bij deze reactie: evenwichten tussen oplossingen, condensatiekernen, kleine en grote belletjes en gasvormig stikstof.Doordat er nog steeds stikstof gevormd wordt, groeien de kerntjes uit tot kleine belletjes en die weer tot grotere die bruisend stikstof uit de oplossing drijven. Nu is de oplossing niet meer verzadigd; de bellen stijgen op en verdwijnen, en nieuw gevormde stikstof lost op tot de oplossing verzadigd raakt, et cetera. Als de stoffen nagenoeg zijn opgebruikt, wordt de vorming van stikstof te traag voor het oscillerend effect.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zoutzuur (2 mol/l) – Ammoniumchloride – Natriumnitriet – Gedestilleerd water
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
5.15. Overgangselementen
5.15.1. Reacties met overgangselementen

- Info: Neerslag en complexreacties met verschillende metalen uit de b-groep
- Moeilijkheid: gemiddeld
- Chemische stoffen: CuSO4 0,5 mol/l – Co(NO3)2 0,5 mol/l – NiCl2 0,5 mol/l – Mg(NO3)2 0,5 mol/l – NH3 3 mol/l – NaOH 1 mol/l
- Thema: anorganische stoffen – chemische reacties
- Tijd: 25 min
- Begrippen: zouten – neerslag – complexreactie
5.15.2. De overgangselementen

- Info: Neerslag en complexreacties met verschillende metalen uit de b-groep
- Moeilijkheid: gemiddeld
- Chemische stoffen: K2CrO4 0,2 mol/l – KMnO4 0,2 mol/l – Co(NO3)2 0,5 mol/l – NH3 3 mol/l – HCl 1 mol/ – NaOH 1 mol/l – NiCl2 0,5 mol/l – CuSO4 0,2 mol/l – FeSO4 0,2 mol/l – Fe(NO3)3 0,2 mol/l – AgNO3 0,2 mol/l – KSCN 0,1 mol/l – KI 0,2 mol/l – Zetmeeloplossing – Zn granulen
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties
- Tijd: 25 min
- Begrippen: zouten – neerslag – complexreactie
5.16. Sulfieten
5.16.1. Goethes kleurenleer

- Info: Wat zal er gebeuren als we in een beker met water volgende stoffen toevoegen: kaliumpermanganaat, kaliumhydroxide, mierenzuur, natriumwaterstofsulfaat en natriumsulfiet? Het paarse permanganaation (MnO4–) wordt stap voor stap gereduceerd. De eerste stap voert via het blauwe, onstabiele hypomanganaat (MnO43-) door oxidatie naar het groene manganaat (MnO42-).Door de aanwezigheid van OH–ionen wordt de rechtstreekse reductie naar Mn2+ vermeden.In het zure milieu ontstaat lichtbruin manganiet (MnO44-) dat, gemengd met permanganaat, een roodbruine kleur veroorzaakt. Dit gebeurt door de toevoeging van het zure natriumwaterstofsulfaat wat ertoe leidt dat de OH– worden geneutraliseerd. Het aanwezige formiaat wordt zuur waardoor Mn(+VI) oxideert tot Mn(+IV) met de bruine kleur. Tenslotte zorgt het sulfiet ervoor dat manganiet gereduceerd wordt tot het tweewaardige mangaan ( Mn2+). Dat is zeer licht zalmkleurig, nagenoeg kleurloos.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 400 ml gedestilleerd water (H2O); – 0,02 g kaliumpermanganaat (KMnO4); – 2,5 g kaliumhydroxide (KOH); – 0,04 g 85% mierenzuur (HCOOH) 0,04 g / 1 druppel; – 2,5 g natriumwaterstofsulfaat (NaHSO4); – 0,25 g natriumsulfiet (Na2SO3).
- Thema: anorganische stoffen – chemische reacties – redoxreacties
- Tijd: 30 min
- Begrippen: zouten – verschillende OG van mangaan
5.17. Zinkzouten
5.17.1. Bereiding van zinkjodide oplossing

- Info: Wat gebeurt er als je zink en jodium met elkaar laat reageren in water? De jodiumoplossing wordt oranjegeel na verhitting . Na toevoeging van het zinkpoeder verdwijnt de oranjegele kleur. De oplossing wordt lichtgeelgrijs. De gefilterde oplossing heeft de kleur van lichte zonnebloemolie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 1 spatelpunt zink – 1 spatelpunt dijood – 20 ml water
- Thema: anorganische stoffen – chemische reacties
- Tijd: 30 min
- Begrippen: zouten – reactie tussen metaal en niet-metaal
5.17.2. Reactie tussen zinksulfaat en ammoniak

- Info: Wat wordt er gevormd wanneer zinksulfaat en ammoniak samen wordt gebracht? Bij het toevoegen van een weinig ammoniak aan de zinksulfaatoplossing ontstaat een witte neerslag. Verder toevoegen van de ammoniakoplossing zorgt ervoor dat de neerslag terug oplost.
- Moeilijkheid: gemiddeld
- Chemische stoffen: zinksulfaat – ammoniak
- Thema: anorganische stoffen – chemische reacties – neerslag en complexreactie
- Tijd: 30 min
- Begrippen: zouten
5.18. Zilverzouten
5.18.1. Chemische foto

- Info: Is er behalve stofomzetting een andere vorm van omzetting bij chemische reactie? Via verschillende oplossingen wordt op fotopapier een foto gevormd
- Moeilijkheid: moeilijk
- Chemische stoffen:fixeervloeistof – ontwikkelvloeistof
- Thema: chemische reacties – energetische aspecten –
- Tijd:80 min
- Begrippen: zouten – endo-energetische reacties – fotolyse – complexreacties
5.18.2. Een oude hoed met nieuwe veren
- Info: De AgCl neerslag ontstaat door reactie tussen het HCl in gasfase en de Ag-ionen in de oplossing.
- Moeilijkheid: moeilijk
- Chemische stoffen:f 0,001 M AgNO3 – Geconc HCl
- Thema: chemische reacties – energetische aspecten – neerslagreactie
- Tijd:10 min
- Begrippen: zouten – diffusie
5.18.3. Fotografie op oude wijze

- Info: Kunnen we een negatief van een figuur ‘afdrukken’ op filtreerpapier ? Complexreactie met ijzerhexacyanoferraat
- Moeilijkheid:gemiddeld
- Chemische stoffen: 5 cl oplossing Fe(NO3)3 – 0,5 mol/liter – 8 cl oplossing K2C2O4 – 0,75 mol/liter – 0,5 cl oplossing K3Fe(CN)6 – 0,25 mol/liter
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd:40 min
- Begrippen: zouten – endo-energetische reacties – fotolyse – complexreacties
5.18.4. Fotolyse van zilverchloride

- Info: Onder invloed van licht (fotolyse) ontleedt de zilverchloride neerslag. Magnesium verbranden geeft extra licht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zilvernitraatoplossing 0.01M – natriumchloride-oplossing 0.01M – magnesiumlint
- Thema: anorganische stoffen – chemische reacties – energetische aspecten
- Tijd 10 min
- Begrippen: zouten – endo-energetische reacties – fotolyse – neerslagreactie
5.18.5. Geprojecteerde neerslagen

- Info: Door diffusie verdelen de drie zouten zich geleidelijk in het water.
Indien voldoende contact ontstaan er respectievelijk AgCl (witte neerslag )en AgI (gele neerslag). Eventueel ontstaat nog door licht Ag. - Moeilijkheid: eenvoudig
- Chemische stoffen: zilvernitraat – NaCl – KI
- Thema: anorganische stoffen – chemische reacties – neerslagreacties
- Tijd 10 min
- Begrippen: zouten
5.18.6. Neerslagen en complexen met zilver
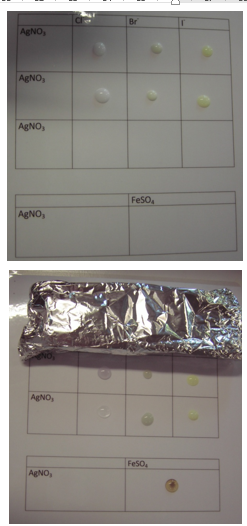
- Info: Verschillende neerslagen met het zilverion ontstaan na elkaar. Telkens wordt een neerslag gevormd met een kleiner oplosbaarheidsproduct of een complex wat stabieler is dan de vorige neerslag of complex.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 200 ml AgNO3 0.01 mol/l – 100 ml NaHCO3 0.1 mol/l – 100 ml NaOH 0.1 mol/l – 100 ml NaCl 0.1 mol/l – 100 ml NH3 0.1 mol/l – 100 ml KBr 0.1mol/l – 100 ml Na2S2O3 0.1 mol/l – 100 ml 0.1 mol/l KI – 100 ml Na2S 0.1 mol/l
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties
- Tijd 30 min
- Begrippen: zouten – oplosbaarheidsproduct
5.18.7. Reacties met zilverionen

- Info: Verschillende neerslagen met het zilverion ontstaan na elkaar. Telkens wordt een neerslag gevormd met een kleiner oplosbaarheidsproduct of een complex wat stabieler is dan de vorige neerslag of complex.Toevoeging van chloride, bromide en jodide aan AgNO3 geeft onmiddellijk een witte, licht gele en gele neerslag.Deze neerslag blijft bestaan als de stalen worden afgeschermd van licht. De kleuren van AgCl en AgBr worden donkerder door de vorming van metallisch zilver, met jodide ontstaat weinig verschil.AgCl lost onmiddellijk op in NH3 oplossing, AgBr gedeeltelijk, AgI nietToevoeging van Fe(II) oplossing aan AgNO3 geeft vorming van Ag wat vast te stellen is met een vergrootglas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH3 3 mol/l – FeSO4 0,2 mol/l – KBr 0,2 mol/l – KI 0,2 mol/l – AgNO3 0,1 mol/l – NaCl 0,2 mol/l
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties – redoxreacties
- Tijd 30 min
- Begrippen: zouten – oplosbaarheidsproduct
5.18.8. Veranderende evenwichtconcentraties
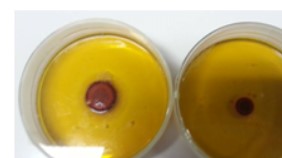
- Info: Een chemisch evenwicht ontstaat wanneer in een reactievat twee tegengestelde reacties optreden waarbij de reactieproducten van de eerste reactie de beginstoffen zijn van de tweede reactie. Als beide reacties met dezelfde snelheid verlopen, is er sprake van een chemisch evenwicht.
Zo is er na de vorming van zilverchromaat op dat moment een evenwicht waarbij evenveel vast zilverchromaat in oplossing gaat als er zilver- en chromaationen uit de oplossing combineren tot het slecht oplosbare zout.
De evenwichtsconcentraties veranderen door wijziging van de omstandigheden: een andere temperatuur, andere concentraties van opgeloste stoffen of ionen. - Moeilijkheid: eenvoudig
- Chemische stoffen: 0,2M AgNO3 oplossing – 0,2M K2CrO4 oplossing – 0,2M NaCl – 1M NH3 – 2M HCl
- Thema: anorganische stoffen – chemische reacties – neerslagreacties – complexreacties – redoxreacties
- Tijd 30 min
- Begrippen: zouten – oplosbaarheidsproduct
5.18.9. Verdringingsreactie met zilvernitraat en koper

- Info:Wat gebeurt er met het koperplaatje van zodra deze in aanraking komt met zilvernitraat?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat oplossing (1 mol/l) – Koper metaal en/of koperdraad
- Thema: anorganische stoffen – redoxreacties
- Tijd 15 min
- Begrippen: zouten – verdringingsreactie metalen
5.18.10. Zilverbos

- Info:Wat gebeurt er met het koperplaatje van zodra deze in aanraking komt met zilvernitraat?
- Moeilijkheid: eenvoudig
- Chemische stoffen: koperplaatje – zilvernitraatoplossing 10%
- Thema: anorganische stoffen – redoxreacties
- Tijd 15 min
- Begrippen: zouten – verdringingsreactie metalen
5.18.11. Reactie van zilvernitraat, ammoniak en leidingswater

- Info: Welke reactie vindt er plaats wanneer men zilvernitraat en leidingwater bij elkaar voegt gevolgd door ammoniak?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniak 4 mol/L – Zoutzuur 4 mol/L – Zilvernitraatoplossing 0,1 mol/L
- Thema: anorganische stoffen – neerslagreactie – complexreactie
- Tijd 15 min
- Begrippen: zouten – oplosbaarheidsproduct
5.18.12.De reactie tussen zilvernitraat en kaliumjodide

- Info: Wat wordt er gevormd wanneer zilvernitraat, zwavelzuur en kaliumjodide worden samengebracht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat – zwavelzuur – kaliumjodide
- Thema: anorganische stoffen – neerslagreactie
- Tijd 15 min
- Begrippen: zouten – oplosbaarheidsproduct
6. Identificatiereacties van anorganische stoffen
6.1. Het verbrandingsproduct van koolstofdioxide aantonen

- Info: Welk verbrandingsproduct produceert een verbranding, naast waterdamp? Helder kalkwater dat troebel wordt is een indicator voor koolstofdioxide. Het klakwater wordt troebel dus koolstofdioxide is een verbrandingsproduct dat gevormd wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Helder kalkwater
- Thema: anorganische stoffen – redoxreactie
- Tijd 15 min
- Begrippen: identificatie koolstofdioxide – verbrandingsreactie
6.2. Het verbrandingsproduct van waterdamp aantonen

- Info: Welk verbrandingsproduct wordt er gevormd? Waterdamp is een verbrandingsproduct dat gevormd wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: theelichtje
- Thema: anorganische stoffen – redoxreactie
- Tijd 15 min
- Begrippen: identificatie waterdamp -verbrandingsreactie
6.3. Identificatie van de verbrandingsproducten van een kaars

- Info: Tot welke stoffen verbrandt een koolwaterstof? Steek de kaars aan en laat het enkele minuten branden tot de kobaltchloride verandert van blauw naar roze en kalkwater vertroebelt
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – Stukje blauw kobaltchloride papier – 20 ml van kalkwater
- Thema: anorganische stoffen – redoxreactie
- Tijd 20 min
- Begrippen: identificatie waterdamp -verbrandingsreactie
6.4. Identificatie van zuurstof

- Info: Hoe kan je aantonen dat er na een reactie, zuurstofgas is gevormd? Met behulp van een houtenspaander/lucifer kan men aantonen dat er zuurstofgas gevormd is. Deze houtenspaander/lucifer zal meer vlam vatten wat te wijten is aan een hogere concentratie zuurstof. Bij de verbranding wordt er CO2 gevormd.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 30 ml zuurstofgas – 2 ml kalkwater
- Thema: anorganische stoffen – enkelvoudige stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – identificatiereactie zuurstofgas – verbrandingsreactie
6.5. Ijzer aanduiden in cornflakes

- Info: Maak van het cornflakesmengsel een papje. Ga er overheen met een magneet. Je ziet dat er in de zak kleine zwarte deeltjes aangetrokken worden door de magneet.
- Moeilijkheid: gemiddeld
- Chemische stoffen: cornflakes
- Thema: anorganische stoffen – enkelvoudige stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – magnetisme – identificatiereactie
6.6. Kwalitatief onderzoek van koper in munten

- Info: Hoe kunnen we d.m.v. NH3-oplossing en HNO3-oplossing aantonen dat er koper zit in een munt? Na aanbrengen van de salpeterzuuroplossing, lijken de munten properder te zijn. Wanneer we met het wattenstaafje met ammoniakoplossing over deze munten wrijven, wordt dit wattenstaafje blauw.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Euromunten – HNO3-oplossing 1 keer verdund – NH3-oplossing 1 keer verdund
- Thema: anorganische stoffen – enkelvoudige stoffen – chemische reacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – identificatiereactie
6.7. Kwalitatieve analyse van voedingsstoffen in melk

- Info:Hoe kunnen we delen in melk scheiden en analyseren? Door verschillende scheidingstechnieken te gebruiken en geïsoleerde delen te analyseren
- Moeilijkheid: gemiddeld
- Chemische stoffen: volle melk- verdund azijnzur – verdund natriumhydroxide 0.5 mol/l – kopersulfaatoplossing 1% – diethylether – ethanol 96%- indikatorpapier – natriumsulfaat – Fehling-oplossingen – SudanIII-oplossing 0.1% in methanol – natriumdithionietoplossing 1% – ammoniumoxalaatoplossing 5% – ammoniummolybdaatoplossing 10%
- Thema: anorganische stoffen – scheidingstechnieken
- Tijd: 2 uur
- Begrippen: scheidingsschema – verschillende scheidingstechnieken – analysetechnieken
6.8. Fysische eigenschappen van anorganische stoffen

- Info:Wat is de invloed van het oplosmiddel? In dit practicum zijn we aan de slag gegaan met een belangrijke fysische eigenschap van anorganische stoffen: “oplosbaarheid”. De oplosbaarheid van een stof geeft aan in welke mate de stof kan oplossen in een andere
- Moeilijkheid: gemiddeld
- Chemische stoffen: Suiker – Azijnzuur – CuSO4 – Ethanol – Gedemineraliseerd water – I2 – Zwavel – NaOH – Ether – n-heptaan
- Thema: anorganische stoffen – stofeigenschappen
- Tijd: 30 min
- Begrippen: analysetechnieken – oplosbaarheid
6.9. Onderzoek: identificatie van anorganische stofklassen

- Info:Hoe kunnen we anorganische stofklassen omzetten naar andere stofklassen? Bij de eerste reactiereeks hebben we magnesium omgezet naar magnesiumoxide. Hierna hebben we dit door het te laten reageren met water magnesiumhydroxide gevormd.Bij de reacties met octazwavel hebben we eerst zwaveldioxide/zwaveltrioxide gevormd. Met dit gas te laten reageren bekwamen we zwavelzuur.Bij onze laatste reactie tussen zoutzuur en natriumhydroxide hebben we water en zout gevormd.
- Moeilijkheid: gemiddeld
- Chemische stoffen: magnesiumlint – octazwavel – NaOH-oplossing (4,0 mol/l) – HCl-oplossing (4,0 mol/l)
- Thema: anorganische stoffen – reacties tussen anorganische stoffen
- Tijd: 30 min
- Begrippen: analysetechnieken – stofklassen
6.10. Onderzoek: oplosbaarheid van anorganische stofklassen

- Info:Welke verbanden kunnen we vinden tussen de aard van deze stoffen en de oplosbaarheid in water?
- De zouten en hydroxiden van de onderzochte alkalimetalen lossen op in water. De zouten en hydroxiden van de onderzochte aardalkalimetalen lossen niet altijd op in water.
- Moeilijkheid: gemiddeld
- Chemische stoffen: HCl – HNO3 – H3PO4 – HClO3 – NaOH – Ca(OH)2 – CaCO3 – NaCl – BaSO4 – KNO3
- Thema: anorganische stoffen – stofeigenschappen
- Tijd: 30 min
- Begrippen: analysetechnieken – oplosbaarheid
7. Reactiesoorten
7.1. Reactiepatronen
7.1.1. Onderzoek: identificatie van anorganische stofklassen

- Info:Hoe kunnen we anorganische stofklassen omzetten naar andere stofklassen? Bij de eerste reactiereeks hebben we magnesium omgezet naar magnesiumoxide. Hierna hebben we dit door het te laten reageren met water magnesiumhydroxide gevormd.Bij de reacties met octazwavel hebben we eerst zwaveldioxide/zwaveltrioxide gevormd. Met dit gas te laten reageren bekwamen we zwavelzuur.Bij onze laatste reactie tussen zoutzuur en natriumhydroxide hebben we water en zout gevormd.
- Moeilijkheid: gemiddeld
- Chemische stoffen: magnesiumlint – octazwavel – NaOH-oplossing (4,0 mol/l) – HCl-oplossing (4,0 mol/l)
- Thema: anorganische stoffen – reacties tussen anorganische stoffen
- Tijd: 30 min
- Begrippen: analysetechnieken – stofklassen
7.1.2. Reactiepatronen

- Info:Wat gebeurt bij een synthesereactie? Een verbranding is een reactie met dizuurstofgas. Het magnesium gaat reageren met dizuurstof tot magnesiumoxide. Fe-poeder reageert met zwavelpoeder tot ijzersulfide: Fe + S –> Fe
- Moeilijkheid: gemiddeld
- Chemische stoffen: ijzer – octazwavel – magnesiumlint
- Thema: anorganische stoffen – reacties metaal en niet-metaal
- Tijd: 30 min
- Begrippen: analysetechnieken – stofklassen
7.2. Reacties niet-metalen
7.2.1. Reacties met chloorgas

- Info: Het KI verandert in geel door de vorming van I2 – Het KBr verandert in geel door de vorming van Br2 – Met NaCl treedt geen reactie op.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Bleekwater – HCl 1 mol/l – NaCl 0,2 mol/l – KBr 0,2 mol/l – KI 0,2 mol/l
- Thema: anorganische stoffen – enkelvoudige stoffen – redoxreacties – stofklassen
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – spanningsreeks niet-metalen – reacties anorganische stoffen
7.3. Metalen en hydroxiden
7.3.1. Reactie van loog en aluminium

- Info: Welk effect heeft natriumhydroxide (sterke base) op aluminium? We stellen vast het aluminium oplost in de NaOH-oplossing. Dit komt doordat Aluminium reageert met het NaOH.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1g NaOH-korrels (ontstopperkorrels) – Aluminiumfolie
- Thema: Anorganische stoffen – redoxreactie – reacties anorganische stofklassen
- Tijd: 15 min
- Begrippen: hydroxide – vorming van waterstofgas
7.4. Metaal en niet-metaal
7.4.1. Vorming van FeS met zwavel en ijzer

- Info: Hoe kunnen aantonen dat we FeS vormen uit Fe en S? Zwavel en ijzer reageren pas met elkaar als je ze verwarmt, omdat als je ze bij elkaar gooit en verwarmt er een goudachtige vaste stof(pyriet) en een kleurloos gas ontstaat, die andere stofeigenschappen heeft namelijk; is niet magnetisch, lost niet op in water en reageert met zoutzuur, is zwart en vast met kamer temperatuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fe poeder – S poeder
- Thema: Anorganische stoffen – redoxreactie – reacties anorganische stofklassen
- Tijd: 15 min
- Begrippen: hydroxide – vorming van waterstofgas – reactie metaal en niet-metaal
7.5. Metaaloxide en zuur
7.5.1. Reactie tussen koperoxide en zwavelzuur

- Info: Hoe reageert koperoxide met zwavelzuur? De reactie tussen CuO en H2SO4 doet CuSO4 en H2O ontstaan, waardoor de oplossing neutraal wordt. Dit kunnen we waarnemen door de blauwe kleur. Metaaloxiden en zuren geven zout en water
- Moeilijkheid: gemiddeld
- Chemische stoffen: H2SO4 0,1 mol/.l 20ml – 1 g CuO
- Thema: Anorganische stoffen – anorganische stofklassen
- Tijd: 25 min
- Begrippen: zuren -reactie oxide en zuur
7.6. Metalen en zuren
7.6.1. Bereiding van waterstofgas

- Info: Hoe kunnen we waterstofgas bereiden? Het magnesiumlint en waterstofchloride reageren samen tot magnesiumchloride en waterstofgas.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Mg lint – HCl 2mol/l
- Thema: Anorganische stoffen – anorganische stofklassen
- Tijd: 25 min
- Begrippen: zuren -reactie metaal en zuur
7.6.2. De reactie van metalen met zuren
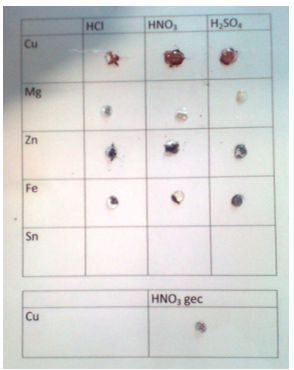
- Info: Hoe kunnen we waterstofgas bereiden? Het magnesiumlint en waterstofchloride reageren samen tot magnesiumchloride en waterstofgas.
- Moeilijkheid: gemiddeld
- Chemische stoffen: HCl 1 mol/l – HNO3 1 mol/l – HNO3 5 mol/l – H2SO4 1 mol/l – Mg lint – Zn korrels – Fe poeder – Sn korrels/poeder – Cu draad of poeder
- Thema: Anorganische stoffen – anorganische stofklassen – redoxreacties
- Tijd: 25 min
- Begrippen: zuren -reactie oxide en zuur – verdringingsreeks metalen
7.6.3.Inwerking van zuren op metalen

- Info: Hoe werken zuren in op metalen? Controle van verdringingsreeks metalen en effect van soort zuur en concentratie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: verdund HCl 6mol/l – verdund H2SO4 6mol/l – geconcentreerd salpeterzuur 12mol/l – 6 cm magnesiumlint – 1 koperplaatje – papier met mespunt ijzerpoeder – ijzernagels – zinkplaatjes – 3 aluminiumplaatjes
- Thema: Anorganische stoffen – anorganische stofklassen – redoxreacties
- Tijd: 25 min
- Begrippen: zuren -reactie oxide en zuur – verdringingsreeks metalen
7.6.4. Potloodslijper vormt knalgas en verdwijnt in zuur

- Info: De slijper is uit magnesium. Magnesium verbrandt na warmtetoevoer en geeft een sterk wit licht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magnesiumpotloodslijper – geconcentreerde HCl
- Thema: enkelvoudige stoffen – redoxreacties – reacties anorganische stofklassen
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.6.5. Reactie van koper en azijnzuur

- Info: Welke kleur krijgt het azijnzuur na reactie met koper? Het koperoxide gaat reageren met het azijnzuur. Het azijnzuur krijgt hierdoor een blauwe kleur omdat er koperacetaat is gevormd. Het koper van de munten reageert met het zuur van de citroen en vormt het kopercitraat. Als de spijker in de oplossing komt, bedekt de stof de spijker met een dun laagje, wat niet is af te wrijven.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd azijnzuur – Koperen plaatje – Koperoxide
- Thema: enkelvoudige stoffen – redoxreacties – reacties anorganische stofklassen
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.6.6. Verdunde en geconcentreerde zuren reageren verscheiden

- Info: Wat neem je anders waar als je zink laat reageren met verdunde en geconcentreerde zuren? De reactie tussen zink en verdund zwavelzuur zorgt voor de vorming van een witte stof en een gas. Deze reactie is licht bruisend.Bij geconcentreerd zwavelzuur is de reactie heviger. Er ontstaat een schuimlaag dankzij de productie van het gas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zinkpoeder – Geconcentreerd zwavelzuur en salpeterzuur – H2SO4 1 mol/l en HNO3 1 mol/l
- Thema: Anorganische stoffen – redoxreactie – verdringingsreeks – reacties anorganische stofklassen
- Tijd: 25 min
- Begrippen: zuren – zuursterkte – concentratie
7.6.7. Branding van de zee nabootsen

- Info: Hoe herkennen we een chemische reactie? Gebeurt er behalve stofomzetting nog iets ander gedurende een chemische reactie?
- Moeilijkheid: eenvoudig
- Chemische stoffen: verdunde HCl -methyleenblauw – Mg-poeder
- Thema: Anorganische stoffen – redoxreactie – verdringingsreeks – reacties anorganische stofklassen
- Tijd: 10min
- Begrippen: zuren – stofklassen
7.6.8.Reactie van metalen met zuren op papier

- Info: Hoe kunnen we waterstofgas bereiden? Het magnesiumlint en waterstofchloride reageren samen tot magnesiumchloride en waterstofgas.
- Moeilijkheid: gemiddeld
- Chemische stoffen: HCl 1 mol/l – HNO3 1 mol/l – HNO3 5 mol/l – H2SO4 1 mol/l – Mg lint – Zn korrels – Fe poeder – Sn korrels/poeder – Cu draad of poeder
- Thema: Anorganische stoffen – anorganische stofklassen – redoxreacties
- Tijd: 25 min
- Begrippen: zuren -reactie oxide en zuur – verdringingsreeks metalen
7.6.9. Reactie van magnesium met zoutzuur

- Info: Welke soort energetische reactie vindt plaats tussen magnesium en waterstofchloride?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magnesiumlint – Waterstofchloride
- Thema: enkelvoudige stoffen – chemische reactie – reacties anorganische stofklassen
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – exo-energetische reactie – warmte
7.7 Niet-metaaloxiden en hydroxiden
7.7.1. Aantonen van koolzuurgas met kalkwater
- Info: Hoe kun je de vorming van koolzuurgas aantonen? Identificatie met kalkwater
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20ml koolstofdioxidegas – 3 tot 5 ml kalkwater
- Thema: anorganische stoffen – enkelvoudige stoffen – chemische reactie – reacties anorganische stofklassen
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – reacties stofklassen
7.7.2. Bevat uitgeademde lucht koolstofdioxide?

- Info: Bevat uitgeademde lucht CO2? De universeelindicator wordt geel-groen als ze in een zure omgeving is en is paars als ze in een basisch milieu is. – Er is CO2 aanwezig in uitgeademde lucht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een rietje – Universeelindicator – NaOH oplossing 0.1 mol/l
- Thema: anorganische stoffen -enkelvoudige stoffen – chemische reactie – reacties anorganische stofklassen
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – reacties stofklassen – zuur-base indicator
7.7.3. Koolstofdioxide en waterig natriumhydroxide

- Info: Calcium oxide reageert exothermisch met water en vormt Calciumdihydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2 (g), 50 ml – NaOH(aq), 6 mol/l, 10 mL
- Thema: Anorganische stoffen – chemische reactie – reactie stofklassen
- Tijd: 15 min
- Begrippen:oxide – stofklassen – reactie oxide en hydroxide
7.7.4. Opname van koolzuurgas door hydroxide

- Info: Nemen hydroxiden CO2 op? We stellen vast dat de ballon kleiner wordt. Dit duidt erop dat de hydroxide reageert met het CO2-gas uit de ballon: het neemt het gas op.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KOH – NaOH – Ca(OH)2 – droog ijs
- Thema: Anorganische stoffen – chemische reactie – reactie stofklassen
- Tijd: 15 min
- Begrippen:oxide – stofklassen – reactie oxide en hydroxide
7.7.5. Welk gas ademen we uit?

- Info: Welk gas ademen we uit? Ca(OH)2 is een indicator voor CO2. Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig. Wanneer de oplossing troebel wordt, is er CO2 aanwezig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rietje – Kalkwater
- Thema: Anorganische stoffen – chemische reactie – reactie stofklassen
- Tijd: 15 min
- Begrippen:oxide – stofklassen – reactie oxide en hydroxide
7.8. Zout en metaal
7.8.1. Aluminium reageert in een koperzoutoplossing

- Info: Welk stof wordt er gevormd na de reactie van aluminiumfolie met een kopersulfaatoplossing? Dit experiment illustreert de verplaatsing van koper uit koper(II)sulfaatoplossing (CuSO4) met aluminiumfolie. Studenten voegen aluminiumfolie toe aan koper(II)sulfaatoplossing (CuSO4) en nemen geen reactie waar. Vervolgens wordt natriumchloride toegevoegd en opgelost. Een reactie treedt op en de oplossing is erg warm, aluminium lost op en roodkoper is zichtbaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2g NaCl – 0,8 mol/l Koper(II)sulfaat (CuSO4(aq)) – aluminiumfolie (2cm – 2cm)
- Thema: Anorganische stoffen – chemische reactie – reactie stofklassen
- Tijd: 20 min
- Begrippen:oxide – stofklassen – reactie metaal en zout
7.8.2. Koolstof uit eierschalen

- Info: Op welke manier kunnen we koolstof bereiden uit eierschalen? Eierschalen bevatten calciumcarbonaat. Dit gaat met magnesium koolstof vormen. Het wit licht dat tijdens de verbranding ontstaat, is afkomstig van het magnesium en de oranje vonkjes zijn afkomstig van het calciumcarbonaat in de eierschalen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Droge eierschalen – Magnesiumpoeder – 10% zoutzuur
- Thema: enkelvoudige stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – verdringingsreactie metalen
7.8.3. Verdringingsreeks met zilvernitraat en koper

- Info: Wat gebeurt er met het koperplaatje van zodra deze in aanraking komt met zilvernitraat? Er treedt een verdringingsreactie op vermits zilver een edeler metaal is dan koper worden zilverionen door koper vrijgezet uit zouten .
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat oplossing (1 mol/l) – Koper metaal en/of koperdraad
- Thema: enkelvoudige stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – verdringingsreactie metalen
7.9. Zuren en zouten
7.9.1. De reactie van calciumcarbonaat en zoutzuur

- Info:Wat gebeurt er als we calciumcarbonaat laten reageren met zoutzuur? Het koolzuur wordt ontwikkeld door de reactie tussen de kalk (calciumcarbonaat, CaCO3) en het zoutzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 2mol/l – CaCO3
- Thema: Anorganische stoffen – gasvorming – reacties tussen stofklassen
- Tijd:10 min
- Begrippen: zuren -identificatie – identificatiereactie
7.9.2. Hoe kan je koolzuurgas uit eierschalen halen?

- Info: Op welke manier kunnen we koolstof bereiden uit eierschalen? Eierschalen bevatten calciumcarbonaat. Dit gaat met magnesium koolstof vormen. Het wit licht dat tijdens de verbranding ontstaat, is afkomstig van het magnesium en de oranje vonkjes zijn afkomstig van het calciumcarbonaat in de eierschalen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Droge eierschalen – Magnesiumpoeder – Zoutzuur 1mol/l
- Thema: anorganische stoffen– redoxreactie – reacties anorganische stofklassen
- Tijd: 15 min
- Begrippen: zouten – verdringingsreactie metalen
7.9.3. Oplossen van kalksteen in citroensap

- Info: Is citroensap zuur genoeg om kalksteen op te lossen? Het kalksteen reageert met het citroenzuur dat aanwezig is in het citroensap. Hierbij wordt CO2 gevormd. Deze vorming van CO2 zorgt voor de vertroebeling van het kalkwater door de vorming van calciumcarbonaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gefiltreerd citroensap – Kalksteen (kleine blokjes) – Kalkwater
- Thema: anorganische stoffen– neutralisatiereactie – reacties stofklassen
- Tijd: 15 min
- Begrippen: zouten
7.9.4. Reacties met waterstofsulfide

- Info:Identificatiereacties van waterstofsulfide
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 1 mol/l – Pb(NO3)2 0,5 mol/l – KMnO4 0,01 mol/l – AgNO3 0,2 mol/l – H2SO4 1 mol/l – ZnS poeder
- Thema: Anorganische stoffen – neerslagreactie – redoxreactie – reacties anorganische stofklassen
- Tijd:20 min
- Begrippen: zuren -identificatie – identificatiereactie
7.9.5. Zuren op marmer

- Info: Hoe reageert marmer met een zuur? Hoewel allemaal zure oplossing werden gebruikt werd een verschil in sterkte van gasontwikkeling vastgesteld. Met sterk zure reinigers wordt bruisende werking vastgesteld.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een stuk marmer – een aantal zure huishoudproducten
- Thema: Anorganische stoffen
- Tijd: 15 min
- Begrippen: zuren – corrosie
7.10. Zuren en hydroxiden
7.10.1. Ammoniumchloride bereiden

- Info: Hoe kunnen NH4Cl nevel vormen? We stellen vast dat er witte ammoniumchloride wordt gevormd doordat de gec. Ammoniak en gec. HCl met elkaar reageren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gec. NH3 – Gec. HCl
- Thema: Anorganische stoffen – reacties stofklassen
- Tijd: 15 min
- Begrippen: zouten– enthalpie – zoutvorming uit zuur en base
8. Toepassingen
8.1. Bouwmaterialen
8.1.1. Verharding van cement

- Info:Wat gebeurt er als cement in de lucht, onder water of in afwezigheid van lucht mag uitharden? Wanneer cement uithardt, vormt het naaldvormige kristallen, het zogenaamde
kristalvilt
. Tussen de kristallen wordt water opgeslagen, zogenaamdkristalwater
. - Moeilijkheid: eenvoudig
- Chemische stoffen: 5 lepels cement – 15 lepels zeezand – 10 ml water
- Thema: Anorganische stoffen – reacties stofklassen
- Tijd: 15 min
- Begrippen: zouten– reactie oxide en water
8.1.2. Vergelijking kalksteen en kalkmortel

- Info:Welke eigenschappen hebben kalksteen en kalkmortel gemeen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 stuk kalksteen – 1 stuk kalkmortel – 10 ml zoutzuur 0.1 mol/l
- Thema: Anorganische stoffen – reacties stofklassen
- Tijd: 15 min
- Begrippen: zouten– reactie zout en zuur
8.1.3. Onderzoek van marmer

- Info: Wat gebeurt er als marmer wordt verwarmd in een brandende vlam en vervolgens in contact wordt gebracht met water? Marmer is gemaakt van calciumcarbonaat . Bij verbranding ontsnapt kooldioxide en wordt calciumoxide (ongebluste kalk) gevormd.Het water op het indicatorpapier reageert met het calciumoxide en vormt een loog: calciumhydroxide (gebluste kalk). Het kleurt de indicator blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: pH-papier – 1 stuk marmer – 1 druppel water
- Thema: Anorganische stoffen – reacties stofklassen – ontleding zout
- Tijd: 15 min
- Begrippen: zouten–
8.1.4. Onderzoek van kalkmortel

- Info: Welke eigenschappen heeft kalkmortel als cementvervanger? Het calciumhydroxide reageert met het kooldioxide uit de lucht om calciumcarbonaat (kalksteen) te vormen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 g calciumoxide – 100 ml water – 40 g fijn zeezand
- Thema: Anorganische stoffen – reacties stofklassen – vorming van calciumcarbonaat
- Tijd: 15 min
- Begrippen: zouten–
8.1.5. Gips

- Info:Wat gebeurt er als gips hard wordt? Gips is waterhoudend calciumsulfaat dat is verhit tot ca.130 ° C. Hierdoor verdampt een deel van het kristalwater.
Wanneer het ondergaat, vormt zich een dicht vilt van kristallen. Het water wordt afgezet als kristal water tussen de kristallen . - Moeilijkheid: eenvoudig
- Chemische stoffen: 50 g calciumsulfaat – 30 ml water
- Thema: Anorganische stoffen – reacties stofklassen – kristalwater
- Tijd: 15 min
- Begrippen: zouten– kristalwater
8.1.6. Harden van staal

- Info:Wat gebeurt er als ijzer of staal plotseling wordt afgekoeld in water? Het bloemendraad bestaat uit bijna puur ijzer (koolstofgehalte: 0,5%). Het scheermesje is gemaakt van staal (koolstofgehalte tussen 0,5% en 1,7%).Het staal kan worden gehard omdat de koolstofatomen in het staal zich bij verhitting heroriënteren en sommige verbranden tot kooldioxide . Door de heroriëntatie van de koolstofatomen ontstaan gebieden in het staal met enkele koolstofatomen en gebieden met veel koolstofatomen. De gebieden met veel koolstofatomen zijn niet erg flexibel (vergelijkbaar met grafiet ) en dus zwakke punten in de staalconstructie. Daar breekt het staal onder belasting.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Scheermesje – Bloemendraad – Glazen kom – Smeltkroes tang – Vuurvaste plaat – 30 ml water
- Thema: Anorganische stoffen – reacties stofklassen -metalen – stofeigenschappen
- Tijd: 15 min
- Begrippen: metalen
8.2. Glas
8.2.1. Glazen pipet maken

- Info:Hoe maak je zelf een glazen pipet van een glazen buisje?
- Chemisch gezien is glas een vloeistof. De deeltjes waaruit glas bestaat, zijn niet gerangschikt in een kristalrooster, maar zijn onregelmatig. De deeltjes hebben zelf nauwelijks beweging, waardoor glas een extreem hoge
viscositeit heeft
.
Door opwarming gaan de deeltjes in beweging. De bindende krachten tussen de deeltjes worden zwakker en zwakker, waardoor het glas kan worden gebogen. Wanneer de glasdeeltjes stollen, neemt de beweging van de glasdeeltjes af en nemen de krachten tussen de deeltjes toe. Het glas behoudt de vorm die de deeltjes aannamen na te zijn vervormd. - Moeilijkheid: eenvoudig
- Chemische stoffen: glazen buis (minimaal 20 cm lang)
- Thema: Anorganische stoffen – stofeigenschappen
- Tijd: 15 min
- Begrippen: smelten van glas
8.2.2. Glasproductie

- Info:Hoe kun je glas maken?
- Als gevolg van de verwarming bewegen en mengen de afzonderlijke chemische deeltjes. De kooktemperatuur wordt overschreden. Hierdoor wordt het mengsel vloeibaar. Glas wordt gevormd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20.5 g boorzuur – 5 g lithiumcarbonaat – 3,6 g soda – 3.4 g calciumcarbonaat – 2 g fijn zeezand
- Thema: Anorganische stoffen – stofeigenschappen
- Tijd: 30 min
- Begrippen: smelten van glas – vormen van glas uit oxiden






