IJzerverbindingen
1.Onderzoeksvraag
Welke verbindingen kunnen met ijzer-ionen gevormd worden?
2.Voorbereiding
a.Materiaal + stoffen
- FeSO4-oplossing 0,2 g / 1,5 ml
- plastic mapje
- 0,5 cm magnesiumlint
- weegschuitje
- NaOH-oplossing 0,4mol/l
- gedemineraliseerd water
HCl-oplossing 1 mol/l - pasteurpipetten
- H2O2-oplossing 20 vol%
- spatel
- Na2S2O3-oplossing 0,5 mol/l
- klein bekerglas
- K4Fe(CN)6.3H2O-oplossing 0,1 mol/l
- KSCN-oplossing 0,1 mol/l
- magneet
b.Opstelling (foto)

c.Etiketten

3.Uitvoeren
a.Werkwijze
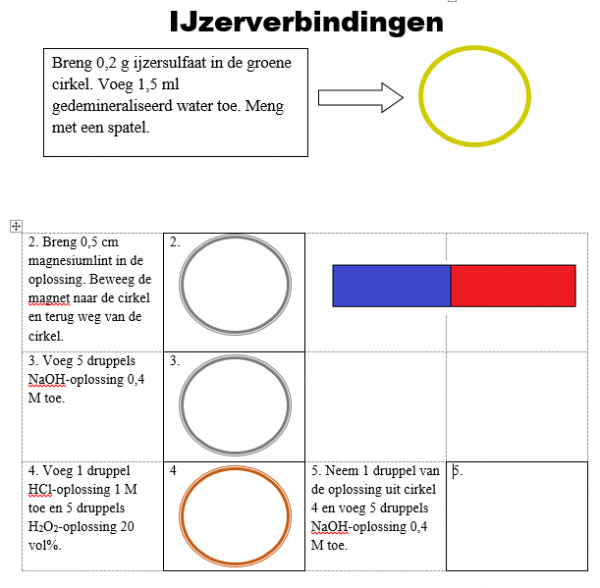
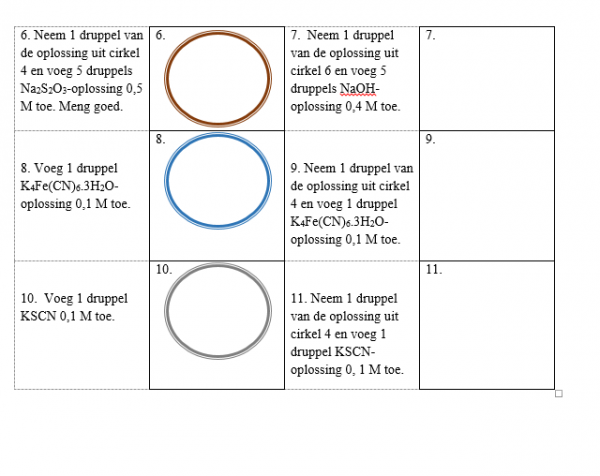
b.Waarneming (+ foto’s)

4.Reflecteren
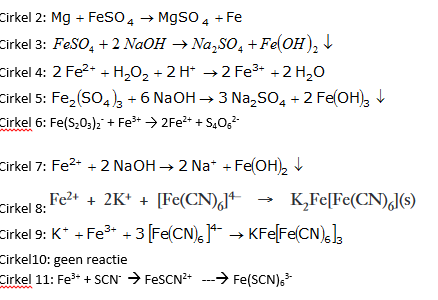
Een uitwisselingsreactie die metallisch ijzer produceert, dat magnetisch is
Mg + FeS04 –> MgS04 + Fe
Fe is een edeler metaal dan Mg
Er wordt een groen neerslag van ijzer (II) hydroxide gevormd
FeSO4 + 2NaOH –> Na2S04 + Fe (OH)2
Neerslagreactie
De oplossing wordt bruin vertrekkend van groen. IJzer II wordt geoxideerd naar bruin ijzer III. De gasbellen die verschijnen zijn de overmaat waterstofperoxide welke ontbindt.
2 Fe2+ + H2O2 + 2 H+ → 2 Fe3+ + 2 H2O
Er wordt een bruin neerslag van ijzer (III) hydroxide gevormd
Fe2(SO4)3 + 6NaOH –> 3Na2S04 + 2Fe (OH)3
Er verschijnt een donkerpaars kleur en verdwijnt dan.
De paarse kleur is een complex – Fe (S2O3)2–
Het ontbindt dan
Fe(S203)2– + Fe3+ → 2Fe2+ + S4O62-
thiosulfaat
Het ijzer III is gereduceerd tot ijzer II
Er wordt een groen neerslag van ijzer (II) hydroxide gevormd
Fe2+ + 2NaOH –> 2Na+ + Fe (OH)2
Na verloop van tijd gebeurt door oxidatie een omzetting naar Fe(OH)3
Er moet een wit neerslag zijn maar het wordt zeer snel geoxideerd tot een blauw, bekend als Turnbull’s Blauw. Dit blijkt identiek te zijn aan Pruisisch blauw verkregen met ijzer III maar met verschillende deeltjesgrootte (zie 9 hieronder)
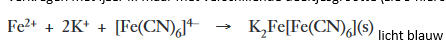
licht blauw
De kleur wordt intenser door de oxidatie onder invloed van licht van het Fe(II) naar het Fe(III)
Een donkerblauw complex, Pruisisch blauw, wordt gevormd
![]()
Met ijzer II wordt hetzelfde complex gevormd als het ijzer II eerst wordt geoxydeerd naar ijzer III.
Geen reactie
Enkel met het Fe(III)-ion vormt het KSCN een complex. De licht gele/oranje kleur is te verklaren door een gedeeltelijke oxidatie van Fe(II).
Een donkerrood complex, van een ijzer(III)thiocyanaat ion, wordt gevormd
Fe3+ + CNS– à [Fe (CNS)]2+
Deze test is specifiek voor ijzer III, maar het is zeer gevoelig en kan hierdoor een rode kleur veroorzaken met ijzer II-oplossingen door vervuiling.
Cirkel 2: Substitutiereactie
Cirkel3: Hydroxide gevormd
Cirkel 4 : Oxidatie
Cirkel 5: Hydroxide gevormd.
Cirkel 6: Complexvorming.
Cirkel 7: Hydroxide gevormd.
Cirkel 8: Oxidatie.
Cirkel 9: Complexvorming.
Cirkel 10: geen reactie.
Cirkel 11: Complexvorming.
5. Aanvullingen
Zorg ervoor dat je de bijlage afgedrukt in een plastic mapje steekt, anders worden de oplossingen rechtstreeks aangebracht op het papier (wat niet de bedoeling is). Het plastic mapje kan nadien afgewassen worden en de volgende keer worden herbruikt.






