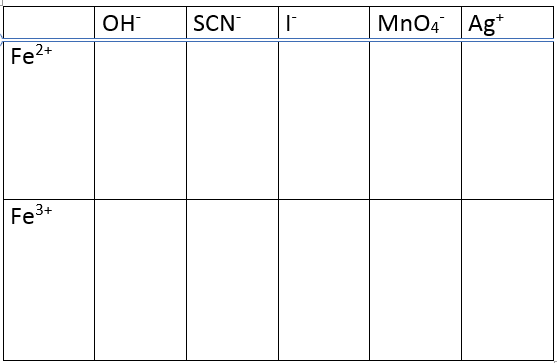
De eigenschappen van Fe2+ en Fe3+
1.Voorbereiding
a.Materiaal + stoffen
- NaOH 1 mol/l
- KMnO4 0,01 mol/l
- KI 0,2 mol/l
- FeSO4 0,2 mol/l
- Fe(NO3)3 0,2 mol/l
- AgNO3 0,2 mol/l
- KSCN 0,1 mol/
- Zetmeel 1% vers
b.Opstelling (foto)
2.Uitvoeren
a.Werkwijze
- Print bovenstaande tabel af en plastificeer het papier
- Breng telkens 1 druppel Fe(II) oplossing in de vakjes van de tweede rij
- Breng telkens 1 druppel Fe(III) oplossing in de vakjes van de derde rij
- Voeg twee druppels NaOH in elk vakje van de tweede kolom en observeer onmiddellijk en na tien minuut.
- Voeg één druppel KSCN in de derde kolom
- Voeg een druppel KI in de vierde kolom. Voeg na een minuut een druppel zetmeel toe aan alle vakjes van kolom4.
- Voeg 1 druppel KMnO4 in elk vakje van kolom 5. Observeer gedurende 10 minuten
- Voeg één druppel AgNO3 in elk vakje van kolom 6. Observeer met een vergrootglas.
b.Waarneming (+ foto’s)

3.Reflecteren
De toevoeging van NaOH geeft een gelachtige groene neerslag met Fe(II) en een bruine neerslag met Fe(III). Na bewaring wordt de Fe(OH)2 geleidelijk aan ook bruin-geel door de vorming van Fe(OH)3.
De thiocyanaarionen geven met Fe(III) een donkerrode kleur, bijna geen kleur met Fe(II). Indien de oplossing een tijdje staat wordt toch een rode kleur gevormd door de aanwezigheid van Fe(III).
Fe(III) oxideert jodide ionen tot dijood wat een blauwzwarte kleur geeft met zetmeel.
2 Fe3+ + 2 I– –> I2 + 2 Fe2+
De paarse kleur van MnO4– vermindert geleidelijk door reductie met Fe(II), Fe(III) heeft geen effect.
MnO4– + 5 Fe2+ + 8H+ –> Mn2+ + 5 Fe3+ + 4 H2O
De reactie tussen AgNO3 en Fe2+ levert metallisch zilver op. De reactie gaat niet op met Fe3+.






