Reacties met H2S
1.Voorbereiding
a.Materiaal + stoffen
- HCl 1 mol/l
- Pb(NO3)2 0,5 mol/l
- KMnO4 0,01 mol/l
- AgNO3 0,2 mol/l
- H2SO4 1 mol/l
- ZnS poeder
2.Uitvoeren
a.Werkwijze
- Maak een blad met een cirkel met grootte overeenkomstig met de petrischaal. Teken een gelijkzijdige driehoek met hoekpunten op de cirkel. Leg de petrischaal hierop, open.
- Leg op de uiteinden: 2 druppels Pb(NO3)2 aan één zijde. 2 druppels AgNO3 aan de volgende zijde.
- 2 druppels KMnO4 met 1 druppel H2SO4 in de laatste hoek.
- Plaats in het midden een schaaltje met wat ZnS poeder. Voeg hierbij 3 druppels HCl en sluit het schaaltje onmiddellijk.
- Observeer de veranderingen gedurende 15 minuten.
b.Waarneming (+ foto’s)
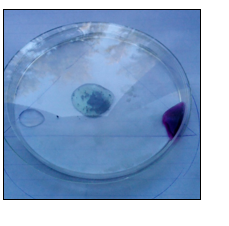
3.Reflecteren
CuS + 2 HCl –> CuCl2 + H2S
Er ontstaan geen gasbellen door de kleine hoeveelheid.
Het Pb(NO3)2 wordt geleidelijk aan donkerder door de vorming van PbS.
Het AgNO3 wordt eveneens donker door Ag2S maar minder dan bij PbS.
Het KMnO4 wordt eerst bruin en met voldoende gas kleurloos door de reductie met H2S.
2 MnO4– + 5 H2S + 6 H+ –> 5S + 2 Mn2+ + 8 H2O






