Reacties met ammoniak
1.Onderzoeksvraag
Hoe reageren verschillende stoffen op ammoniak?
2.Voorbereiding
a.Materiaal + stoffen
- Pasteurpipetten
- Petrischaal met deksel
- Lepeltje
- Ammoniak (NH₃) 2 mol/l
- Zoutzuur (HCl) 0,1 mol/l
- Kopersulfaat (CuSO₄) 0,1 mol/l
- Ijzer(II)sulfaat (FeSO₄) 0,1 mol/l
- Ijzer(III)nitraat (Fe(NO₃)₃) 0,1 mol/l
- Zinksulfaat (ZnSO₄) 0,1 mol/l
- blister
- Calciumchloride (CaCl2)
- Indicator papier
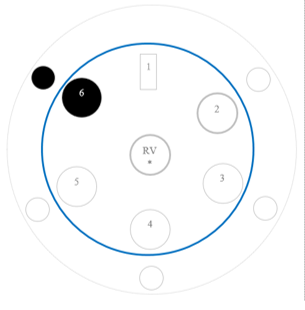
b.Opstelling (foto)

c.Etiketten

3.Uitvoeren
a.Werkwijze
- Neem uw petrischaal met dekseltje en pasteurpipetten.
- Neem de volgende stoffen: zoutzuur, kopersulfaat, ijzer(II)sulfaat, ijzer(III)nitraat en zinksulfaat.
- Neem van het indicatorpapier 2 stripjes van 1-2 cm.
- Bevochtig 1 stripje met gedestilleerd water en 1 stripje met zoutzuur. Leg beide stripjes in de petrischaal aan de rand. Zorg ervoor dat ze elkaar niet raken. Zie onderstaande tekening.
- Doe vervolgens 2 druppels aan de rand in de petrischaal voor de volgende stoffen: kopersulfaat, ijzer(II)sulfaat, ijzer(III)nitraat en zinksulfaat. Zorg ervoor dat ze elkaar niet raken. Zie onderstaande tekening
- Neem nu de blister, calciumchloride en ammoniak.
- Doe in de blister een beetje calciumchloridepoeder met behulp van een lepeltje. Zorg ervoor dat je calciumchloride zonder water gebruikt.
- Leg nu uw blister in het midden van de petrischaal.
- Doe enkele druppels ammoniak in de blister met calciumchloride en doe de deksel er direct op. Zorg ervoor dat je de deksel bij de hand hebt zodat er geen gas verloren gaat.
b.Waarneming (+ foto’s)
Wanneer je ammoniak toevoegt bij calciumchloride ontstaat er een reactie waarbij gas gevormd wordt.
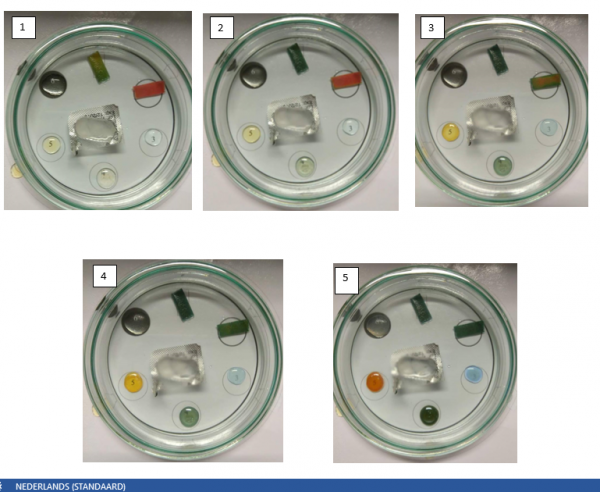
Wanneer het gas in de petrischaal zit, zie je bij het indicatorpapier van H₂O onmiddellijk een verandering. Het indicatorpapier gaat van pH 7 (kleur geel) snel over naar pH 10 (donkergroene kleur). Zie waarnemingsfoto’s 1-2
Vervolgens zie je de volgende verandering bij het indicatorpapier van HCl: pH 1 (roze kleur) gaat geleidelijk over naar pH 9 (groene kleur). Zie waarnemingsfoto’s 2-3.
Bij de stof kopersulfaat verandert de stof geleidelijk aan. Kopersulfaat verandert van lichtblauw naar donkerblauw. Zie waarnemingsfoto’s 3-5.
Bij de stoffen ijzer(II)sulfaat en ijzer(III)nitraat veranderen de stoffen ook geleidelijk aan. Beiden hebben ook 2 overgangen. Bij ijzer(III)sulfaat begint de kleur bij lichtgeel en verandert het naar donkergeel. Na enkele minuten gaat het donkergeel zelfs bruin worden.
Bij ijzer(II)sulfaat wordt stilaan de groene kleur gevormd. Het begint bij lichtgroen en gaat door naar donkergroen. Na enkele minuten gaat het donkergroen bruin worden. Zie waarnemingsfoto’s 3-6.
Als laatste stof hebben we nog zinksulfaat. Aanvankelijk nemen we bij zinksulfaat geen verandering waar. Alle andere stoffen daarentegen ondergingen al een verandering. Uiteindelijk vormt zinksulfaat een neerslag met ammoniak. Je moet wel een zwart blad onder het petrischaaltje houden anders is het niet goed zichtbaar.
Als je na een half uur terug gaat kijken, zien alle stoffen er nog hetzelfde uit, behalve bij zinksulfaat. Bij deze stof zie je dat de neerslag terug weg is. Zie waarnemingsfoto’s 5-7
4.Reflecteren

Optredende chemische reacties
CuSO₄ + 4 NH₃ –> Cu(NH₃)₄2+ + SO42-
HCl + NH₃ –> NH₄Cl
FeSO₄ + 2 NH₃ + 2 H₂O –> Fe(OH)₂ + (NH₄)₂SO₄
Fe(OH)2 oxideren tot Fe(OH)₃
5 Fe(NO₃)₃ + 5 NH₃ + 2 H₂O –> 5 Fe(OH)₃ + 10 NH₄NO₃
ZnSO₄ + 2 NH₃ + 2 H₂O –> Zn(OH)₂ + (NH₄)₂SO₄
Wanneer ammoniak bij calciumchloride wordt toegevoegd, gaat er geen nieuwe stof of complex gevormd worden. Doordat we gebruik maken van calciumchloride zonder water gaat de calciumchloride het water nemen uit de ammoniakoplossing waardoor er meer ammoniakgas vrijkomt die zich gaat verspreiden in de petrischaal.
Ammoniakgas zorgt ervoor dat bij zoutzuur het geleidelijk aan een hoger pH verkrijgt doordat het ammoniak gaat overheersen. Eerst wordt nog ammoniumchloride gevormd. Daarna gaat door de overmaat van ammoniak de ammoniak overheersen en de pH-waarde bepalen. Deze is geëindigd op pH 9.
Bij kopersulfaat gaat een complex gevormd worden door de ammoniak. Door het complex ontstaat er een donkerblauwe kleur.
Bij ijzer(II)sulfaat wordt er eerst een neerslag gevormd door de ammoniak die groen van kleur is. De neerslag die gevormd wordt, is bij Fe²⁺. Door de lucht gaat het ijzer geoxideerd worden naar Fe³⁺. Dit nam je waar door de bruine kleur die gevormd werd.
Bij ijzer(III)nitraat wordt er een neerslag gevormd door de ammoniak die een bruine kleur heeft. Deze wordt niet eerst groen omdat we niet eerst werken met Fe²⁺.
Bij zinksulfaat wordt er eerst een complex gevormd die een neerslag vormt. Deze neerslag die gevormd wordt, heeft een witte kleur. Door de overmaat van ammoniak wordt er een ander complex gevormd, het tetra-aminezink(II)complex. Dit complex zorgt ervoor dat de witte neerslag verdwijnt.






