Ijzersulfaat in zuur en basisch milieu
1.Onderzoeksvraag
Hoe reageert ijzersulfaat wanneer we deze in een basische en zure oplossing brengen?
2.Voorbereiding
a.Materiaal + stoffen
- 2 bekerglazen van 250ml
- pasteurpipet
- proefbuis
- proefbuisrek
- Ijzersulfaat
- natronloog = natriumhydroxide
- zoutzuur
b.Opstelling (foto)

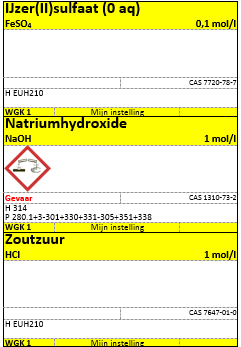
c.Etiketten
3.Uitvoeren
a.Werkwijze
- Neem een proefbuis en vul deze met 4ml ijzer(II)sulfaatoplossing van 0,1 mol/l.
- Voeg bij deze oplossing 1 ml natronloog (= natriumhydroxide 1 mol/l).
- Schud het mengsel en laat deze gedurende 2 minuten staan.
- Voeg 2ml zoutzuur van 1 mol/l toe.
b.Waarneming (+ foto’s)

4.Reflecteren
Fe2+(aq) + 2 OH–(aq) –> Fe(OH)2(s)
4 Fe(OH)2(s) + 2 H2O(l) + O2(g) –> 4 Fe(OH)3(s)
Fe(OH)3(s) + 3 H3O+(aq) –> Fe3+(aq) + 6 H2O(l)
Bij het samenvoegen ontstaat een groene neerslag. Na ongeveer twee minuten is een bruine vaste stof te zien aan de binnenkant van de buis vlak boven het vloeistofoppervlak en bovenin de vloeistof. De oplossing is geelbruin.
Bij het toevoegen van zoutzuur verdwijnt de neerslag en ontstaat een gele oplossing.
Fe2+(aq) + 2 OH–(aq) –> Fe(OH)2(s)
Groen
4 Fe(OH)2(s) + 2 H2O(l) + O2(g) –> 4 Fe(OH)3(s)
bruin
Deze reactie vindt plaats als Fe(OH)2 in aanraking komt met zuurstof.
Fe(OH)3(s) + 3 H3O+(aq) –> Fe3+(aq) + 6 H2O(l)
Lichtgele in zure oplossing






