Diffusie van een gas via microschaal
1.Onderzoeksvraag
Hoe kunnen we diffusie aantonen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Diffusie
b.Materiaal + stoffen
- Twee reeksen nucleonschaaltjes
- Geconc. NH3
- CuSO4 0,5 mol/l
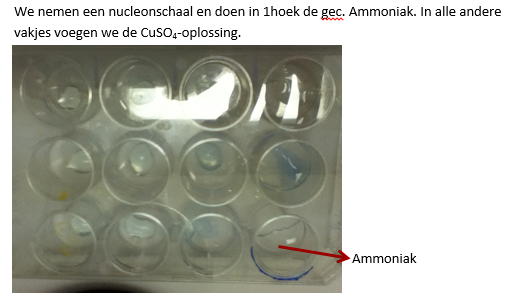
c.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
- Neem een nucleonschaal en doe in één hoek gec. Ammoniak.
- Voeg in alle andere vakjes de CuSO4-oplossing.
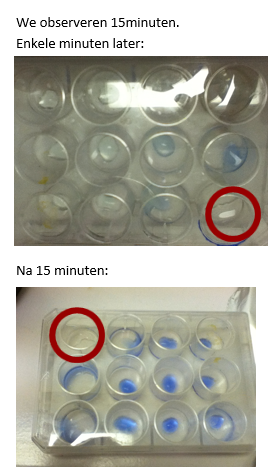
- Sluit de nucleonschaal en bestudeer 15minuten.
b.Waarneming (+ foto’s)
4.Reflecteren
We stellen vast dat het CuSO4 blauw kleurt. De vakjes dicht bij het vakje met ammoniak kleuren als eerste, later volgt de rest. Dit komt door de diffusie van ammoniak. Het verspreid zich geleidelijk aan.
In het ammoniakexperiment worden de druppels CuSO4 geleidelijk donkerder blauw door vorming van Cu(OH)2 en dan donker blauw door vorming van Cu(NH3)42+. De kleur verandert en er ontstaat een patroon. Er ontstaat dus geen gelijkmatige verdeling.
In het chloorexperiment vormen dijood met zetmeel zwarte complexen.
In beide experimenten is er een gradatie in kleurverandering afhankelijk van snelheid van diffusie van het gas.
De snelheid van diffusie is te vergelijken.
Ammoniak heeft een relatieve molecuulmassa van 17, dichloor van 71. De snelheid van beweging van geconcentreerd ammoniak en van chloor is verschillend. De snelheid komt overeen met de hypothese van Avogadro en met de Graham’s wet van gasdiffusie.






