Reactie met zilvernitraat, zwavelzuur en kaliumjodide
1.Onderzoeksvraag
Wat wordt er gevormd wanneer zilvernitraat, zwavelzuur en kaliumjodide worden samengebracht?
2.Voorbereiding
a.Materiaal + stoffen
- 2 bekerglazen van 250ml
- pasteurpipet
- proefbuis
- proefbuisrek
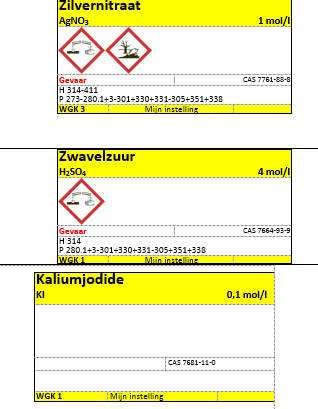
- Zilvernitraat
- zwavelzuur
- kaliumjodide
b.Opstelling (foto)

c.Etiketten
3.Uitvoeren
a.Werkwijze
- Neem een proefbuis en doe hier 1ml van 1 mol/l zilvernitraatoplossing in.
- Voeg vervolgens 1ml van 4 mol/l zwavelzuur toe.
- Voeg vervolgens enkele druppels van 0,1 mol/l kaliumjodide-oplossing toe.
b.Waarneming (+ foto’s)

4.Reflecteren
2 Ag+ (aq) + SO42-(aq) –> Ag2SO4(s)
Ag+(aq) + I–(aq) –> AgI(s)
Bij het samenvoegen ontstaat een witte neerslag (Ag2SO4). Bij toedruppelen van het KI ontstaat een gele neerslag (AgI)
2 Ag+ (aq) + SO42-(aq) –> Ag2SO4(s)
Zilversulfaat is matig oplosbaar? De concentraties zijn groot genoeg zodat
[Ag+]2*[SO42-] > KAg2SO4
Ondanks de overmaat zwavelzuur blijven er zilverionen in oplossing die met de jodide-ionen reageren.
De oplosbaarheid van Ag2SO4 bedraagt in water 8 g/l
Ag+(aq) + I–(aq) –> AgI(s)
[Ag+] [I–] > KAgI
KAg2SO4 = 1,6 10-5 en KAgI = 1,5 10-16
De oplosbaarheid van AgI bedraagt in water: 2,86 10-6 g/l






