Hoofdstuk 12 – Experimenten
1. Elektrolyse
1.1.Baardelektrolyse

- Info: Hoe kun je via elektrolyse een mannetje met baardje vormen? Door elektrolyse van een loodoplossing aan een koperdraad
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cu-draad – Pb(NO3)2-opl 0.1 mol/l
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.2. Chemisch schrijven door elektrische energie

- Info: Kunnen we schrijven zonder ons normale schrijfgerief? Bij deze elektrolyse reactie wordt jodide geoxideerd aan de anode terwijl water gereduceerd wordt aan de kathode . Aan de kathode worden waterstofbelletjes en hydroxide ionen gevormd hetgeen de oplossing basisch maakt waardoor de fenolftaleine rose kleurt .De vorming van jood zou op zich al zichtbaar zijn door de vorming van een lichtbruine kleur. De zetmeel fungeert echter als indicator en geeft aan dat er jood gevormd wordt door donker van kleur te worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KI oplossing 10g/100 ml – Zetmeeloplossing 0.5g/100 ml
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.3. Elektrisch kleuren

- Info:Hoe tonen we de elektrolyse van KI aan? Aan de pluspool trekt de batterij elektronen aan want die zijn negatief geladen. Die elektronen komen van jodiumionen, die daardoor omgezet worden in dijood. Ze kleuren stijfsel blauw.Aan de minkant worden juist elektronen afgegeven: die veranderen de watermoleculen waterstofgas :de belletjes.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumjodide (KI): ½ gram – Ascorbinezuur (C6H8O6): 0,1 gram – Stijfsel-oplossing (0,2%): 5 mL
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.4. Elektrochemische corrosie

- Info: Hoe beïnvloedt een koperdraad het roesten van een nagel/spijker? Rond het koper verschijnt de paarse kleur van het fft. Er ontstaat eveneens de kleur van berlijnsblauw
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gelatine – Fenolftaleïne oplossing in ethanol – Oplossing K4Fe(CN)6: 0, 1 mol/l
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: corrosie
1.5. Elektrochemische metaalbewerking

- Info: Hoe een gat maken met een potlood in een scheermesje? De reactie die plaats vindt is die van een metaal met zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zoutzuur – Scheermesje
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.6. Elektroforese in een petrischaal

- Info: Door de complexering van het koper(II)ion met ammoniak K = 7,1 10-14 is de concentratie te laag om met het chromaation een neerslag te vormen. Bij het ompolen zullen de kleuren door diffusie niet meer geheel mengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: agar-agar – Kaliumnitraat – 0.1M kopersulfaat – 0.1M kaliumchromaat – Geconcentreerd ammoniak
- Thema: redoxreacties
- Tijd: 30 min
- Begrippen: elektrolyse – elektroforese
1.7. Elektroforese
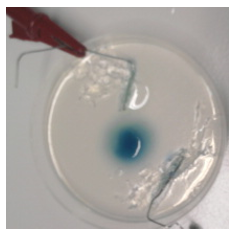
- Info: Door de complexering van het koper(II)ion met ammoniak K = 7,1 10-14 is de concentratie te laag om met het chromaation een neerslag te vormen. Bij het ompolen zullen de kleuren door diffusie niet meer geheel mengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: agar-agar – Kaliumnitraat – 0.1M kopersulfaat – 0.1M kaliumchromaat – Geconcentreerd ammoniak
- Thema: redoxreacties
- Tijd: 30 min
- Begrippen: elektrolyse – elektroforese
1.8. Elektrolyse in een aardappel

- Info:Hoe kunnen we zowel de aardappel gebruiken om een batterij als een elektrolyse cel te maken?
- Moeilijkheid: gemiddeld
- Chemische stoffen: magnesiumstaaf – aardappel – afwasmiddeloplossing (1/4de verdund) – indicatorpapier – FFT-oplossing
- Thema: redoxreacties – biochemie
- Tijd: 20 min
- Begrippen: elektrolyse
1.8. Elektrolyse in een magneetveld

- Info: Hoe kunnen we het ionentransport tijdens een reactie zichtbaar maken? De ionencirculatie is duidelijk zichtbaar aan de pluspool van de spanningsbron en de zuidpool van de batterij. Dit is te wijten aan de elektrolyse van onze Natriumsulfaatoplossing. Hierdoor stijgt de pH-waarde van onze oplossing. Bijgevolg kleurt ons fenolftaleïne terug lichtpaars. Er ontstaan aan beide polen eveneens gassen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 1M Natriumsulfaatoplossing – fenolftaleïneoplossing – 0.1M natronloog – 0.1M HCl
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.9. Elektrolyse van een kaliumjodide oplossing

- Info: Hoe kunnen we de elektrolyse van KI aantonen? Bij deze elektrolyse reactie wordt jodide geoxideerd aan de anode terwijl water gereduceerd wordt aan de kathode
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumjodide oplossing 1 mol/l – Zetmeeloplossing 1% – Fenolftaleine oplossing
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.10. Elektrolyse van water met een eigen toestel

- Info: De elektrode waaraan oxidatie plaatsvindt (elektronen worden afgestaan) is de anode. Hiervoor komt als eerste de sterkste reductor in aanmerking; dit is de stof die het gemakkelijkst elektronen afstaat. In dit geval het oplosmiddel water wat door de anodereactie wordt geoxideerd onder vorming van zuurstof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: elektrolysetoestel – zwavelzuuroplossing 1.3M
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse
1.11. Elektrolyse van water in een petrischaal

- Info: Hoe kunnen we H2-gas vormen zonder het toestel van Hoffmann? Het gevormde H2 gas aan de kathode gaat door de pipet naar de zeepoplossing waar er bubbels gaan ontstaan. Deze bubbels kunnen we aansteken met een lucifer waardoor we een luide knal horen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 koolstofelektroden (grafietstaafjes) – Verzadigde NaCl oplossing – Detergent
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse – knalproef
1.12. Elektrolyse van waterstofchloride

- Info: Door elektrolyse ontleedt zoutzuur. Vorming van waterstofgas is aan te tonen
- Moeilijkheid: eenvoudig
- Chemische stoffen: druppelflesje gevuld met HCl – oplossing
- Thema: redoxreacties
- Tijd: 10 min
- Begrippen: elektrolyse – knalproef
1.13. Ionmigratie

- Info: Hoe kunnen we de positieve en negatieve ionen in een stof als koperchromaat van elkaar scheiden? Als we koperchromaat aanbrengen op een elektrolytoplossing en we brengen een spanning aan. Verschuiven de positieve ionen naar de negatieve pool en de negatieve ionen naar de positieve pool.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniumchloride – Amoniakoplossing geconc – Gedestilleerd water – Koper(II)sulfaat – Kaliumchromaat
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse – identificatie
1.14. Kleurige ontleding
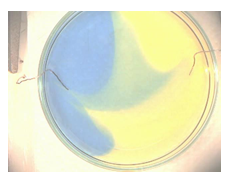
- Info: Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen? Er worden H+ -ionen gevormd aan de positieve pool en OH– -ionen gevormd aan de negatieve pool. Aan de positieve pool krijgen we dus een meer zurige oplossing, geel, en aan de negatieve pool krijgen we een meer basische oplossing, blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ged. water – Natriumsulfaat – Broomthymolblauwoplossing 0,1%:1 mL
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse – identificatie
1.15. Micro-elektrolyse met indicatorpapier

- Info: Het toegevoegde zuur en de base die aan de kathode ontstaat neutraliseren elkaar.De toegevoegde base en het zuur dat aan de anode ontstaat neutraliseren elkaar.Aan de anode kan men ook de corrosie van ijzer tot Fe2+-ionen aantonen, bijvoorbeeld met hexacyanoferraat(III)
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2SO4-opl verzadigd – NaOH 1M – HCl 1M
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse – identificatie
1.16. Schrijven en uitvegen van geheime boodschap met elektrische stroom

- Info: Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen? Schrijf een boodschap met de nagel. Indien dit niet lukt pas de spanning aan. Er ontstaat een donkerblauwe boodschap. Na een tijd wordt omgepoold en wordt terug met de nagel over de boodschap gewreven. De boodschap verdwijnt.
- Moeilijkheid: gemiddeld
- Chemische stoffen:NaCl – tff of fft oplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.17.Ionuitwisseling aantonen met rodekoolsap

- Info: Welk resultaat krijgen we bij elektrolyse van rode koolsap? Aan de anode ontstaat een geel/groene kleur. Dit komt omdat er protonen worden vrijgemaakt waardoor het anhydrobase (pH = 6-7) reageert tot chalcone (pH > 8)Aan de kathode ontstaat een rode kleur. Dit komt omdat de protonen reageren met het anhydrobase ter vorming van flavylium cation.
- Moeilijkheid: gemiddeld
- Chemische stoffen: elektrolysetoestel – Rode koolsap
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.18. Tindendrieten

- Info: Wat neem je waar tijdens de elektrolyse van tinchloride? Veel metalen vormen een neerslag als een elektrische stroom door een oplossing van hun zouten stroomt, maar alleen tin biedt zo’n spectaculaire dendriet.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Tin(II)chloride 0,5 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.19. Zink elektroplating

- Info: Hoe kunnen we koper een zilveren kleur geven met behulp van stroom? Het aansluiten van de negatieve kabel op de koperelektrode levert elektronen aan de koperelektrode. De Zn2+ ionen in oplossing nabij de koperelektrode winnen elektronen om zinkatomen te vormen. De zinkatomen worden op de koperelektrode uitgezet als metallisch zink
- Moeilijkheid: eenvoudig
- Chemische stoffen: Salpeterzuur 0,25mol/l-0,4 mol/l – Koperfolie – Zinkfolie – 30ml natriumhydroxide 0,4mol/l – 5ml zinksulfaat 0,1mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:15 min
- Begrippen: endo-energetische reacties – elektrolyse
1.20. Ijzer-koper element

- Info: Wat gebeurt er bij een elektrolyse van pekel met een ijzer/koper element?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Demiwater – Fenolftaleïne – Natriumchloride 20% – Kaliumhexacyanoferraat 1%
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:15 min
- Begrippen: endo-energetische reacties – elektrolyse
1.21. Elektrolyse van kopersulfaat

- Info: Wat gebeurt er bij de elektrolyse van een kopersulfaatoplossing? De negatieve grafietelektrode trekt Cu2+ ionen (van kopersulfaat) aan. Aan de positieve grafietanode wordt zuurstofgas gevormd door oxidatie van de hydroxide ionen die zich in de kopersulfaatoplossing bevinden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kopersulfaat 0,5mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:15 min
- Begrippen: endo-energetische reacties – elektrolyse
1.22. Beweging van kaliumpermanganaat in een spanningsveld

- Info: Hoe kunnen permanganaationen bewegen in een spanningsveld ? De MnO4– bewegen naar de positieve pool en vormen op elk moment een paarse kleurdoor de aanwezigheid van K-ionen.De MnO4– ionen worden aangetrokken doordat er aan de positieve pool elektronen worden weggehaald en dus gaan de negatieve MnO4– ionen naar de ijzeranode.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Demiwater – Kaliumnitraat 5% oplossing – Kaliumpermanganaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:15 min
- Begrippen: endo-energetische reacties – elektrolyse
1.23. Beweging ionen in een spanningsveld

- Info: Wat gebeurt er tijdens de elektrolyse van een oplossing van kopersulfaat/kaliumchromaat in agar-agar? De koperionen van kopersulfaat gaan naar negatieve pool waardoor er een blauwe kleur naar daar trekt. De chromaationen van kaliumchromaat gaan naar de positieve pool waardoor er een gele kleur naar daar trekt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Demiwater – Agar-agar – Kaliumnitraat – Geconcentreerde ammonia – Kopersulfaat – Kaliumchromaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – diffusie
1.24. Haargroeimiddel voor Harry Koperdraad

- Info: Hoe kunnen we Harry door middel van koperdraad een baard laten groeien? Door de elektrische stroom die door de koperdraad bij Harry zijn voeten en baard stroomt, wordt de loodnitraatoplossing ontleed. Bij de voeten of de positieve pool zal zich een vormen. Bij de baard of de negatieve pool zijn de loodionen te vinden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Looddinitraat-oplossing (Pb(NO3)2) 0,1 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – dendrieten
1.25. Elektrolyse in een nunclon

- Info: Welke stoffen worden er gevormd bij de elektrolyse en hoe tonen we dit aan? Op verschillende manieren gebeurt de elektrolyse, afhankelijk van de samenstelling.
- Moeilijkheid: eenvoudig
- Chemische stoffen: natriumsulfaatoplossing Na2SO4 1 mol/l – Thymolblauw – Verzadigde keukenzoutoplossing NaCl verzadigd – Fenolftaleïne – Kopersulfaatoplossing CuSO4 1 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – dendrieten
1.26. Elektrolytische productie van zink

- Info: Hoe kunnen we een heroplaadbare batterij maken? Het bruine neerslag bestaat uit loodoxide. Het gas is voor zuurstof. Het metaal, dat zich op de Aluminiumfolie bevindt, is zink.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Aluminiumplaatje – 10 g zinksulfaat – Zwavelzuur 100 ml 1mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – galvanische cel
1.27. Blauwe letters op een geel papier

- Info: Hoe kunnen we een papiertje een gele achtergrond geven en vervolgens blauw laten kleuren zonder pennen of stiften te gebruiken? De alkoholische broomthymolblauwoplossing is geel gekleurd en daarom dus zuur. Het natriumchloride dissocieert in het water en dient als elektrolyt om de stroom te geleiden. Aan de – pool zal een chemische reactie gebeuren waardoor plaatselijk NaOH gevormd wordt, en aangezien dit een base is zorgt dit ervoor dat de broomthymolblauw blauw kleurt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Tafelzout (natriumchloride) of kaliumchloride – Broomthymolblauw – Ethanol
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – zuur-base indicator – galvanische cel
1.28. Dendrieten

- Info: Hoe maken we dendrieten van tin? Tin(II)ionen worden geoxideerd tot een onoplosbaar neerslag van tin (IV) chloride-ionen bij de anode en gereduceerd tot metaalachtig tin bij de kathode.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Tin(+II)chloride.2H2O (11,9 g) – water (30 ml) – azijnzuur (10ml) (70%)
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – dendrieten
1.29. Ionenmigratie met ijzerchloride

- Info: Wat gebeurt er als geladen atomen (ionen) in een elektrisch veld komen?
- Kaliumpermanganaatoplossing : De negatief geladen, violette permanganaationen (MnO 4 – ) migreren naar de positieve pool. Ze worden aangetrokken door het elektrische veld. Geleidelijk ontbinden ze tot bruin mangaandioxide (MnO 2 ). De positief geladen kaliumionen (K + ) zijn kleurloos en daardoor niet zichtbaar.
- Koper (II) sulfaatoplossing : De positief geladen koper (II) ionen (Cu 2+ ) migreren ook naar de negatieve pool door het elektrische veld. De kleurloze sulfaationen (SO 4 2- ) migreren naar de positieve pool.
- IJzer (III) chloride-oplossing : IJzer (III) -ionen zijn donkerbruin. Omdat ze positief geladen zijn (Fe 3+ ), migreren ze naar de negatieve pool in het elektrische veld. De kleurloze chloride-ionen (Cl – ) kunnen worden gedetecteerd met de zilvernitraatoplossing . De kleurloze zilvernitraatoplossing vormt samen met de chloride-ionen wit zilverchloride.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 g agar – 20 g kaliumnitraat – 20 ml water – 1 druppel kopersulfaat 0.1 mol/l – 1 druppel kalimpermanganaat 0.02 mol/l – 1 druppel verzadigde ijzer(III)chloride oplossing – 1 druppel zilvernitraatoplossing 0.1 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.30. Elektrolyse van zinkjodide

- Info: Wat gebeurt er als u een zinkjodide-oplossing elektrolyseert? De jodium anionen (I – ) migreren naar de positieve pool , omdat ze zich aangetrokken voelen als negatief geladen deeltjes. Ze geven hun elektron op aan de positieve pool. De jodium anion (I – ) wordt elementair jood in de vorm van jood moleculen (I 2 ).
Het zink migreert naar de negatieve pool-Kationen (Zn 2+ ), omdat ze als positief geladen deeltjes worden aangetrokken. Ze pikken twee elektronen op bij de negatieve pool. Het zink kation (Zn 2+ ) wordt elementair zink in de vorm van zinkmetaal (Zn). - Moeilijkheid: eenvoudig
- Chemische stoffen: 10 g zinkjodide – 100 ml water
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.31. Elektrolyse van keukenzout

- Info: Wat gebeurt er als je een keukenzoutoplossing onder spanning zet? Als je stroom door een keukenzoutoplossing laat vloeien, treedt er een analyse op omdat keukenzout verder ontleed wordt. Zowel het waterstofgas als het chloorgas zijn gevaarlijke stoffen. Chloorgas of mosterdglas is giftig en waterstofgas is zeer explosief.
- Moeilijkheid: eenvoudig
- Chemische stoffen: keukenzout en gedestilleerd water
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse – elektrische geleiding
1.32. Gekleurde elektrolyse van water

- Info: Hoe kun de elektrolyse van water visueel aantonen? Er ontstaat zuurstofgas, waterstofgas en pH-verandering wat aantoonbaar is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4,2 g natriumsulfaat – methylroodindicator (1 g in 60 ml 95% ethanol) – tff indicator (1,5 g thymolftaleïne indicator in 60 ml 95 % ethanol)
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.33. Elektrolyse kaliumpermanganaat en kopersulfaat

- Info: Welke reactie treedt op als we enkele kristallen KMnO4/CuSO4 in een druppel water brengen en elektrolyse uitvoeren?
Bij de elektrolyse van koper(II)sulfaat wordt koper afgezet op de kathode. Aan de anode komt zuurstof vrij en de zuurtegraad van de oplossing gaat naar beneden door vrijkomen van waterstofionen. In zuur milieu wordt in het paarse gereduceerd tot het kleurloze . Waardoor de oplossing ontkleurt aan de kathode
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 en KMnO4 kristallen
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.34. Elektrolyse tin(II)chloride

- Info: Welk effect geeft elektrolyse van tin(II)chloride? In de buurt van een van de clips vindt een reactie op het verminderen van de tin plaats: Sn2+ (oplossing) + 2e– → Sn (vast) Tin is een metaal dat neerslaat (vormt een vaste stof) als vast elementair blik. De tin-dendriet groeit in de richting dat de elektrische stroom door de oplossing stroomt
- Moeilijkheid: eenvoudig
- Chemische stoffen: SnCl2-oplossing 0,5 mol/l (filtreer de eventuele neerslag af)
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:20 min
- Begrippen: endo-energetische reacties – elektrolyse – dendrieten
1.35. Elektrolyse van koper(II)chloride

- Info: Welke reactieproducten ontstaan door de elektrolyse van koper(II)chloride? Door de elektrolyse en toegevoerde stroom ontleedt CuCl2
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuCl2 0,5 mol/l – KI 0,1 mol/l – KBr 0,5 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.36. Elektrolyse van koper(II)chloride en dichloor aantonen

- Info: Wat gebeurt er bij elektrolyse van koper(II)chloride en hoe kun je dichloor aantonen? Na toevoegen olie (en even wachten) Bruine kleur verdwijnt aan de grens van de olie en oplossing. Aan de kathode slaat koper neer, aan de anode vormt chloorgas
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuCl2 -oplossing 0,1 mol/l – KI-oplossing 0,2 mol/l – Plantaardige olie
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.37. Elektrolyse van water in een mini-Hoffmann apparaat

- Info: Wat gebeurt er bij elektrolyse van water? Enkel gasontwikkeling aan de beide elektroden kon worden geobserveerd. De gasvorming kon geobserveerd worden. Door de OH– en H+ ionen was er ook een kleuromslag van het methylrood verwacht: de zure omgeving aan de anode een rode kleur
- Moeilijkheid: eenvoudig
- Chemische stoffen: methylroodoplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.38. Microscale elektrolyse van koperchloride

- Info: Welke reactieproducten ontstaan door de elektrolyse van koper(II)chloride? Door de elektrolyse en toegevoerde stroom ontleedt CuCl2
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuCl2 0,5 mol/l – KI 0,1 mol/l – KBr 0,5 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.39. Fractalen met zilver

- Info: Hoe kun je zilverfractalen maken? De oplossing met zilverchloride reageert aan de koperen draad. Er treedt een verdringingsreactie op met vorming van zilverdendrieten.
- Chemische stoffen: zilvernitraat (AgNO3)-oplossing 0,1 mol/l – NaCl-oplossing 0,1 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.40. Schrijven met kaliumjodide/fenolftaleïne elektrolyse

- Info: Hoe kun je een boodschap schrijven met elektrische energie? Het gevormde dijood kleurt blauwpaars met toegevoegd zetmeel. Door contact te maken met de nagel is het circuit gesloten en treedt de reactie op. Door een mengsel te maken is ook een mengkleur van het donker paars van dijood in zetmeel en het lichtpaars van de kleuromslag van fenolftaleïne zichtbaar.
- Chemische stoffen: oplossing van 10% KI in de zetmeeloplossing – zetmeeloplossing 0,5% – fenolftaleïne-oplossing 0,05%
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd:25 min
- Begrippen: endo-energetische reacties – elektrolyse
2. Galvanische cel
2.1. Aardappelbatterij

- Info: Hoe kunnen we met aardappelen elektrische energie vormen? In de aardappel-batterij wordt chemische energie omgezet naar elektrische energie door een spontane overdracht van elektronen.
In dit geval reageert het zink van de nagel met het koper van de koperdraad. - Moeilijkheid: eenvoudig
- Chemische stoffen: 2 koperen strips – 2 zinken strips – 2 (stukken) aardappelen
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
2.2. Aluminiumbatterij

- Info: Hoe kunnen we een batterij bouwen met aluminium? Het in water opgeloste zuurstof wordt door deze elektronen gereduceerd en vormt hydroxide ionen. Aan de anode wordt het Aluminium geoxideerd. Het aluminiumhydroxide dat gevormd wordt vormt een wit neerslag op de elektrode.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koperen plaatje – Aluminium plaatje – Demi-water – Zout – Bleek (Chloor)
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel
2.3. Blik geeft stroom

- Info: Hoe kan een blikje energie geven? Door een galvanische cel te bouwen waarbij er een reactie optreedt met het aluminium van dit blikje.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2mol/l NaCl – 2mol/l KNO3 oplossing – blikje bier
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel

- Info: Hoe maken we een batterij? Aan de anode ontstaan zinkionen. Aan de andere elektrode wordt het koper(II)ion gereduceerd; het Cu2+ ion neemt twee elektronen op en slaat als een koperlaagje op de kathode neer.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kopersulfaat (CuSO4) – Zinksulfaat (ZnSO4) – Kaliumchloride (KCl) – Demiwater – Cu-staafje of plaatje – Zn-staafje of plaatje
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
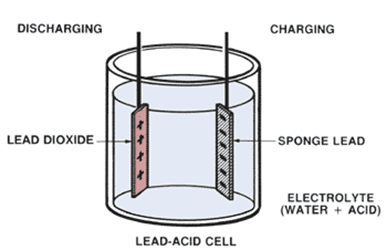
- Info: Hoe kan een herbruikbare batterij maken? Het oppervlak van de loodstrips reageren echter met zwavelzuur ter vorming van loodsulfaat. Met een opgelegde spanning ontstaat elektrolyse van het zwavelzuur. Zuurstof wordt afgegeven aan de anode en waterstofgas aan de kathode. Op hetzelfde moment gebeurt een oxydatie van lood naar Pb4+.Twee verschillende elektroden vormen een geleidingsproces met een spanningsverschil van ongeveer 2V. Indien de cel gebruikt wordt als bron keren de reacties om.
- Moeilijkheid: gemiddeld
- Chemische stoffen: loodfolie 0,2mm 250g – zwavelzuur 0.5 mol/l – batterij 4,5 V
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel -elektrolyse

- Info: Hoe krijgen we wisselstroom uit een blikje cola? De veranderingen in de spanning – en de resulterende pulserende werking van de motor – kan worden toegeschreven aan elektrochemische reacties aan de beide elektroden Het oscillerend karakter ontstaat door het combineren van de eigen oscillerende elektroden aan elkaar. Hierdoor krijgt men een elektrochemische cel die een pulserende stroom vrijgeeft .
- Moeilijkheid: gemiddeld
- Chemische stoffen: zwavelzuuroplossing 0.5mol/l – Kaliumbromaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel -elektrolyse
2.7.Fruitsapklok

- Info: Door de chemische reacties die optreden in de fruitsap ontstaat elektrische energie. Dit is een voorbeeld van een exo-energetische reactie met vorming van elektrische energie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: fruitsap – 20 tot 30 cm magnesiumlint, aan één uiteinde opgerold rond b.v. een ijslollystokje; – 20 tot 30 cm koperdraad, aan één uiteinde opgerold;
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
2.8.Colabatterij

- Info: Hoe kunnen we een batterij maken met cola die sterk genoeg is voor een LED-lampje te laten branden? Door een galvanische cel te maken en cola dient als zoutbrug.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola – 3 Koperelektrode – 3 Zinkelektrode of magnesiumelektrode
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
2.9. Een oplaadbare batterij maken

- Info: Hoe kunnen we een oplaadbare batterij maken? De elektrolyse gebeurt tussen de elektroden met vrijzetting van waterstofgas aan de negatieve pool en zuurstofgas aan de positieve pool. Twee verschillende elektroden vormen een geleidingsproces met een spanningsverschil van ongeveer 2V. Indien de cel gebruikt wordt als bron keren de reacties om.
- Moeilijkheid: eenvoudig
- Chemische stoffen: loodfolie – platte batterij van 4.5V – motortje 2V (schakeling van lampje) – zwavelzuuroplossing 5%
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel – elektrolyse
2.10. Geef een schok

- Info: Kunnen citroenen, koperen munten en andere munten stroom geven? Het citroensap is een zure oplossing die de elektriciteit die gemaakt werd door de 2 verschillende metalen van de munten geleidt. Meestal gebruikt men koper en zink. De standaardpotentiaal voor koper en zink half-cel reacties die dan gebruikt worden
- Moeilijkheid: eenvoudig
- Chemische stoffen: een citroen – stroken keukenpapier van 2,5 cm op 5 cm – 5 koperen munten – 5 andere munten, niet koper of aluminiumfolie
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel
2.11. Het autootje op zonne-energie

- Info: Wanneer we de energiebron op het autootje aansluiten, ontstaat er een chemische reactie met het water. Het water splitst zich namelijk op in waterstofgas in het ene vaatje en zuurstofgas in het andere vaatje.
- Moeilijkheid:gemiddeld
- Chemische stoffen: Kleine versie van het toestel van Hoffman – brandstofcel
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – ontleding water – knalgas – galvanische cel – elektrolyse
2.12. Galvanische elementen

- Info: Waarin verschillen galvanische elementen van elkaar? We kregen het hoogste voltage bij de combinatie van koper en magnesium, namelijk 2,01 V.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koperelektroden – Zinkelektroden – Magnesium elektroden – Geconcentreerde zoutoplossing :(zout: kaliumnitraat of natriumsulfaat) – Kopersulfaat-oplossing CuSO4 0,5 mol/l – Zinksulfaat-oplossing ZnSO4 0,5 mol/l – Magnesiumsulfaat-oplossing MgSO4 0,5 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel
2.13. Loodbatterij

- Info: Hoe kunnen we een batterij maken van lood en zwavelzuur? We hebben een loodbatterij kunnen maken. Dit doen we door loodelektroden in een zuur milieu te brengen en dan voeren we een elektrolyse uit. De reacties aan de anode en kathode zijn hierboven te zien. Zo laden we de batterij op. Als we de elektroden na de analyse aansluiten op een voltmeter kunnen we zien dat de batterij opgeladen is, door het voltage dat de voltmeter toont.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Loodelektroden – Zwavelzuuroplossing H2SO4 3 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel
2.14. Menselijke batterij

- Info: Hoe kunnen we een batterij bouwen met een constante spanning? Door zelf de zoutbrug te maken met 2 halfcellen te koppelen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 mol/l CuSO4 – 1 mol/l ZnSO4 – Zn elektrode – Cu elektrode
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel
2.15. Galvanische cel

- Info: Hoe kunnen we een batterij bouwen met een constante spanning? Door zelf de zoutbrug te maken met 2 halfcellen te koppelen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 mol/l CuSO4 – 1 mol/l ZnSO4 – Zn elektrode – Cu elektrode
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – galvanische cel
2.16. Droge cel

- Info: Hoe kunnen we zelf een AA-batterij maken? Een droge cel bestaat uit een kathode (metaal of grafiet) omgeven door een vochtige elektrolytische pasta. De pasta is ingesloten in de anode en de hele cel is meestal verpakt in een ander materiaal om lekkage te voorkomen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mangaanoxide – Ammoniumchloride – Zinkplaatje
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 40 min
- Begrippen: exo-energetische reacties – galvanische cel
2.17. Citroenbatterij

- Info: Hoe kunnen we een batterij maken met citroenen? Door de zure eigenschappen van een citroen (of citrusvrucht) is het mogelijk om een spanning op te wekken met behulp van 2 elektroden bestaande uit 2 metalen die samen een REDOX koppel vormen. De elektronen van de oxidator komen vrij en migreren naar de reductor.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koperplaatje – Magnesiumplaatje of zinkplaatje – Citroen
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 40 min
- Begrippen: exo-energetische reacties – galvanische cel
2.18. De Zelfgemaakte Batterij

- Info: Hoe kunnen we een Leclanché batterij namaken? Hierbij zal het zink een oxidatiereactie ondergaan en het MnO2 een reductie reactie ondergaan met de gevormde elektronen van de oxidatiereactie. Hier zal een spanning worden opgewekt die te meten
- Moeilijkheid: eenvoudig
- Chemische stoffen: KOH – korrels – 50 ml water – Een mengsel van 8 gram MnO2 en 3 gram actieve kool – Een Zn-buisje
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 40 min
- Begrippen: exo-energetische reacties – galvanische cel
2.19. Zink-koolstofbatterij

- Info: Hoe maak je zelf een simpele batterij? De rotor draait continu zolang beide elektroden (zinkplaat en koolstofstaaf) de elektrolyt (zout water) raken. Als beide elektroden elkaar raken, stopt de rotor onmiddellijk. Als je de aansluitingen verwisselt, draait de rotor in tegengestelde richting. De zinkplaat, die aan het begin van het experiment glanzend was, wordt mat naarmate het experiment vordert.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koolstofelektrode – 1 strip zinkstaal – 50 ml water – 10 g keukenzout – 10 ml 0.5 mol/l HCl
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
2.20. Spanning vormen

- Info: Hoe kunnen we in een petrischaal verschillende spanningen vormen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Enkele metalen (koper, lood, zink en aluminium) – Een stukje filtreerpapier doordrenkt met 3,5 mol/l KCl-oplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
2.21. Daniëllcel in een nunclonschaaltje

- Info: Hoe kun je een mini galvanische cel vormen met zink en koper? De spontane stroom van elektronen van anode naar kathode genereert een stroom met een spanning nabij de theoretische E°-cel voor deze halfcellen (1,10 V).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zinkplaatje – Koperplaatje – Zinksulfaatoplossing (ZnSO4) 1 mol/l – Koper(II)sulfaatoplossing (CuSO4) 1 mol/l – Verzadigde kaliumchloride-oplossing (KCl)
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
3. Redoxreacties
3.1 Algemeen
3.1.1. Enkele redoxreacties

- Info: Hoe kun je redoxreacties visualiseren? Er treedt geen reactie op tussen de koper(II)oplossing en het bromide of chloride. Toevoeging aan KI geeft een licht bruine neerslag van CuI. Toevoeging van een zetmeeloplossing geeft een blauw-zwarte kleur wat aangeeft dat dijood is gevormd.Toevoeging van Fe(II) aan AgNO3 geeft Ag-metaal aan te duiden met de glittering.De toevoeging van een druppel KSCN geeft een rode kleur wat aangeeft dat Fe(III) is ontstaan. Ook een witte neerslag van AgSCN ontstaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KBr 0,2 mol/l – KI 0,2 mol/l – NaCl 0,2 mol/l – AgNO3 0,1 mol/l – CuSO4 0,2 mol/l – FeSO4 0,2 mol/l – KSCN 0,1 mol/l – zetmeeloplossing 1% – Fe(NO3)3 0,2 mol/l
- Thema: chemische reacties – redoxreactie
- Tijd: 30 min
- Begrippen: oxidatie – reductie
3.1.2. Katalyse van redoxreacties door koperionen

- Info: Hoe katalyseren koperionen de reactie tussen Fe3+ en thiosulfaatoplosing? Katalysatoren zijn stoffen die een reactie kunnen versnellen zonder zelf gebruikt te worden. Met koperionen (Cu2+) kan men een breed scala van redoxreacties versnellen.Koperionen katalyseren de reactie van Fe3+ met thiosulfaat
- Moeilijkheid: eenvoudig
- Chemische stoffen: IJzernitraat (Fe(NO3)3.9H2O) : 0.05 mol/l – Natriumthiosulfaat (Na2S2O3.5H2O) : 0.1 mol/l – Kopersulfaat (CuSO4.5H2O) : 5% kopersulfaat oplossing
- Thema: chemische reacties – redoxreactie
- Tijd: 20 min
- Begrippen: oxidatie – reductie
3.1.3. Redoxreacties met halogenen

- Info: Hoe kunnen we de spanningsreeks van niet-metalen aantonen met een luciferdoosje? Het schuuroppervlak van luciferdoosjes bevat chloraat. Met zoutzuur ontstaat een redoxreactie waarbij chloraat reduceert tot chloor.
- Moeilijkheid: eenvoudig
- Chemische stoffen: luciferdoosje – KI oplossing 1 mol/l – 10% zoutzuuroplossing
- Thema: chemische reacties – redoxreactie
- Tijd: 15 min
- Begrippen: oxidatie – reductie – spanningsreeks halogenen
3.1.4. Reactie tussen ijzersulfaat en zilvernitraat
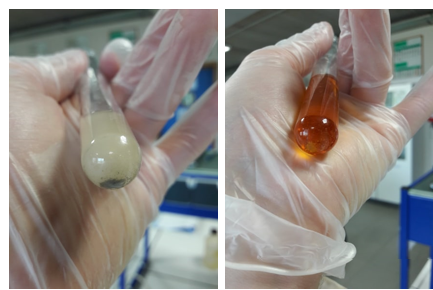
- Info:Welke reactie treedt er op en wat gebeurt er wanneer we ijzer(II)sulfaat en zilvernitraat en later ijzer(III)nitraat bij elkaar voegen? De oplossing krijgt een licht grijze kleur en op de bodem vormt er zich een grijs/zwarte neerslag.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1 mol/l FeSO4 oplossing – 0,1 mol/l AgNO3 oplossing – 1 mol/l Fe(NO3)3 oplossing
- Thema: chemische reacties – redoxreactie
- Tijd: 15 min
- Begrippen: oxidatie – reductie – spanningsreeks halogenen
3.1.5. Werking van een ontkleuringsmiddel en javel

- Info: Hoe werken ontkleuringsmiddelen en bleekmiddelen? Bleekmiddelen werken oxidatief, ze bevatten meestal peroxiden die atoom- of singletzuurstof afgeven. Ze zijn aanzienlijk reactiever dan zuurstof uit de lucht. Bleekmiddelen kunnen ook hypochloriet bevatten, waaruit chloor wordt gevormd dat verantwoordelijk is voor het bleek effect. Ontkleuringsmiddelen werken reductief, ze bevatten meestal dithioniet. Dit is een sterk reductiemiddel en kan veel kleurstoffen omzetten in een kleurloze of lichtgekleurde leucovorm.
- Moeilijkheid: eenvoudig
- Chemische stoffen: paaseikleuren (of andere kleurstoffen voor voedingsmiddelen) – bleekmiddel – ontkleuringsmiddel
- Thema: chemische reacties – redoxreactie
- Tijd: 20 min
- Begrippen: oxidatie – reductie
3.1.6. Chemische gom

- Info: Hoe kan je inkt laten verdwijnen? Kaliumpermanganaat KMnO4 is een sterk oxidatiemiddel. Dit betekent dat permanganaat reageert met verschillende stoffen en hun elektronen wegneemt. Kleurstoffen zijn specifieke stoffen die verantwoordelijk zijn voor de inktkleur. Kaliumpermanganaat oxideert kleurstoffen terwijl de structuur verandert. Dat is de reden waarom kleurstoffen, en dus ook inkt, ontkleuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: filtreerpapier – KMnO4 – 5 mol/l NaHSO4 – CH3COONa 3 H2O – 0,5 mol/l Na2S2O5
- Thema: chemische reacties – redoxreactie
- Tijd: 20 min
- Begrippen: oxidatie – reductie
3.1.7. Reactie tussen magnesium en natriumsulfiet in zuur milieu

- Info: Welke stof wordt er gevormd als we natriumsulfiet met magnesium laten reageren in een zuur milieu. Hoe kunnen we dit aantonen? Plaats een stukje magnesiumlint (5 cm) in een mengsel van 3 ml 0,01 mol/l natriumsulfietoplossing en 1 ml 1 mol/l zwavelzuuroplossing. Houd een stukje indicator papier van loodacetaat in de buis. Er treedt een duidelijk gasontwikkeling op en het indicatorpapiertje met loodacetaat indicator wordt bruinzwart.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,01 mol/l Natriumsulfietoplossing – 1 mol/l Zwavelzuuroplossing – Magnesiumlint
- Thema: chemische reacties – redoxreactie
- Tijd: 15 min
- Begrippen: oxidatie – reductie – identificatiereactie
3.1.8. Doorzichtige cola

- Info: Hoe kunnen we cola, een ondoorzichtige drank, doorzichtig maken met behulp van een chemische reactie? We kunnen cola ontkleuren door bleekwater toe te voegen en de kleurstof om te zetten in zijn kleurloze leuco-vorm.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola – Bleekwater
- Thema: chemische reacties – redoxreactie
- Tijd: 10 min
- Begrippen: oxidatie – reductie – identificatiereactie
3.1.9. Reductie van ijzer(III)oxide

- Info: Hoe kun je ijzer bekomen uit ijzer(III)oxide? Koolstof is reactiever dan ijzer. Het ijzeroxide wordt door de koolstof gereduceerd tot metallisch ijzer.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Enkele korrels Fe2O3 – Enkele korrels NaCO3
- Thema: chemische reacties – redoxreactie
- Tijd: 10 min
- Begrippen: oxidatie – reductie – identificatiereactie
3.2. Redoxreacties met dichromaat
3.2.1. Chemische amoebe in een petrischaal

- Info: Wat zal er gebeuren als men cyclohexanol toevoegt aan een oplossing van kaliumdichromaat en zwavelzuur?De pulserende veranderingen van grootte en vorm van de deeltjes ontstaat door de gedeeltelijke oxidatie van cyclohexanol door het kaliumdichromaat in zuur milieu tot cyclohexanon. De druppels veranderen in vorm door de verandering van oppervlaktespanning door wisselende verhouding van cyclohexanol en cyclohexanon.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Kaliumdichromaat – Zwavelzuur – Cyclohexanol
- Thema: stofeigenschappen – organische stoffen
- Tijd: 15 min
- Begrippen: osmose – diffusie – redoxreactie – microschaal – pulserende werking
3.2.2. De alcoholtest

- Info: Wat zal er gebeuren als ethanol in contact komt met kaliumdichromaat? Na een minuut ontstaat een groene kleur van Cr3+ in de dichromaatoplossing welke geleidelijkaan de oranje kleur omzet naar geel-groen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 5% K2Cr2O7 oplossing – H2SO4 geconcentreerd – Ethanol 97%
- Thema: anorganische stoffen– redoxreactie – organische stoffen
- Tijd: 25 min
- Begrippen: zouten – identificatie ethanol
3.2.3. Propaan-1-ol in dichromaat

- Info: Wat zal er gebeuren als we een mengsel van propan-1-ol, kaliumdichromaat en zwavelzuur enkele minuten laten staan? De oranje kleur van het mengsel verandert in blauwgroen. Er is een aparte geur waarneembaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Propan-1-ol – K2Cr2O7 (0,1mol/l) – H2SO4 (4 mol/l)
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: organische reacties – oxidatie
3.3. Redoxreacties met dijood
3.3.1.Klokreactie met dijood

- Info: Klokreactie met kaliumjodide, waterstofperoxide en thiosulfaatoplosossingen. Kleur wordt gevormd door ontstaan van dijood en reactie met zetmeel.
- Moeilijkheid:moeilijk
- Chemische stoffen:
- OplossingA: 2 ml 30% H2O2 + 93 ml gedestilleerd water
- Oplossing B: Breng 1 g zetmeel in 100ml water aan het koken. Kook eventjes door. Voeg nu 0,124 g Na2S2O3.5H2O aan de 100ml oplossing
- OplossingC: 1,74 g KI, 1,4 g CH3COONa en 3ml 6M azijnzuur in 200 ml oplossing
- Thema: enkelvoudige stoffen – reactiesnelheid – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – klokreactie
3.3.2. Zoek de samenstelling van chemisch bier

- Info: Hoe kunnen we bier (Duvel) op een chemische wijze nabootsen? Voer redoxreactie uit met vorming van djood
- Moeilijkheid:moeilijk
- Chemische stoffen: KIO3 (kaliumjodaat) – CH3CH2OH (ethanol) – H2SO4 (zwavelzuur) – Na2SO3 (dinatriumsulfiet) – kleurloos detergent
- Thema: enkelvoudige stoffen – reactiesnelheid – redoxreacties
- Tijd:30 min
- Begrippen: enkelvoudige stoffen – reactiesnelheid
3.3.3. Egyptische nacht

- Info: Hoe kunnen we geleidelijk aan een blauwe oplossing vormen? Door isobetadine toe te voegen voeg je dijood (indicator voor zetmeel) toe aan de maatbeker. De vitamine C oplossing reduceert dijood in jodide-ionen. Bij het toevoegen van de zetmeeloplossing zal de inhoud van de maatbeker dus niet meteen donkerblauw kleuren. Dat gebeurt pas wanneer waterstofperoxide reageert met de gereduceerde jodide-ionen ter vorming van water en dijood (trage reactie). Hierbij komt zuurstof (onder de vorm van water) vrij en zal stillaan stijgen naar het oppervlak.
- Moeilijkheid:moeilijk
- Chemische stoffen: Isobetadine – Huishoudazijn – Waterstofperoxide 30% – Zetmeeloplossing 1% – Vitamine C oplossing 5%
- Thema: enkelvoudige stoffen – reactiesnelheid – redoxreacties
- Tijd:30 min
- Begrippen: enkelvoudige stoffen – reactiesnelheid
3.4. Redoxreacties met kaliumchloraat
3.4.1. Bengaals vuur

- Info: Wat gebeurt er wanneer een mengsel van zinkpoeder, ammoniumnitraat en ammoniumchloride in contact komt met water? Een mengsel van zinkpoeder, ammoniumnitraat en ammoniumchloride wordt vaak “Negatief X” genoemd. Het toevoegen van slechts een kleine druppel water veroorzaakt een redoxreactie, die wordt versneld door de aanwezigheid van chloride-ionen. Als sterk reductiemiddel reageert zink explosief met nitraationen om zinkoxide, stikstofgas en water te produceren.
- Moeilijkheid:gemiddeld
- Chemische stoffen: KClO3 – Suiker – Ba(NO3)2 of Sr(NO3)2 of Cu(NO3)2 – H2SO4 gec
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
3.4.2. Brandende gummibeer

- Info: Wat gebeurt er als we een gummibeertje toevoegen bij het gesmolten kaliumchloraat? Gummiberen bestaan hoofdzakelijk uit suiker (meestal glucose) en gelatine (of andere verdikkingsmiddelen). Deze organische stoffen zijn ontvlambaar.Kaliumchloraat is een krachtige oxidator. Boven ongeveer 400 ° C ontleedt kaliumchloraat tot kaliumchloride en kaliumperchloraat, waarbij de laatste snel uiteenvalt in kaliumchloride en zuurstof.
- Moeilijkheid:gemiddeld
- Chemische stoffen: Gummibeertjes – Kaliumchloraat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
3.4.3. Gummy Bear vuurwerk

- Info: Wat gebeurt er als we een gummy-beertje mengen met kaliumchloraat?
- Moeilijkheid:gemiddeld
- Chemische stoffen: Gummibeertjes – Kaliumchloraat – CuSO4
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
3.4.4. Zelfbrandende kaars

- Info: Kunnen we een kaars aansteken zonder een aansteker of lucifers? Wanneer we het mengsel in de kaars gieten gebeurt er niets. Wanneer we een druppel zwavelzuur aan het mengsel kaliumchloraat en suiker toevoegen ontstaat er een hevige vlam. De kaars brandt.
- Moeilijkheid:gemiddeld
- Chemische stoffen: een kaars, – KClO3, – geconcentreerd H2SO4, – suiker
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
3.4.5. Bengaals vuur

- Info: Wat gebeurt er wanneer een mengsel van zinkpoeder, ammoniumnitraat en ammoniumchloride in contact komt met water? Een mengsel van zinkpoeder, ammoniumnitraat en ammoniumchloride wordt vaak “Negatief X” genoemd. Het toevoegen van slechts een kleine druppel water veroorzaakt een redoxreactie, die wordt versneld door de aanwezigheid van chloride-ionen. Als sterk reductiemiddel reageert zink explosief met nitraationen om zinkoxide, stikstofgas en water te produceren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 gram ammoniumnitraat – 2 gram zinkpoeder – 25 gram ammoniumchloride
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
3.4.6. Jood-Bloem

- Info: Wat gebeurt er als we lugol en zetmeel in dezelfde afgesloten ruimte brengen? In de afgesloten ruimte zal het voorwerp/de plaats waar zetmeel aanwezig is blauw worden. Doordat in lugol het dijood een goede vluchtigheid heeft stijgt deze. Deze komt dan geleidelijk in aanraking met het zetmeel dat op de tissue zit. Als deze 2 stoffen in aanraking komen met elkaar verkleurt het lugol blauw. Ze vormen een blauw zetmeel-jodiumcomplex.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zetmeel – Lugoloplossing
- Thema: chemische reacties – redoxreactie
- Tijd: 10 min
- Begrippen: oxidans
3.5. Redoxreacties met kaliumpermanganaat
3.5.1. Alcoholoxidatie

- Info: Wat gebeurt er met de paars gekleurde propan-1-ol, propan-2-ol en t-butanol bij de oxidatie? Propan-1-ol wordt geoxideerd door permanganaat tot propanal en tot propionzuur. Propan-2-ol oxideert tot aceton. Het permanganaat gaat naar het groene MnO42- en tot MnO2. Tertiair butanol ondergaat geen oxidatie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4 (0,006 mol/l) – NaOH (1mol/l) – Propan-1-ol & propan-2-ol & t-butanol
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: reacties met organische stoffen – oxidatie
3.5.2. Chemische kameleon
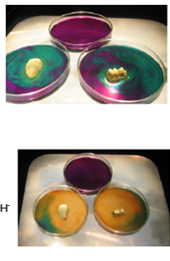
- Info: Onder invloed van NaOH zal het permanganaat met de suiker reageren. Wat overblijft is bruinsteen. Permanganaat is sterk paars en bruinsteen geel/bruin. Omdat de reactie afhankelijk is van temperatuur en concentraties, zal de reactie in deze verhoudingen vrij langzaam verlopen. De kleurveranderingen zijn dan ook mooi te zien. De laatste verandering, van groen naar geel en geel/bruin, duurt het langst. Die van paars naar donkerpaars gaat vrij snel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4 – saccharose – NaOH
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: reacties met organische stoffen – oxidatie
3.5.3. Een chemische vlag

- Info: Onder invloed van NaOH zal het permanganaat met de suiker reageren. Wat overblijft is bruinsteen. Permanganaat is sterk paars en bruinsteen geel/bruin. Omdat de reactie afhankelijk is van temperatuur en concentraties, zal de reactie in deze verhoudingen vrij langzaam verlopen. De kleurveranderingen zijn dan ook mooi te zien. De laatste verandering, van groen naar geel en geel/bruin, duurt het langst. Die van paars naar donkerpaars gaat vrij snel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: OplossingA: 500 ml NaOH 6M – OplossingB: 20 ml H2O2 0.1% – Azijnzuur – KMnO4
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: reacties met organische stoffen – oxidatie
3.5.4. Goethes kleurenleer

- Info: Wat zal er gebeuren als we in een beker met water volgende stoffen toevoegen: kaliumpermanganaat, kaliumhydroxide, mierenzuur, natriumwaterstofsulfaat en natriumsulfiet? Het paarse permanganaation (MnO4–) wordt stap voor stap gereduceerd. De eerste stap voert via het blauwe, onstabiele hypomanganaat (MnO43-) door oxidatie naar het groene manganaat (MnO42-).Door de aanwezigheid van OH–ionen wordt de rechtstreekse reductie naar Mn2+ vermeden.In het zure milieu ontstaat lichtbruin manganiet (MnO44-) dat, gemengd met permanganaat, een roodbruine kleur veroorzaakt. Dit gebeurt door de toevoeging van het zure natriumwaterstofsulfaat wat ertoe leidt dat de OH– worden geneutraliseerd. Het aanwezige formiaat wordt zuur waardoor Mn(+VI) oxideert tot Mn(+IV) met de bruine kleur. Tenslotte zorgt het sulfiet ervoor dat manganiet gereduceerd wordt tot het tweewaardige mangaan ( Mn2+). Dat is zeer licht zalmkleurig, nagenoeg kleurloos.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 400 ml gedestilleerd water (H2O); – 0,02 g kaliumpermanganaat (KMnO4); – 2,5 g kaliumhydroxide (KOH); – 0,04 g 85% mierenzuur (HCOOH) 0,04 g / 1 druppel; – 2,5 g natriumwaterstofsulfaat (NaHSO4); – 0,25 g natriumsulfiet (Na2SO3).
- Thema: anorganische stoffen – chemische reacties – redoxreacties
- Tijd: 30 min
- Begrippen: zouten – verschillende OG van mangaan
3.5.5. Kinetiekproef met onzichtbare inkt en oxaalzuur

- Info: Wat zou er met de paarse-blauwe inkt kunnen gebeuren als we hiermee op papier schrijven? De paars-blauwe kleur van de KMnO4-oplossing vervaagt en verkleurt naar bruin. Waarna het helemaal verdwijnt na een tijdje.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Verzadigde oxaalzuuroplossing 12g/l in ethanol en verdunningen – 0.090 mol/l KMnO4
- Thema: anorganische stoffen – chemische reacties – redoxreacties – reactiesnelheid
- Tijd: 30 min
- Begrippen: oxidatie – reductie
3.5.6. Kleurenspel

- Info:Reacties waarbij de kleuren van mangaanverbindingen ontstaan bij veranderen van oxidatiegetal
- Moeilijkheid: gemiddeld
- Chemische stoffen: Mangaan(II)sulfaat (verzadigde oplossing) – Kaliumpermanganaat: 0.1 g in 100ml water – Natriumsulfiet: 2 g in 100 ml water – Natriumhydroxide 6M – Zwavelzuur
- Thema: chemische reacties – complexreactie – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – kleurreacties – verschillende oxidatiegetallen
3.5.7. Licht onder water

- Info: Is bliksem onder water mogelijk? Na een korte tijd zie je steeds opstijgende bellen tot aan het raakvlak van het zuur met ethanol, waar dan ‘bliksem’ ontstaat, vergezeld van een kleine knal. Dit duurt een paar minuten. Er vormen zich ook groene, bruine en paarse slierten.
- Moeilijkheid: gemiddeld
- Chemische stoffen: geconcentreerd zwavelzuur – ethanol – kaliumpermanganaat
- Thema: chemische reacties – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – exo-energetische reactie – verschillende oxidatiegetallen
3.5.8. Maak de mooiste instant cappuccino

- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen? Exotherme reactie waarbij het detergent zorgt voor het schuim. De kaliumpermanganaat kristallen blijven op het schuim drijven en zorgen voor het bovenste laagje van de cappuccino.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KMnO4, H2O2 30 % (5 ml) , vloeibaar detergent
- Thema: anorganische stoffen – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
3.5.9. Maak de traagste chemiekameleon

- Info: Onder invloed van NaOH zal het permanganaat met de suiker reageren. Wat overblijft is bruinsteen. Permanganaat is sterk paars en bruinsteen geel/bruin. Omdat de reactie afhankelijk is van temperatuur en concentraties, zal de reactie in deze verhoudingen vrij langzaam verlopen. De kleurveranderingen zijn dan ook mooi te zien.
De laatste verandering, van groen naar geel en geel/bruin, duurt het langst. Die van paars naar donkerpaars gaat vrij snel. - Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4 – NaOH – suiker
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: reacties met organische stoffen – oxidatie
3.5.10. Ontkleuren van tomaten

- Info: Door reactie van HCl en KMnO4 vormt Cl2. In een waterige oplossing levert het Cl2 HOCl en HCl. Tijdens de ontkleuringsreactie ontbindt HClO in HCl en O2. Dit O2 ontkleurt de tomatensap.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4 – 6 mol/l HCl – tomatensap
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: reacties met organische stoffen – oxidatie
3.5.11. Onweer onder water

- Info: Zodra de Kaliumpermanganaat in aanraking komt met de onderste laag zwavelzuur wordt onder andere het groene Mangaanheptoxide gevormd.Dit Mangaanheptoxide gaat op het grensvlak tussen de Ethanol en het Zwavelzuur ook een reactie aan (redoxreactie).
- Moeilijkheid: gemiddeld
- Chemische stoffen:Geconcentreerd zwavelzuur – Ethanol 96% – Vast kaliumpermanganaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – verbrandingsreactie
3.5.12. Oxaalzuurgehalte in rabarber

- Info:In principe kan de hoeveeheid oxaalzuur in planten worden bepaald door titratie met kaliumpermanganaat. Planten bevatten naast oxaalzuur nog anderz zuren zoals appelzuur en melkzuur en reductoren zoals Fe(II)-ionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rabarber (80g per bepaling) – HCl 1M – ammoniak 25% – CaCl2 oplossing 15 massa% – zwavelzuur 20massa% -KMnO4 0.02M – Universeelindicatorpapier
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
3.5.13. Permanganaatfontein

- Info: Wat gebeurt er als we kaliumpermanganaat brengen in een mengsel van oxaalzuur en zwavelzuur. Het permanganaat ion haalt elektronen van de oxaalzuur moleculen en oxideert daardoor het oxaalzuur. Het MnO4– ion gedraagt zich als een oxidator in deze reactie terwijl oxaalzuur de reductor is in deze reactie. Door elektronen over te dragen reduceert het het MnO4– ion tot Mn2+. Mn2+ ionen zijn kleurloos. De bruine kleur die na verloop van tijd gevormd wordt duidt op de aanwezigheid van Mn4+ ionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumpermanganaat – Oxaalzuur 3% – Verdund zwavelzuur
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
3.5.14. Permanganaatfontein 2

- Info:Welke kleur ontstaat er bij het toevoegen van kaliumpermanganaat kristal bij zwavelzuur en oxaalzuur? Als kaliumpermanganaat wordt opgelost in water, splitst het in de ionen K+(aq) en MnO4–(aq). Het MnO4–(aq)-ion reageert met oxaalzuur, hierbij komt onder andere koolstofdioxide (CO2) vrij. Omdat CO2 slecht oplosbaar is en bovendien een veel kleinere dichtheid heeft dan water, stijgt het naar de oppervlakte. In zijn kielzog neemt het daarbij ook wat opgelost MnO4–(aq) mee. Die MnO4–(aq)-ionen veroorzaken de paarse kleur. Deze proef lukt het best in een zuur milieu, vandaar de toevoeging van het zwavelzuur aan het begin van de proef. Na verloop van tijd verkleurt het mengsel van paars naar bruinachtig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumpermanganaat – Verdund zwavelzuur 0,5 mol/l – Oxaalzuur
- Thema: organische stoffen – redoxreactie
- Tijd: 10 min
- Begrippen: carbonzuren – oxidatie
3.5.15. Reacties met kaliumpermanganaat in verschillende milieus

- Info: Welke reactie zal kaliumpermanganaat geven in een zuur, neutraal en basisch milieu? Afhankelijk van het milieu verandert het oxidadatiegetal van mangaan verschillend
- Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4 opl 0.02 mol/l – H2SO4 opl 3 mol/l – FeSO4.7H2O – KI oplossing 5 % – zetmeeloplossing – fft – NaOH oplossing 2 mol/l – Cu-poeder
- Thema: redoxreactie
- Tijd: 10 min
- Begrippen: reductie – oxidatie – invloed milieu
3.5.16. Reductie van kaliumpermanganaat door gummibeertjes

- Info: Onder invloed van NaOH zal het permanganaat met de suiker reageren. Wat overblijft is bruinsteen. Permanganaat is sterk paars en bruinsteen geel/bruin. Omdat de reactie afhankelijk is van temperatuur en concentraties, zal de reactie in deze verhoudingen vrij langzaam verlopen. De kleurveranderingen zijn dan ook mooi te zien. De laatste verandering, van groen naar geel en geel/bruin, duurt het langst. Die van paars naar donkerpaars gaat vrij snel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4-oplossing (0,01 mol/l) – NaOH-oplossing (3 mol/l) – een gummibeer of glucosetabletje
- Thema: redoxreactie – organische chemie – biochemie
- Tijd: 10 min
- Begrippen: reductie – oxidatie – invloed milieu
3.5.17. Reductie van kaliumpermanganaat met ethanol

- Info: In een zure oplossing wordt permanganaat gereduceerd tot Mn(II) met ethanol. Tijdens de reductie verandert de paarse kleur in een bijna kleurloze oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1 mol/l KMnO4, – gec H2SO4, – ethanol
- Thema: redoxreactie – organische stoffen
- Tijd: 15 min
- Begrippen: reductie – oxidatie – invloed milieu
3.5.18. Vuurspuwende vulkaan

- Info:Kaliumpermanganaat is een sterke oxidator die in staat is om glycerine in een sterk exotherme reactie onder vuurverschijnselen te oxideren tot CO2 en water. Kaliumpermanganaat wordt hierbij zelf gereduceerd, het betreft hier dus een redoxreactie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumpermanganaat – Glycerol
- Thema: redoxreactie – organische stoffen
- Tijd: 15 min
- Begrippen: reductie – oxidatie – invloed milieu
3.5.19. Chemische vulkaan

- Info: Hoe illustreer ik wat er gebeurt in een vulkaanuitbarsting? De zuurstof die gevormd wordt, zien we duidelijk ontsnappen, dit illustreert de rook. De reactie is ook duidelijk exotherm.
- Moeilijkheid: eenvoudig
- Chemische stoffen: H2O2(geconcentreerd) – KMnO4
- Thema: redoxreactie – organische stoffen
- Tijd: 15 min
- Begrippen: reductie – oxidatie – invloed milieu
3.5.20. Oxidatietoestanden van mangaan in een alginaatkorrel
- Info: Hoe kunnen we de oxidatietoestanden van mangaan en in een alginaatkorrel weergeven? Na enkele seconden zien we dat de violet kleur van de bolletjes kleurloos worden. Dit komt wanneer zwaveldioxide de alignaatbolletje bereikt. Hierdoor zal de permanganaationen in de reactie met de waterstofsulfiet- of sulfietionen worden gereduceerd tot mangaan(II)-ionen.Ammoniak diffundeert in de alginaatbolletjes en zorgt voor een relatief hoge pH in de bolletjes. Onder deze omstandigheden worden de permanganaat-ionen alleen gereduceerd tot mangaan (IV) -ionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gelballetjes – Kaliumpermanganaat – Zwavelzuuroplossing 2 mol/L – Calciumchloride – Ammoniakoplossing 25%
- Thema: redoxreactie – organische stoffen – biochemie
- Tijd: 15 min
- Begrippen: reductie – oxidatie – diffusie
3.5.21. Reductie van kaliumpermanganaat met suiker
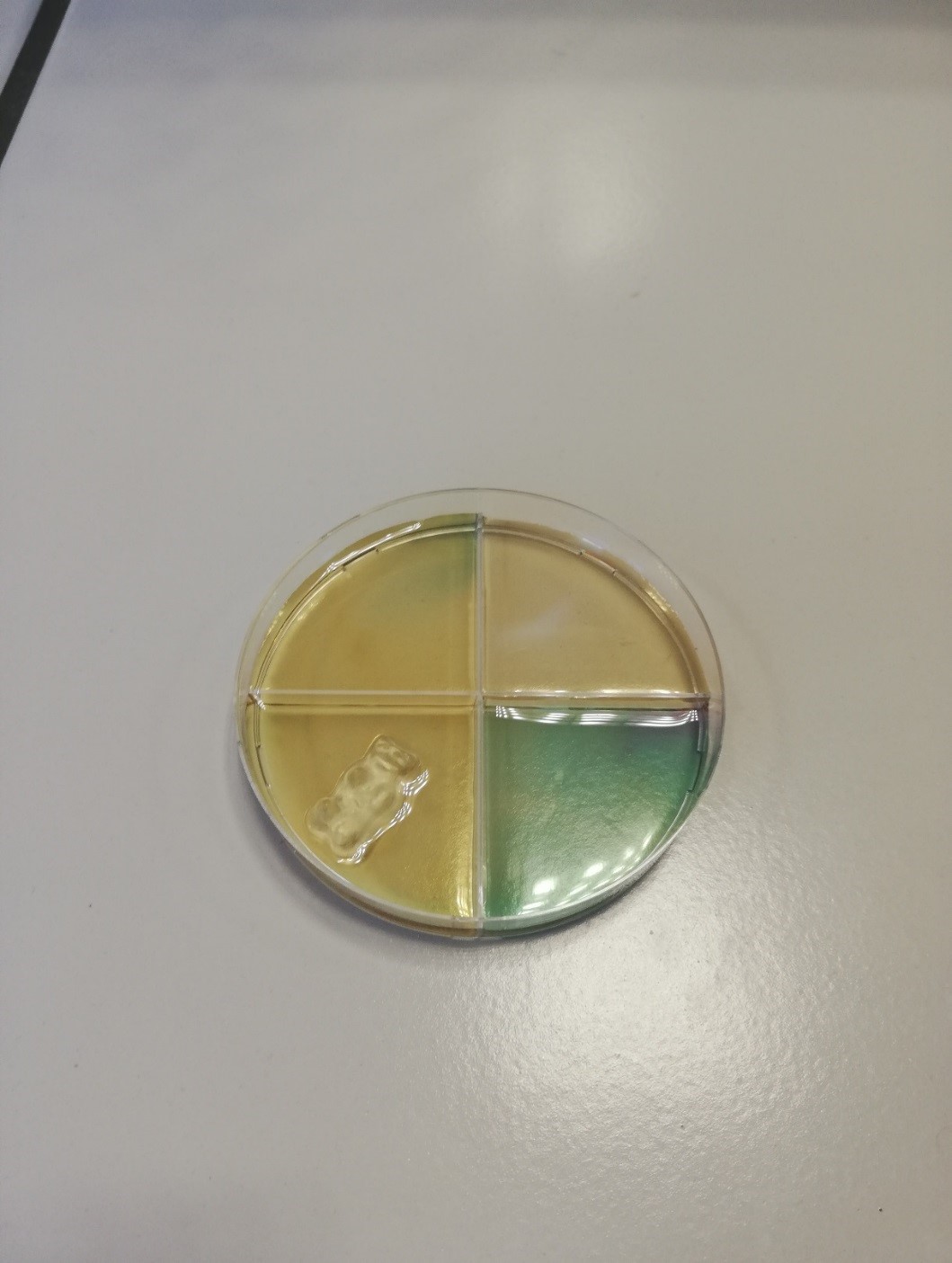
- Info: Welke kleurveranderingen kan suiker veroorzaken bij de toevoeging aan kaliumpermanganaat? Onder invloed van NaOH zal het permanganaat met de suiker reageren. Wat overblijft is bruinsteen. Permanganaat is sterk paars en bruinsteen geel/bruin.
Omdat de reactie afhankelijk is van temperatuur en concentraties, zal de reactie in deze verhoudingen vrij langzaam verlopen. De kleurveranderingen zijn dan ook mooi te zien. - Moeilijkheid: eenvoudig
- Chemische stoffen: 50 ml natriumhydroxide 1 mol/l (NaOH) – 0,02 g kaliumpermanganaat (KMnO4) – Glucose – Maltose – Zetmeel – Gummibeertjes
- Thema: redoxreactie – organische stoffen – biochemie
- Tijd: 15 min
- Begrippen: reductie – oxidatie – diffusie – meerdere oxidatiegetallen van mangaan
3.5.22. Vuur maken met kaliumpermanganaat en suiker

- Info: Wat moet u doen om brand aanzienlijk te versnellen? De wrijving mengt suiker en kaliumpermanganaat . Tegelijkertijd wordt er warmte gegenereerd. Deze warmte is voldoende om de reactie tussen de twee stoffen op gang te brengen (activeringsenergie). De suiker brandt. Het kaliumpermanganaat zorgt voor de benodigde zuurstof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2,5 g suiker – 2,5 g kaliumpermanganaat
- Thema: redoxreactie – organische stoffen – biochemie
- Tijd: 15 min
- Begrippen: reductie – oxidatie – diffusie – meerdere oxidatiegetallen van mangaan
3.6. Redoxreacties met thiosulfaat
3.6.1. Zonsondergang
- Info:We zien dat er duidelijk vertroebeling optreedt. Dit is zo omdat er uiteindelijk zwavel wordt gevormd dat een neerslag is door reactie tusse zoutzuur en hetthiosulfaat. Hierdoor wordt onze heldere oplossing troebel. Des te hoger de concentratie zoutzuur, des te sneller de neerslagvorming zichtbaar wordt.We verkrijgen een colloïdale oplossing: de kleine zwaveldeeltjes blijven dus fijn verdeeld in de vloeistof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 g Na2S2O3 – 1 l water – HCl 2 mol/l 20 ml
- Thema: redoxreactie – reactiesnelheid
- Tijd: 15 min
- Begrippen: reductie – oxidatie
3.7. Redoxreacties met waterstofperoxide
3.7.1. Exotherme reactie met gedroogde gist

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van gist.Het gist bevat namelijk het catalase enzyme. Deze ontbinding is exotherm
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 pakketje of koffielepel gedroogde gist – 5% H202
- Thema: anorganische stoffen – energetische aspecten
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties – mechanische energie – katalysator
3.7.2. Maak de mooiste instant cappuccino

- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen? Exotherme reactie waarbij het detergent zorgt voor het schuim. De kaliumpermanganaat kristallen blijven op het schuim drijven en zorgen voor het bovenste laagje van de cappuccino.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KMnO4, H2O2 30 % (5 ml) , vloeibaar detergent
- Thema: anorganische stoffen – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
3.7.3. Reactie tussen KI en waterstofperoxide
- Info: Hoe kunnen we een klokreactie opbouwen met KI en waterstofperoxide? Bij het toevoegen van de waterstofperoxide-oplossing wordt het kleurloze mengsel blauw. Met voldoende thio-oplossing wordt het mengsel kleurloos. Binnen een minuut treedt weer blauwkleurig op.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 0,1 mol/l kaliumjodide-oplossing – 0,1 mol/l zwavelzuur-oplossing – Zetmeeloplossing – Waterstofperoxide 2m% – 0,1 mol/l Natriumthiosulfaatoplossing
- Thema: reactiesnelheid – redoxreactie
- Tijd: 20 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
3.8. Redoxreacties met zink
3.8.1. Brons, zilver, goud met zink

- Info:Maak zelf gouden en zilveren muntstukken. Als we de muntjes in de NaOH-oplossing met zinkkorrels leggen, zien we ze na een tijdje verkleuren. Ze krijgen een zilveren kleur.
Als we de muntjes in de vlam houden, krijgen ze een gouden kleur.
Als je de muntjes te lang in de vlam houdt, krijgen ze een rode kleur. - Moeilijkheid:gemiddeld
- Chemische stoffen: zinkkorrels (Zn) – NaOH – azijnzuur (huishoudazijn) – koperen muntstukjes
- Thema: enkelvoudige stoffen – mengsel – chemische reactie – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – messing
4. Redoxtitraties
4.1. Dosering van vitamine C door redoxtitraties

- Info: Hoe kunnen we gehalte vitamine C bepalen? Jodaat vormt met jodide in een zure oplossing jood.Ascorbinezuur is in oplossing makkelijk te oxideren tot dehydro-ascorbinezuur. Als oxidator kan een joodoplossing gebruikt worden:
- Moeilijkheid: gemiddeld
- Chemische stoffen: vitamine C tabletten – zwavelzuur 2 mol/l – KI oplossing 2 mol/l – KIO3 oplossing 0.03 mol/l – zetmeeloplossing
- Thema: rredoxreactie
- Tijd: 40 min
- Begrippen: titratie
4.2. Oxaalzuurgehalte in rabarber

- Info:In principe kan de hoeveeheid oxaalzuur in planten worden bepaald door titratie met kaliumpermanganaat. Planten bevatten naast oxaalzuur nog anderz zuren zoals appelzuur en melkzuur en reductoren zoals Fe(II)-ionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rabarber (80g per bepaling) – HCl 1M – ammoniak 25% – CaCl2 oplossing 15 massa% – zwavelzuur 20massa% -KMnO4 0.02M – Universeelindicatorpapier
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie – titratie
4.3. Titratie met ascorbinezuur

- Info: Hoe kan je ascorbinezuur in een citroen doseren met een titratie? Dijood is een indicator voor zetmeel. Bij aanwezigheid kleurt deze zwart. Ascorbinezuur is een zwak zuur maar toch een zuur. Deze geeft dus zijn H-atomen van zijn hydroxylgroepen af (aan de cyclische binding door negatief mesomeer effect) zodat de di-jood naar iodide-ionen kunnen vormen. Wanneer er een overmaat aan kaliumjodaat wordt toegevoegd, is al het ascorbinezuur weg gereageerd en kan er geen di-jood meer omgevormd worden. De oplossing krijgt dan een zwarte kleur door het aanwezige zetmeel.
- Moeilijkheid: gemiddeld
- Chemische stoffen: zetmeeloplossing 1%, ascorbinezuur, zwavelzuur 2mol/l, kaliumjodaat 0,03 mol/l, kaliumjodide 2 mol/l en gedestilleerd water.
- Thema: redoxreactie
- Tijd: 40 min
- Begrippen: titratie
5. Roest en corrosie

- Info: Hoe kunnen we corrosie zichtbaar maken? Als metalen op de een of andere manier met water in aanraking komen zal dus corrosie plaatsvinden. Op de manier waarop we dit experiment uitgevoerd hebben kunnen we corrosieprocessen zichtbaar maken.Als corrosie plaatsvindt verschijnt er een blauwe kleur bij de anodische gebieden door de reactie van de ferro-ionen met het kaliumferricyanide waarbij een diepblauw geleurde verbinding gevormd.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine – Nagel – Fenolftaleine – Kaliumferricyanide (K3Fe(CN)6)
- Thema: redoxreactie
- Tijd: 40 min
- Begrippen: corrosie
5.2. Elektrochemische corrosie

- Info: Hoe een gat maken met een potlood in een scheermesje? IJzer gaat in oplossing als Fe2+, het gevolg daarvan is dat het metaal negatief geladen wordt (de elektronen blijven achter) t.o.v. het elektrolyt. Het gevolg is dat er een potentiaalverschil gecreëerd wordt tussen het elektrolyt en het metaal.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ijzer – Zoutzuur
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – elektrochemie
5.3. Oxidatie van ijzeren nagels

- Info: Wat zal er gebeuren met de nagel als men er koperdraad of aluminiumfolie rond wikkelt?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 ijzeren nagels; – aluminiumfolie; – koperdraad van 0,5 mm; – gelatine; – keukenzout; – 1 tablet aspirine; – aceton
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.4. Roest of geen roest

- Info: Welke factoren beïnvloeden roestvorming? In leidingwater zit bij kamertemperatuur ongeveer 10 mg/l zuurstofgas opgelost. De oplosbaarheid neemt ad bij verhoging van temperatuur tot minder dan 1 mg/l bij 100°C. Door het koken is het grootste deel van het zuurstofgas verdreven.
- Moeilijkheid: eenvoudig
- Chemische stoffen: staalwol – plantenolie
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.5. Roest

- Info: Welke factoren beïnvloeden roestvorming? Vocht dat zich in de lucht bevindt of in het gekookte water, tast het ijzer aan. Bij ijzer is dit waar te nemen door het ontstaan van roest. Enkel wanneer de spijker niet in contact kwam met water of lucht vertoonde hij geen roest.Vocht is een oxiderend agens dat ervoor zorgt dat zuurstof uit de lucht, of de lucht die in het water is opgelost, ijzer aantast. Deze oxidatie heet corrosie en bij ijzer spreken we van roestvorming.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 nagels
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.6. Roestpreventie

- Info: Welke factoren beïnvloeden roestvorming? Vocht dat zich in de lucht bevindt of in het gekookte water, tast het ijzer aan. Bij ijzer is dit waar te nemen door het ontstaan van roest. Enkel wanneer de spijker niet in contact kwam met water of lucht vertoonde hij geen roest.Vocht is een oxiderend agens dat ervoor zorgt dat zuurstof uit de lucht, of de lucht die in het water is opgelost, ijzer aantast. Deze oxidatie heet corrosie en bij ijzer spreken we van roestvorming. De roestvorming van de andere spijkers hangt af van de effectiviteit van de bescherming.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 g gelatine in 100ml water en los daarin 0,2 g – kaliumhexacyanoferraat(III) op. Houd de oplossing warm, maar niet heet, omdat dan giftige stoffen kunnen vrijkomen. – 10ml 1mol/l zoutzuur – Ca 2 cm magnesiumlint -Klein stukje zinkfolie – Klein stukje koperfolie – Vaseline
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.7. Verwijderen van roest met oxaalzuur

- Info: Hoe kun je roest verwijderen uit kledij? Om de nagels te verroesten neem je een petrischaaltje. Je legt in het petrischaaltje natte watten. Op deze natte watten leg je de nagels. Daarna leg je weer één laag natte watten. Dit laat je een tijdje staan. Zo verkrijg je verroeste nagels.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Verroeste nagels – Oxaalzuur – Papieren doek
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.8. Versneld roesten

- Info:Hoe kunnen we het roesten van staal/ijzer versnellen? Hoe fijner het ijzer, hoe rapper je resultaat ziet, ijzervijlsel werkt het best. De metalen kunnen ook in de javel en het azijn afzonderlijk gedaan, worden. Dan wordt het ook duidelijk dat het de javel is die voor het sterk roestend effect zorgt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: azijn – bleekmiddel – staalwol
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.9. Roestvorming in een spuit
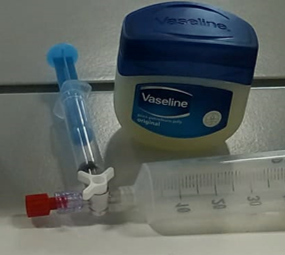
- Info:Hoe kunnen we snel roest vormen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzerwol – Water
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie
5.10. Roesten in een proefbuis

- Info: Hoe ontstaat roest? Alleen water of alleen lucht is niet genoeg om het proces (snel) te laten verlopen, de combinatie echter wel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 ijzeren nagels – Schuurpapier
- Thema: redoxreactie
- Tijd: 15 min
- Begrippen: corrosie – oxidatie
5.11. Corrosiebescherming

- Info: Hoe bescherm je (onedele) metalen tegen roest? Na een tijdje , de oplossing wordt blauw op ijzer draad die wordt gewikkeld rond de koperen plaat.
Een soortgelijke waarneming kan worden gedaan op de ijzeren ring, die in de oplossing ligt zonder contact met een ander metaal. Alleen hier is de blauwe verkleuring minder intens.
Er is geen kleurverandering op de ijzeren draad is aangesloten op het zink plaat. - Moeilijkheid: eenvoudig
- Chemische stoffen: stuk koperdraad, ijzeren draad, zink – spatelpunt kaliumhexacyanoferraat(II) – spatelpunt keukenzout
- Thema: redoxreactie
- Tijd: 25 min
- Begrippen: corrosie – oxidatie
6. Verbrandingsreacties
6.1. Brandbaarheid
6.1.1. Brandbaarheid van ether

- Info: Hoe kun je de brandbaarheid van diethylether testen? We zien dat het uiteinde aan de zijkant van de buis gaat branden. De etherdampen zijn zwaarder dan de lucht en brandbaar. Hierdoor zakt de ether dus naar onder in het buisje en komen de dampen daar ook vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: diethylether – watten
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen:ethers – brandbaarheid
6.1.2. Brandbare citrusvruchten

- Info: In welke citrusvruchten is de schil brandbaar? De schil bevatten terpenen ( limoneen), dit zijn vluchtige verbindingen. Terpenen bestaan vooral uit koolstof en waterstof. Terpenoïden, ook geurstoffen, bevatten ook zuurstof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: diverse verse citrusvruchten – brander
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid
6.1.3. De verbranding van een kaars in lucht en in uitgeademde lucht

- Info: Brandt een kaars anders in uitgeademde lucht dan in gewone lucht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 Theelichtjes
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen:brandbaarheid
6.1.4. De verbranding van een kaars in lucht en in zuivere zuurstof

- Info: Heeft de hoeveelheid zuurstof in de lucht een invloed op de verbranding? Een verbrandingsreactie heeft zuurstof nodig om op te kunnen gaan. Hoe meer zuurstof, hoe heviger de reactie dus hoe helderder de vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumjodide poeder – Waterstofperoxide 10%
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid
6.1.5. Geflambeerd geld

- Info: Wat gebeurt er wanneer we een briefje geld (of stukje papier) dat ondergedompeld is geweest in wodka, whisky of een oplossing bestaande uit 50% water/50% ethanol in brand steken? De alcohol in de oplossing zorgt voor het branden en het water in de oplossing beschermt het papier.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Alcoholrijke drank/oplossing 50% water/50% ethanol – keukenzout
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen:brandbaarheid
6.1.6. Het verbrandingsproduct koolstof

- Info: Welk verbrandingsproduct produceert een verbranding, naast waterdamp en koolstofdioxide? Koolstof of roet is een verbrandingsproduct dat gevormd wordt bij een verbrandingsreactie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid
6.1.7. Het verbrandingsproduct waterdamp aantonen

- Info: Welk verbrandingsproduct wordt er gevormd? Waterdamp is een verbrandingsproduct dat gevormd wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid
6.1.8. Het verbrandingsproduct koolstofdioxide aantonen

- Info: Welk verbrandingsproduct produceert een verbranding, naast waterdamp? Helder kalkwater dat troebel wordt is een indicator voor koolstofdioxide. Het klakwater wordt troebel dus koolstofdioxide is een verbrandingsproduct dat gevormd wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Helder kalkwater – Theelichtje
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid
6.1.9. Hoe kunnen we de kaarsvlam doven? Methode1

- Info: Kunnen we de kaarsvlam doven met een koper draadnet? Koper is een goede warmtegeleider. Hierdoor wordt de warmte van de vlam afgeleid alsook de ontstekingstemperatuur van de paraffine. De vlam wordt dus gedoofd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: een kaars, – een aansteker – een draadnet
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid
6.1.10. Hoe kunnen we de kaarsvlam doven? Methode2

- Info: Kunnen we de kaarsvlam doven met een spiraalvormige koperdraad?
- Moeilijkheid: eenvoudig
- Chemische stoffen: een kaars, – een aansteker – een spiraalvormig stukje koperdraad
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid
6.1.11. Invloed van een katalysator op ontbranding

- Info: Welke invloed heeft een katalysator op ontbranding? De suiker zonder assen smelt gewoon tot karamel, maar ontbrandt niet. De suiker met de assen ontbrandt wel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suikerklontjes – Assen
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.12. Invloed van temperatuur op brandbare stoffen

- Info: Welke invloed heeft temperatuur op brandbare stoffen en waar ontbranden ze? Bij de alcoholoplossing en bunsenbrander begint de vlam direct aan het oppervlak. Bij het theelichtje begint de vlam hoger dan het oppervlak.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje – 98% alcoholoplossing
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.13. Invloed van oppervlaktevergroting op brand

- Info: Welke invloed heeft oppervlaktevergroting op brand? In het horlogeglas kan de alcohol enkel ontbranden aan het bovenste oppervlak. Enkel daar komt zuurstof en is er dus een kleine vlam. Bij de verstuiver kan er langs alle zijden zuurstof bij de alcohol en is het contactoppervlak enorm vergroot. Dus krijgen we een grote vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje – 98% alcoholoplossing
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.14. Invloed van vocht op brandbare stoffen

- Info: Welke invloed heeft vocht op brandbare stoffen? Het stukje papier ontbrandt spontaan. Het bakje ontbrandt niet en het water wordt zeer warm.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Water
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.15. Invloed van zuurstof op brandbaarheid

- Info: Welke invloed heeft zuurstofgas op brand? Vuur heeft zuurstof nodig om te blijven branden. Als de zuurstof op is, dooft de vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kaars
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.16. Krijt als wiek

- Info: Kunnen we krijt ook als wiek gebruiken? Het krijt verbrandt de vrijgekomen gassen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Krijt – Lampolie
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.17. Regen van vuur

- Info: Kunnen we met houtskoolsnipper regen van vuur maken? We kunnen regen van vuur maken door houtskoolsnippers te verbranden in een vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Houtskoolsnippers
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid
6.1.18. Springende vlam

- Info: Hoe kunnen we een vlam laten springen? We kunnen een vlam laten springen van een brandende lucifer naar een net uitgeblazen kaars doordat de gassen die nog ontsnappen brandbaar zijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid – exo-energetische reactie
6.1.19. Verbranding van kaarsenvetdampen

- Info: Kunnen de dampen van kaarsenvet branden? Kaarsvet is de brandstof voor de verbranding. Deze dampen mengen zich met de zuurstof die vrijkomt uit de oxi-reiniger die dient als een zuurstofbron. Voor een verbranding is zuurstof nodig en een brandstof, in dit geval de kaarsenvet dampen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – Lucifers – Koperdraadnet
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid – exo-energetische reactie
6.1.20. Wasdampen zichtbaar maken met een koperdraadnet

- Info: Hoe moeten we het koperdraad houden om deze wasdampen te zien? We kunnen de wasdampen van de roetdampen onderscheiden door een koperdraadnet net boven de wiek in de vlam te houden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – Lucifers – Koperdraadnet
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid – exo-energetische reactie
6.1.21. Roet

- Info: Hoe maak je roet? De onverlichte vlam van de brander wordt geelachtig op de punten waar roet de vlam binnenkomt, waar het een gloeiende vlam wordt. Hoe meer roet er in de brandervlam komt, hoe intenser het effect kan worden waargenomen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid
6.1.22. Een dochtervlam maken

- Info: Hoe kun je meerdere vlammen maken vanuit één vlam? Het gas (wasdamp) dat uit de glazen buis of uit de gewalste aluminiumfolie ontsnapt, kan worden ontstoken en brandt met een kleine “dochtervlam” aan het einde van de afvoerbuis. Het uiteinde van de buis, die in de vlam zit, wordt zwart.
- Moeilijkheid: eenvoudig
- Chemische stoffen: gewalste aluminiumfolie (lengte: tot 8 cm, ca. 4 mm) – kaars
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: brandbaarheid
6.1.23. Ontbranden van was

- Info: Wat gebeurt er als je was ontsteekt? Eerst smelt de was. Na lange tijd verwarmen worden uiteindelijk wasdampen gevormd. De vloeibare was ontbrandt niet, alleen wanneer wasdampen optreden treedt ontbranding op.
- Moeilijkheid: eenvoudig
- Chemische stoffen: houtsnippers – Kaarsvet
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.24. Ontbranden van wasdampen

- Info: Hoe brandt een kaars? De was wordt eerst gesmolten door de vlam. Bij de lont, die als capillair fungeert, verdampt de vloeibare was en branden de resulterende wasdampen in de vlam. De vloeibare was stijgt over de lont , aan het einde van de lont verdampt het en vervolgens verbrandt het. Als de vlam is gedoofd, kunnen eventuele dampen die nog worden geproduceerd opnieuw worden ontstoken met de brandende spaan zonder de lont aan te raken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: houtsnippers, – metalen koffielepel – Kaars
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.25. Drie methoden van brandbestrijding

- Info: Hoe blus je brand? In de eerste stap wordt de brandstof uit het vuur gehaald. In de tweede stap wordt de zuurstof uit het vuur gehaald omdat de luchttoevoer onder het bekerglas wordt onderbroken. In de derde stap wordt de benodigde warmte door het metalen gaas aan het vuur onttrokken, terwijl het gas ongehinderd kan passeren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: metalen zeef, – grote beker
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.26. Blus brandende benzine met water

- Info: Hoe blus je brandende benzine niet? Het brandende papier kan worden geblust met water omdat het water het vuur afkoelt en de lucht uit de brandstof haalt wanneer deze nat wordt. Brandende benzine kan niet met water worden geblust omdat benzine op water drijft. Hierdoor kan het water niet afkoelen en kan het ook de brandstof niet van de lucht scheiden
- Moeilijkheid: eenvoudig
- Chemische stoffen: vel papier, – vochtige katoenen doek – benzine, – leidingwater
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.27. Waarom brandt het papier in het theezakje niet?

- Info: Waarom brandt het papier in het theezeefje niet? Naast zuurstof en brandbaar materiaal is er een bepaalde minimale energie nodig voor de ontsteking van het papier. Omdat het theezeefje de energie echter in de vorm van warmte afvoert, kan de wasstoom van het waxlichtje boven het theezeefje niet meer branden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje, – theezeefje – papier
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.28. Blussen met bakpoeder

- Info: Hoe kun je brand bestrijden met bakpoeder? Natriumbicarbonaat ontleedt in kooldioxide en water wanneer het wordt verwarmd met een bunsenbrander.
- Moeilijkheid: eenvoudig
- Chemische stoffen: theelichtje – natriumbicarbonaat
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.29. Brand bestrijden met keukenzout en ijs

- Info: Hoe kun je brand bestrijden met keukenzout en ijs? Het mengsel van ijs en zout haalt de minimale energie uit de benzine die nodig is om het vuur in stand te houden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: benzine – natriumchloride, – ijs.
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.30. Kan een vetbrand geblust worden met water?

- Info: Kan een vetbrand geblust worden met water? Water drijft bovenop het vet. Hierdoor kan de vetbrand niet met water worden geblust.
- Moeilijkheid: eenvoudig
- Chemische stoffen: vuurvaste basis, – waxinelichtje,
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.31. Kan een aluminiumbrand geblust worden met water?

- Info: Kan een aluminiumbrand worden geblust met water? Aluminium heeft een zeer hoge oxidatieneiging. Door de hete vlam verdampt het bluswater onmiddellijk.
- Moeilijkheid: eenvoudig
- Chemische stoffen: vuurvaste voet – aluminium puntenslijper,
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.32. Brand blussen met zoutzuur en natriumbicarbonaat

- Info: Hoe kan je met soda en zoutzuur vuur doven? De toevoeging van zoutzuur aan natriumcarbonaat Kooldioxide. De CO2 is zwaarder dan de andere gassen in de lucht en verplaatst ze uit de beker. Als de zuurstoftoevoer wordt onderbroken, gaat de vlam van het waxinelichtje uit.
- Moeilijkheid: eenvoudig
- Chemische stoffen: waxinelichtje. – zoutzuur (w = 25%), – natriumcarbonaat (watervrij).
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.33. Zelfbrandende kaars

- Info: Hoe kun je een kaars zonder vuur aansteken? Binnen een paar seconden wordt de vlam geproduceerd met kaliumchloraat en zwavelzuur en lijkt de kaars aan te gaan.
- Moeilijkheid: eenvoudig
- Chemische stoffen:zeer klein flesje geconcentreerd zwavelzuur – Meng voorzichtig een hoeveelheid kaliumchloraat ter grootte van een erwt met een gelijke hoeveelheid suiker.
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.34. De springend vlam

- Info: Hoe kun je een vlam laten “springen”? De vlam dooft in de kooldioxide en de gloeiende spalk barst in brand in de zuurstof, zodat de vlam van de ene spalk naar de andere lijkt te “springen“
- Moeilijkheid: eenvoudig
- Chemische stoffen: een schep natriumwaterstofcarbonaat, NaHCO3 – 250 ml azijn of 5% azijnzuur – 1/2 schep mangaandioxide, MnO2 – 250 ml 3% waterstofperoxide
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.35. Niet-brandend biljet

- Info: Hoe kun je een biljet laten branden zonder dat het biljet verbrandt? Aceton is (net als alcoholen) zeer brandbaar en brandt zeer koel. De aceton verbrandt, maar het biljet is doordrenkt met water zodat deze niet verbrandt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Aceton
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.1.36. Ontbranding van was

- Info: Wat gebeurt er als je was ontsteekt? Kaarsvet brandt niet in zowel vaste als vloeibare aggregatietoestanden. Pas dan, als de was verdampt, kan deze worden ontstoken. De wasdampen branden. De was brandt noch in de vaste noch in de vloeibare toestand. Alleen de wasdampen zijn brandbaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaarsvet
- Thema: redoxreacties
- Tijd: 15 min
- Begrippen: brandbaarheid
6.2. Verbrandingsreacties
6.2.1. Aardappelkanon

- Info: Hoever kun je een aardappel schieten met een zelfgemaakt aardappelkanon? In de meeste spuitbussen is butaan het drijfgas. De reactie die optreedt is dus de verbranding van butaan.De afstand die we kunnen bereiken met het aardappelkanon is voornamelijk afhankelijk van de hoeveelheid gas dat we gebruiken, ook spelen de hoek waaronder we schieten en in mindere mate de aard van het gas een rol.
- Moeilijkheid: gemiddeld
- Chemische stoffen: koperdraad – (laad)stok – aardappels – alkaan
- Thema: organische stoffen – organische reacties – redoxreactie
- Tijd: 30 min
- Begrippen:alkanen – verbrandingsreactie
6.2.2. Brandende suiker

- Info: Hoe kun je met modellen chemische stoffen ruimtelijk voorstellen? Het verbranden van een suikerklontje is een chemische reactie. Wanneer je het suikerklontje met as inwrijft, brandt het wel. Dit komt doordat de as meehelpt bij het verbranden van de suiker.
- Moeilijkheid: eenvoudig
- Chemische stoffen: paar suikerklontjes – beetje sigaretteas
- Thema: chemische reacties – energetische aspecten – redoxreacties
- Tijd: 10 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
6.2.3. Brandende zakdoek

- Info: Het water dat in de zakdoek zit, zorgt ervoor dat als het alcohol verbrand is, de doek niet verbrandt. Door de warme alcohol vlam zal er weliswaar iets verdampen maar daardoor behoudt de doek juist een lage temperatuur (tijdens een faseverandering van vloeistof naar gas blijft de temperatuur constant) en kan het niet ontbranden.De doek kan pas ontbranden als alle water verdampt is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: isopropanol-water of ethanol-water (50-50)
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: concentratie – verbranding
6.2.4. De faraoslang

- Info: Hoe word je slangenbezweerder? Tijdens het verhitten treedt er een analyse van suiker op. Er ontstaat koolstof. We voegen hier bakpoeder aan toe zodat de slang zal groeien. Tot slot voegen we ethanol toe zodat de temperatuur zal stijgen en de analyse van suiker optreedt. Er zijn verschillende factoren die de grootte van de slang beïnvloeden, bijvoorbeeld de verdelingsgraad van het bakpoeder
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Bakpoeder – Ethanol
- Thema: chemische reacties – energetische aspecten – redoxreacties
- Tijd: 25 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie – verbranding
6.2.5. Geflambeerd geld

- Info: Wat gebeurt er wanneer we een briefje geld (of stukje papier) dat ondergedompeld is geweest in wodka, whisky of een oplossing bestaande uit 50% water/50% ethanol in brand steken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Briefje geld of een stukje papier – Alcoholrijke drank/oplossing 50% water/50% ethanol – keukenzout
- Thema: organische stoffen – alcoholen – redoxreacties
- Tijd: 25 min
- Begrippen: ethanol – verbrandingsreactie
6.2.6. Het koperexperiment

- Info: Welk verschil nemen we waar tussen koper dat bij verhitting wordt blootgesteld aan zuurstof en koper die niet wordt blootgesteld aan zuurstof? Binnen ontstaat een kleurenspel vooral als de plaat niet volledig is gedicht. Dit komt door de verschillende koperoxiden (CuO zwart, Cu2O rood) in verschillende verhoudingen. Afhankelijk van de hoeveelheid kan Cu2O gaan van geel via oranje naar rood, CuO van bruin tot zwart.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koperplaatje
- Thema: Redoxreacties
- Tijd: 15 min
- Begrippen: meerdere OG – verbrandingsreactie
6.2.6.Het regent vuur

- Info: Oxalaten zijn soms thermisch instabiel: de zouten kunnen onder verhitting ontleden in het metaal horende bij het kation onder afgifte van 2 moleculen kooldioxide. Het op deze wijze ontleden van fijn verdeeld ijzeroxalaat is een manier om zogenaamd pyrofoor ijzer te maken. Het ijzer onder poedervorm brandt spontaan door de wrijvingskracht met lucht.
- Moeilijkheid:gemiddeld
- Chemische stoffen:ijzeroxalaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – verbranding
6.2.7. Het verbrandingsproduct koolstof

- Info: Welk verbrandingsproduct produceert een verbranding, naast waterdamp en koolstofdioxide? Koolstof of roet is een verbrandingsproduct dat gevormd wordt bij een verbrandingsreactie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid – verbranding
6.2.8. Het verbrandingsproduct koolstofdioxide aantonen

- Info: Welk verbrandingsproduct produceert een verbranding, naast waterdamp? Helder kalkwater dat troebel wordt is een indicator voor koolstofdioxide. Het klakwater wordt troebel dus koolstofdioxide is een verbrandingsproduct dat gevormd wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Helder kalkwater – Theelichtje
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: brandbaarheid – verbranding
6.2.9. Het luchtvolume en verbranding van kaarsen

- Info: Heeft het luchtvolume een invloed op een brandende kaars? Het luchtvolume heeft een invloed op de verbrandingstijd van de kaars. Hoe groter het luchtvolume, hoe langer de verbrandingstijd duurt. In de lucht is zuurstof aanwezig dus hoe meer lucht, hoe meer zuurstof en hoe langer de kaars brandt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: theelichtjes, 3x
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: verbranding
6.2.10. Hoe gebruik je correct een bunsenbrander, met veel of weinig zuurstof?

- Info: Hoe gebruik je correct een bunsenbrander? De blauwe vlam, waar de zuurstof volledig open staat, is niet alleen veel warmer, de verbranding verloop ook veel zuiverder, er is geen roetaanslag.
- Moeilijkheid: eenvoudig
- Chemische stoffen: oude en nieuwe bunsenbrander
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: verbranding
6.2.11. Identificatie van verbrandingsproducten van een kaars

- Info: Tot welke stoffen verbrandt een koolwaterstof? Afhankelijk van zuurstofconcentratie ontstaat koolstof, koolstofoxide en -dioxide en water
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – Stukje blauw kobaltchloride papier – 20 ml van kalkwater
- Thema: organische stoffen – redoxreacties
- Tijd: 10 min
- Begrippen: verbranding
6.2.12. Methaanvuurbal

- Info: Hoe maken we bellenblazen chemisch spectaculair? Nadat we de lucifer bij de bubbels houden, zien we een enorme vuurbal ontstaan. Het opmerkelijke is dat de handen van de proefpersoon niet verwond zijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: methaangas – lucifers – water
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 15min
- Begrippen:alkanen – verbrandingsreactie
6.2.13. Nitrocellulose

- Info: Ontbrandt een pingpongballetje als we dit aansteken? Katoenen watten bestaan voor vrijwel 100% uit cellulose, een polymeer van ß D-glucose, bestaande uit lange onvertakte ketens met 2000-3000 glucose-eenheden. Door de reactie met salpeterzuur, hierboven in rood aangegeven als HONO2, ontstaat de nitraat ester van cellulose. De OH-groepen van cellulose verliezen hierbij een proton en salpeterzuur een OH-groep om samen een molecuul water te vormen. Deze reactie is een evenwichtsreactie, maar doordat de zwavelzuur het vrijkomende water bindt is de reactie aflopend naar rechts.
- Moeilijkheid: eenvoudig
- Chemische stoffen: pH papier – Exsiccator – Salpeterzuur 70%: HNO3 – Zwavelzuur 98%: H2SO4 – Natriumwaterstofcarbonaat: ) NaHCO3 – Watten (100% katoen) – IJsgruis
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 25 min
- Begrippen:alkanen – verbrandingsreactie
6.2.14. Raket met lucifers

- Info: Hoe kunnen we met aluminiumfolie en een kaars, lucifers laten wegschieten als een raket? Door verhitting gaat de kaliumchloraat en de paraffine ontleden. Er wordt veel koolstof en zuurstofgas gevormd. Als deze in contact komen met de vlam van de kaars wordt er enorme hoeveelheid koolstofdioxide gevormd. Deze grote gasontwikkeling is de stuwkracht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Lucifers – Aluminiumfolie – Kaars
- Thema: enkelvoudige stoffen – chemische reactie – redoxreacties
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – exo-energetische reactie – verbrandingsreactie
6.2.15. Roestpreventie

- Info: Welke factoren beïnvloeden roestvorming? Vocht dat zich in de lucht bevindt of in het gekookte water, tast het ijzer aan. Bij ijzer is dit waar te nemen door het ontstaan van roest. Enkel wanneer de spijker niet in contact kwam met water of lucht vertoonde hij geen roest.Vocht is een oxiderend agens dat ervoor zorgt dat zuurstof uit de lucht, of de lucht die in het water is opgelost, ijzer aantast. Deze oxidatie heet corrosie en bij ijzer spreken we van roestvorming. De roestvorming van de andere spijkers hangt af van de effectiviteit van de bescherming.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 g gelatine in 100ml water en los daarin 0,2 g – kaliumhexacyanoferraat(III) op. Houd de oplossing warm, maar niet heet, omdat dan giftige stoffen kunnen vrijkomen. – 10ml 1mol/l zoutzuur – Ca 2 cm magnesiumlint -Klein stukje zinkfolie – Klein stukje koperfolie – Vaseline
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: corrosie – oxidatie – verbrandingsreactie
6.2.16. Sterretjes voor oud en nieuw

- Info: De voor sterretjes kenmerkende vonken ontstaan door de snelle verbranding van ijzer- en aluminiumpoeder. Bariumnitraat zorgt daarbij voor de benodigde zuurstof. Dextrine doet hierbij dienst als bindmiddel én brandstof.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Bariumnitraat: Ba(NO3)2 – Aluminiumpoeder: Al – IJzerpoeder: Fe – Dextrine: (C6H10O5)n – Spiritus: C2H5OH (85%) – Zoutzuur: HCl
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: exo-energetische reacties – lichtvorming -verbrandingsreactie
6.2.17. Verbranden van azijnzuur

- Info: Welke kleur vlam heeft azijnzuur bij het verwarmen? Het azijnzuur vormt een blauw gele vlam. Aan de rand van het porseleinen schaaltje ontstaat een beetje condenswater.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd azijnzuur
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: carbonzuren – organische reacties – verbrandingsreactie
6.2.18. Verbranden van ethyn

- Info: Welke stof wordt er gevormd door hydrolyse van calciumcarbide? Door de hydrolyse van calciumcarbide wordt er ethyn gevormd. Ethyn zal vervolgens reageren tot koolstofdioxide en water, d.m.v. verbranding.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumcarbide
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie – alkynen
6.2.19. Verbranding van brandstoffen

- Info: Welke stof brandt het beste: methanol, butaan-1-ol, heptaan-1-ol? Breng in 2 uitdampschaaltjes respectievelijk 2 à 3 ml methanol en evenveel butaan-1-ol en heptaan-1-ol in de anderen. Nader met een brandend lont beide brandstoffen. Neem het verschil in brandbaarheid waar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 à 6 ml methanol; – 4 à 6 ml butaan-1-ol. – 4 à 6 ml heptaan-1-ol
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
6.2.20. Verbranding van kaarsen in een afgesloten ruimte

- Info:Onder welke maatbeker blijft het kaarsje het langst branden? Als je het waxinelichtje aansteekt, dan branden het kaarsvet en het lont langzaam op. Voor de verbranding is zuurstof uit de lucht nodig. Tijdens het branden wordt er zuurstof (O2) omgezet in koolzuur (CO2). Als je een glas over het brandende waxinelichtje zet, dan verdwijnt de zuurstof onder het glas. En zodra er onvoldoende zuurstof is, dan zal het waxinelichtje uit gaan. De zuurstof in het glas is vervangen door koolzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
6.2.21. Verbranding van staalwol met batterij

- Info: Kunnen we staalwol verbranden met een batterij? Wanneer we de batterij in contact met het staalwol brengen, begint een chemische reactie (oxidatie).
- Moeilijkheid: eenvoudig
- Chemische stoffen: platte batterij 4,5V – aluminiumfolie – staalwol
- Thema: redoxreacties
- Tijd: 25 min
- Begrippen: verbrandingsreactie
6.2.22. Verbrandingsgassen bij de verbranding van alcohol

- Info: Welke dampen komen vrij als je alcohol verbrandt? Bij het verbranden van ethanol komen zowel koolstofdioxide als water vrij
- Moeilijkheid: eenvoudig
- Chemische stoffen: kakwater – ethanol
- Thema: redoxreacties
- Tijd: 25 min
- Begrippen: verbrandingsreactie
6.2.23. Vliegend theezakje

- Info: Wat gebeurt er als we een theezakje aansteken? Het papier verbrandt en er ontstaat koolstof.
Het papier verbrandt en wordt op het einde zo licht en zo warm dat het opstijgt. - Moeilijkheid: eenvoudig
- Chemische stoffen: Theezakje – Aansteker
- Thema: redoxreacties
- Tijd: 10 min
- Begrippen: verbrandingsreactie
6.2.24. Vuur schrijven

- Info: Kunnen we met vuur schijven?
- Moeilijkheid: eenvoudig
- Chemische stoffen: KClO3
- Thema: anorganische stoffen – chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: zouten – exo-energetische reacties – warmte- buskruit – verbrandingsreactie
6.2.25. Wasdampen ontsteken

- Info: Hoe kunnen we was toch laten branden? De was brandt niet in vaste toestand, maar wel in gastoestand
- Moeilijkheid: eenvoudig
- Chemische stoffen: Was van een kaars
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – warmte – verbrandingsreactie
6.2.26. Welk gas ontstaat er door de verbranding van een kaars?

- Info: Welk gas ontstaat er door verbranding van een kaars? Ca(OH)2 is een indicator voor CO2.
Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig.
Wanneer de oplossing troebel wordt, is er CO2 aanwezig. - Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – warmte – verbrandingsreactie
6.2.27. Zuurstof bevordert de verbranding

- Info: Breng het zuurstofgas in een grote proefbuis via een slang. – Steek de kaars aan en breng het in de proefbuis. De kaars brandt heviger.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 50ml zuurstofgas – 2ml kalkwater
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – warmte – verbrandingsreactie
6.2.28. Verbranding van suiker

- Info:Wat is de invloed van de as op het verbrandingsproces van suiker? Het verbranden van een suikerklontje is een chemische reactie. Om een chemische reactie te starten is energie nodig, bijvoorbeeld van de vlam van een lucifer. Het eerste suikerklontje brandt niet, omdat de lucifer niet genoeg energie geeft om de reactie te starten. Wanneer je het suikerklontje met as inwrijft, brandt het wel. Dit komt doordat de as meehelpt bij het verbranden van de suiker. Er is nu minder warmte nodig om de verbranding te starten. We noemen de as een katalysator. Voor het verteren van je eten zijn ook katalysatoren nodig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een suikerklontje – Brique – Assen
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – warmte – verbrandingsreactie
6.2.29. Rokende pingpongbal

- Info: Wat gebeurt er als een pingpongbal wordt aangestoken? Een pingpongbal is opgebouwd uit celluloïde. Dit is een stof die zeer ontvlambaar is. In aluminiumpapier gaat dit echter smeulen waardoor er witte rook ontstaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Pingpongbal – aluminiumfolie – Potlood
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – warmte – verbrandingsreactie
6.2.30. Vuur maken met vergrootglas

- Info: Wat gebeurt er als je zonlicht bundelt met een vergrootglas en het op een krant richt? De lichtvlek is erg helder, na korte tijd stijgt het papier en stijgt rook. Je kunt sintels zien aan de randen van de verkoolde gaten. Op een gegeven moment ontbrandt het papier in de buurt van de heldere lichtvlek.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Vergrootglas
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: warmte – verbrandingsreactie
6.2.31. Vuur maken met kauwgom

- Info: Hoe maak je een vuurtje met een batterij en kauwgompapier? Ten eerste stijgt er rook op het kauwgompapier. De batterij wordt erg heet. Dan begint het kauwgompapier op het dunste punt in het midden te verbranden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Batterij (AA, 1,5 V) – 1 strookje kauwgompapier
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: warmte – verbrandingsreactie
6.2.32. Belang van ontstekingstemperatuur

- Info: Hoe kun de ontstekingstemperatuur bepalen? Aceton, methanol en benzine vormen genoeg brandbare dampen om onmiddellijk in brand te vliegen. Petroleum moet voorverwarmd worden (met haardroger). Brandbare zware gassen kunnen langs een helling dalen en dan ontbranden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aceton – methanol – benzine – diesel
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: warmte – verbrandingsreactie
6.2.33. Zelfbrandende kaars

- Info: Kunnen we een kaars aansteken zonder een aansteker of lucifers? Wanneer we het mengsel in de kaars gieten gebeurt er niets. Wanneer we een druppel zwavelzuur aan het mengsel kaliumchloraat en suiker toevoegen ontstaat er een hevige vlam. De kaars brandt.
- Moeilijkheid:gemiddeld
- Chemische stoffen: een kaars, – KClO3, – geconcentreerd H2SO4, – suiker
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
7. Verdringingsreeks metalen
7.1. Aluminium reageert in een koperoplossing

- Info: Wat gebeurt er als je aluminium in een oplossing van een koperzout brengt? Wanneer aluminiumfolie wordt toegevoegd wordt er geen reactie waargenomen.
Na toevoegen van NaCl start de reactie, je kan onder het aluminiumfolie ‘belletjes’ ontstaan, later is een zwartverkleuring van het folie waarneembaar en zie je dat de er in de blauwe/groene kopersulfaatoplossing een rode neerslag wordt gevormd. Door toevoegen van zout start de reactie. - Moeilijkheid: eenvoudig
- Chemische stoffen: 10% CuSO4-oplossing -10% NaCl-oplossing – aluminiumfolie
- Thema: redoxreactie
- Tijd: 20 min
- Begrippen: verdringingsreeks metalen
7.2. Baardelektrolyse

- Info: Hoe kun je via elektrolyse een mannetje met baardje vormen? Door elektrolyse van een loodoplossing aan een koperdraad
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cu-draad – Pb(NO3)2-opl 0.1 mol/l
- Thema: redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse- verdringingsreeks metalen

- Info: Aluminium tracht zich te verbinden met dizuurstof met vorming van een oxidatielaagje. Hierdoor treedt geen corrosie meer op van Al. De oxidatie wordt gehinderd door reactie met kwikdichloride.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aluminiumfolie – HgCl2-oplossing 10%
- Thema: redoxreacties
- Tijd: 10 min
- Begrippen: verdringingsreeks metalen

- Info: Op welke manier kunnen we koolstof bereiden uit eierschalen? Eierschalen bevatten calciumcarbonaat. Dit gaat met magnesium koolstof vormen. Het wit licht dat tijdens de verbranding ontstaat, is afkomstig van het magnesium en de oranje vonkjes zijn afkomstig van het calciumcarbonaat in de eierschalen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Droge eierschalen – Magnesiumpoeder – Zoutzuur 1mol/l
- Thema: enkelvoudige stoffen – redoxreactie
- Tijd: 15 min
- Begrippen: verdringingsreeks metalen
7.5. Koperen takken

- Info: Verdringingsreactie met afzetting van Cu.
- Moeilijkheid: gemiddeld
- Chemische stoffen: fijn ijzerwol – kopersulfaatoplossing 10%
- Thema: anorganische stoffen – chemische reacties – redoxreactie
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – verdringingsreactie van metalen
7.6. Maak een tinnen sterrenhemel
- Info: Hoe krijg ik de grootste en mooiste sterretjes van tin ? Zink is een onedeler metaal dan tin, het verdringt tin(II)-ionen uit de verbinding
- Moeilijkheid: eenvoudig
- Chemische stoffen: Tin(II)chloride, – 18% zoutzuur, – zinkkorrels of een plaatje zink
- Thema: redoxreactie
- Tijd: 15 min
- Begrippen: zouten – stofveranderingen – verdringingsreactie van metalen
7.7. Passivering van ijzeren nagels met geconcentreerd salpeterzuur

- Info: Wat gebeurt er als we ijzeren nagels in geconcentreerd salpeterzuur brengen? Ijzer lost niet op in geconcentreerd salpeterzuur maar wel in verdund salpeterzuur. Dit komt doordat de metalen hun oppervlak beschermen door een passiverende laag van de overeenkomstige nitraten te vormen. Wanneer water wordt toegevoegd om het mengsel te verdunnen verloopt de reactie plots zeer snel en ontstaan de bekende bruine nitreuze dampen.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Salpeterzuur – 3 ijzeren nagels
- Thema: Anorganische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: zuren – complexreactie met salpeterzuur – verdringingsreeks metalen
7.8. Plaats van waterstof in de spanningsreeks van metalen

- Info: Hoe reageren verschillende metalen met HCl ?
- Moeilijkheid:gemiddeld
- Chemische stoffen: 6 mol/l HCl oplossing – Stukjes van volgende metalen: Mg, Pb, Fe, Zn en Cu
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.9. Spitse spijker

- Info: Kunnen we het koper van een muntje aanbrengen op een spijker? Het koper van de munten reageert met het zuur van de citroen en vormt het kopercitraat. Als de spijker in de oplossing komt, bedekt de stof de spijker met een dun laagje, wat niet is af te wrijven.
- Moeilijkheid: eenvoudig
- Chzmische stoffen: 20 doffe koperen munten – Zout – 1 grote schone spijker
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.10. Verdringingsreactie met zilvernitraat en koper

- Info: Wat gebeurt er met het koperplaatje van zodra deze in aanraking komt met zilvernitraat? Er vormen zich grijze vlekken plekken op het koperplaatje. Als je dichterbij kijkt zie een soort grijze pluis.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat oplossing (1 mol/l) – Koper metaal en/of koperdraad
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.11. Verdringingsreacties bij metalen
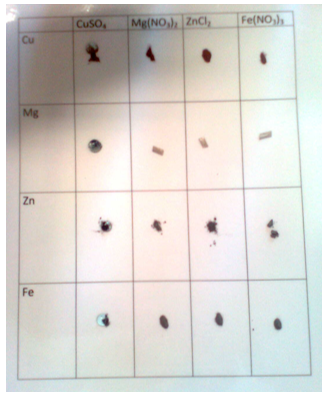
- Info: Wat is de volgorde bij de verdringingsreeks van metalen? De volgorde van de verdringingsreeks van de metalen in volgorde van meest onedel tot meest edel is in deze reeks bijgevolg:Mg Zn Fe Cu
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 0,2 mol/l – Fe(NO3)3 0,2 mol/l – Mg(NO3)2 0,2 mol/l – ZnCl2 0,2 mol/l – Mg lint – Zn granulen – Fe nageltjes/poeder – Cu draad
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.12. Verdringingsreeks in een nunclon

- Info: Hoe is de reactiviteit van metalen te vergelijken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 0,2 mol/l – Fe(NO3)3 0,2 mol/l – Mg(NO3)2 0,2 mol/l – ZnCl2 0,2 mol/l – Mg lint – Zn granulen – Fe nageltjes/poeder – Cu draad
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.13. Verdringingsreeks

- Info: Hoe is de reactiviteit van metalen te vergelijken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 0,2 mol/l – Fe(NO3)3 0,2 mol/l – Mg(NO3)2 0,2 mol/l – ZnCl2 0,2 mol/l – Mg lint – Zn granulen – Fe nageltjes/poeder – Cu draad
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen
7.14. Verhit magnesium reageert met water

- Info: Hoe beïnvloedt kokend water de verbranding van magnesiumlint? Verhit magnesium reageert met water waarin zuurstof gebonden zit. Magnesium is onedeler dan waterstof
- Moeilijkheid: gemiddeld
- Chemische stoffen: Water – Magnesiumlint
- Thema: enkelvoudige stoffen – periodiek systeem – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – aardalkalimetalen – spanningsreeks metalen
7.15. Verkoperen van een ijzeren plaat

- Info: Het element koper heeft een normpotentiaal van +0,34 V en is edeler dan ijzer met een normpotentiaal van -0,44 V. Deze reactie loopt niet als het ijzer vooraf in de salpeterzuur wordt gebracht. Er blijkt een beschermlaag te ontstaan die verwijderd wordt door het schudden of tikken..
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 oplossing – 5% geconcentreerd HNO3 – aceton – ijzeren plaatje
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – galvaniseren- verdringingsreeks metalen
7.16. Zilverbos

- Info: Aan het koperen plaatje treedt een afzetting op van Ag, dit in de vorm van zilveren draden .
- Moeilijkheid: eenvoudig
- Chemische stoffen: koperplaatje – zilvernitraatoplossing 10%
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.17. Zinc Christmas tree

- Info: Hoe gaan zink een loodnitraat met elkaar reageren? Zink is een onedeler metaal dan lood. Lood zet zich af op de zinken plaat. Lood vormt hierbij mooie kristallen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zink plaatje eventueel in de vorm van een kerstboom – Loodnitraat oplossing 0.5 mol/l
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.18. Zink en koperdichloride

- Info: Wat gebeurt er wanneer we zink en koperdichloride samenvoegen? Redoxreactie tussen koperionen en een onedel metaal. De Cl– -ionen katalyseren de reactie. Deze reactie treedt daarom niet op met kopersulfaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Spatel/lepel – Zinkpoeder – koperdichloride
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.19. Metaalbomen door sedimentatie

- Info: Wat neem je waar tijdens sedimentatie op een koperdraad en van zilver op een zinkkorrel? Er worden zilverkristallen rond het koperdraadje gevormd. Zink is een onedeler metaal dan lood. Lood zet zich af op de zinken plaat. Lood vormt hierbij mooie kristallen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat-oplossing (5%) – Loodnitraat-oplossing (5%) – Koperdraad – Reepjes zink
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.20. Reactie van ijzer en aluminium met koperionen

- Info: Wat neem je waar tijdens de reactie van staalwol met koperchloride, aluminiumfolie en koperchloride? Het staalwol begint te krullen en te buigen, terwijl in de buis een geelgroene laag zichtbaar wordt. Na een tijdje zakt de staalbol naar de bodem. Het aluminium reageert heftig. Het ontstane gas duwt soms de prop uit de vloeistof. De oplossing wordt ontkleurd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Demiwater – Staalwol – Aluminiumfolie – Koper(II)chloride 0,8 mol/l
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.21. De stekelbol

- Info: Wat neem je waar als je een zinkbolletje in een tinchloride-oplossing doet? De reactie tussen SnCl2 en Zn vindt plaats nabij het oppervlak van de zinkpellet. Tin, dat een product is van deze reactie, groeit als naaldachtige kristallijne structuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Tinchloride-oplossing 0,5 mol/l -Zinkbolletje
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.22. Metaalgevecht om een paperclip

- Info: Wat neem je waar als een paperclip in een kopsulfaat oplossing met natriumwaterstofsulfaat oplossing wordt gelegd? Er vindt een redoxreactie plaats, ijzer reduceert koper.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Paperclip – Koper(II)sulfaat 0,5 mol/l – Natriumwaterstofsulfaat 0,1 mol/l
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.23. Metaalbomen door sedimentatie in een proefbuis

- Info: Hoe kunnen we d.m.v. neerslagvorming metaalbomen maken? Er treedt neerslagvorming op bij de reactie tussen koper en zilvernitraat.Als dit langer blijft staan kleurt de oplossing langzaam blauw. Er wordt zilver en kopernitraat gevormd.Er treedt ook neerslagvorming op bij de reactie tussen zink en loodnitraat. Er wordt lood en zinknitraat gevormd
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat (5%) – Lood(II)nitraat (5%) – Twee stukjes koperdraad – twee zink bolletjes
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.24. Verdringingsreeks in microschaal

- Info: Welke metalen worden het makkelijkste geoxideerd? Metalen en zouten laten reageren in een blisterverpakking
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 koperdraadjes – 2 tin bolletjes – 2 zink bolletjes – Tinchloride-oplossing – Kopersulfaat 1mol/l 10ml – Zinksulfaat 0,5 mol/l 10ml
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.25. Verdringingsreacties metalen
- Info: Hoe kunnen we metalen ordenen qua reactiviteit?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)sulfaat 75 ml 0,1 mol/l – Zinksulfaat 75 ml 0,1 mol/l – Magnesiumsulfaat 75 ml 0,1 mol/l – Loodsulfaat 75 ml 0,1 mol/l – Magnesiumlint – Zink folie – Lood – Koper
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
7.26. Egeltjes in petrischaal

- Info: Hoe kunnen we egeltjes maken op “chemisch niveau”? De reactie tussen SnCl2 en Zn vindt plaats nabij het oppervlak van de zinkpellet. Tin, dat een product is van deze reactie, groeit als naaldachtige kristallijne structuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1g tin(II)chloride (SnCl2.2H2O) – 10 ml Natriumwaterstofsulfaatoplossing 0,5 mol/l (NaHSO4) – Zinkkorreltjes
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks metalen
8. Verdringingsreeks met niet-metalen

- Info: Hoe kunnen we Cl²-gas verkrijgen en de verdringingsreeks hiermee aantonen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: bleekwater (NaOCl) – HCl 1mol/l – ZnS – ZnO – KI
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks niet-metalen
8.2. Redoxreacties met halogenen

- Info: Hoe kunnen we de spanningsreeks van niet-metalen aantonen met een luciferdoosje? Chloor is een sterk oxidatiemiddel en reageert met halogenide bromide en jodide. Zo zal dichloor het jodide ion oxideren tot dijood. Het gevormde dijood is waar te nemen door de bruinkleuring.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Lucifers – luciferdoosje – KI oplossing 1 mol/l – 10% zoutzuuroplossing
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks niet-metalen
8.3. Gekleurde verdringingsreeks van niet-metalen

- Info: Welk halogeen is het meest reactief en welk het minst? Uitvoering van proeven om de spanningsreeks bij halogenen te bepalen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cyclohexaan – Kaliumfluoride – Kaliumchloride – Kaliumbromide – Chloorwater – Broomwater – Kaliumjodide
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks niet-metalen
8.4. Verdringingsreeks met halogenen

- Info: Hoe kan je de verdringingsreeks van halogenen afleiden in een minischaalopstelling?Uitvoering van proeven om de spanningsreeks bij halogenen te bepalen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Chloorgas – Dibroomwater (een verdunde, gele oplossing) – Dijoodoplossing (verdunde lugoloplossing) – 1% kaliumchloride-oplossing – 1% kaliumbromide-oplossing – 1% kaliumjodide-oplossing
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – verdringingsreeks niet-metalen
9. Galvaniseren
9.1. Verkoperen van een metalen voorwerp

- Info: Hoe kun je een metalen voorwerp bedekken met een dun laagje koper? Na korte tijd kun je zien dat het metalen voorwerp van kleur verandert wanneer het in de vloeistof wordt ondergedompeld. De koperen plaat wordt blauwachtig van kleur. Nadat het metalen voorwerp uit het galvaniseerbad is gehaald en vervolgens is uitgespoeld, hecht de koperkleurige laag zich.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 g kopersulfaat – 20 g kaliumnatriumtartraat – 2 g natriumchloride – 1 koperen plaatje
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – galvaniseren






