Elektrolyse van water: Eigen toestel van Hoffman
1.Voorbereiding
a.Materiaal + stoffen
- elektrolysetoestel
- zwavelzuuroplossing 1.3M
2.Uitvoeren
a.Werkwijze
- Breng de zwavelzuuroplossing in het toestel van Hofmann. Onder invloed van een elektrische gelijkstroom wordt het water ontbonden in twee gassen.
- Noteer bij een bepaalde stroomsterkte telkens na 1 minuut het volume dizuurstof en het volume diwaterstof in het toestel van Hofmann (doe dit 10 minuten).
- Noteer nu opnieuw bij een dubbele stroomsterkte telkens na 1 minuut het volume dizuurstof en volume diwaterstof in het toestel van Hofmann.
- Welke relatie is er tussen het volume diwaterstof en het volume dizuurstof die bij elektrolyse van water ontstaan?
- Wat wordt waargenomen wanneer een gloeiende houtspaander aan de geopende kraan boven de positieve pool wordt gehouden.
- Vang een hoeveelheid waterstofgas op in een droge proefbuis. Breng een brandende lucifer bij het uiteinde van de reageerbuis. Wat gebeurt er?
b.Waarneming (+ foto’s)

3.Reflecteren
Elektrolyse is de ontleding van een elektrolyt door middel van gelijkstroom. Hierbij vindt, in tegenstelling tot de reacties in een elektrochemische cel, een gedwongen overdracht van elektronen plaats. Met andere woorden, de (redox)reacties verlopen niet spontaan, maar worden geforceerd door een externe gelijkstroombron.
Volgens afspraak is de elektrode waaraan reductie plaatsvindt (elektronen worden opgenomen) de kathode. Hiervoor komt als eerste de sterkste oxidator in aanmerking; dit is de stof die het gemakkelijkst elektronen opneemt. In dit geval de H3O+ afkomstig van de zwavelzuur die door de kathodereactie wordt gereduceerd onder vorming van waterstofgas en water.
De elektrode waaraan oxidatie plaatsvindt (elektronen worden afgestaan) is de anode. Hiervoor komt als eerste de sterkste reductor in aanmerking; dit is de stof die het gemakkelijkst elektronen afstaat. In dit geval het oplosmiddel water wat door de anodereactie wordt geoxideerd onder vorming van zuurstof.
De halfreacties zijn:
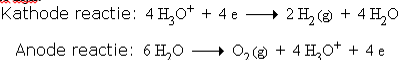
Aan de halfreacties is te zien dat de van zwavelzuur afkomstige H3O+ niet wordt verbruikt. Praktisch gezien dient de zwavelzuur alleen om de geleidbaarheid van de oplossing te vergroten. Optellen van de halfreacties geeft de totale celreactie:
![]()






