Galvanische elementen
1.Onderzoeksvraag
Waarin verschillen galvanische elementen van elkaar?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Elektrolyse: Een chemische reactie waarbij onder invloed van een elektrische stroom stoffen ontleed worden.
- Galvanisch element: Elektrochemische stroombron, kan elektrische stroom leveren als resultaat van een chemische omzetting.
b.Materiaal + stoffen
- Gescheiden petrischaal
- Filtreerpapier 1,5 x 0,8 cm
- Koperelektroden
- Zinkelektroden
- Magnesium elektroden
- Pincet
- Voltmeter
- Geconcentreerde zoutoplossing :(zout: kaliumnitraat of natriumsulfaat)
- Kopersulfaat-oplossing CuSO4 0,5 mol/l
- Zinksulfaat-oplossing ZnSO4 0,5 mol/l
- Magnesiumsulfaat-oplossing MgSO4 0,5 mol/l
c.Opstelling (foto)
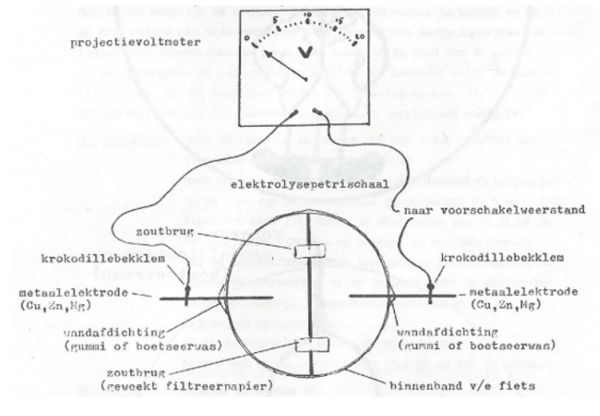
e.Etiketten


3.Uitvoeren
a.Werkwijze
Petrischaal maken:
(We maken drie petrischalen)
- Neem een plastic petrischaal met in het midden een scheidingswand.
- Maak twee gaatjes in de rand op de middelloodlijn van de scheidingswand met een hete spijker.
- Steek de elektroden door de gaatjes en maak ze waterdicht met boetseerklei.
- Petrischaal 1: Koperelektrode en zinkelektrode
- Petrischaal 2: Koperelektrode en magnesiumelektrode
- Petrischaal 3: Zinkelektrode en Magnesiumelektrode
Zoutbruggen:
- Knip strookjes filtreerpapier die als een brug over de scheidingswand kunnen staan.
- Week de strookjes in een geconcentreerde zoutoplossing.
Petrischaal 1:
- Vul de schaalhelft aan de koperelektrode met CuSO4.
- Vul de schaalhelft aan de zinkelektrode met ZnSO4.
- Sluit de elektroden aan op de voltmeter.
- Leg met een pincet de zoutbruggen over de scheidingswand.
Petrischaal 2:
- Vul de schaalhelft aan de koperelektrode met CuSO4.
- Vul de schaalhelft aan de magnesiumelektrode met MgSO4.
- Sluit de elektroden aan op de voltmeter.
- Leg met een pincet de zoutbruggen over de scheidingswand.
Petrischaal 3:
- Vul de schaalhelft aan de magnesiumelektrode met MgSO4.
- Vul de schaalhelft aan de zinkelektrode met ZnSO4.
- Sluit de elektroden aan op de voltmeter.
- Leg met een pincet de zoutbruggen over de scheidingswand.
b.Waarneming (+ foto’s)

4.Reflecteren
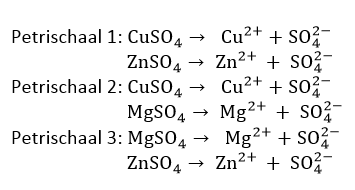
We kregen het hoogste voltage bij de combinatie van koper en magnesium, namelijk 2,01 V. Dit is hoger dan de theoretische waarde van 1,5 V. Ook zien we gasontwikkeling bij de magnesiumpool. Die gasontwikkeling zien we ook als we magnesium combineren met zink maar in veel mindere maten. Magnesium en zink is ook onze zwakste combinatie met een voltage van 840 mv, dit is wel weer hoger dan de theoretische waarde van 0,6 V. Bij koper en zink noteren we een voltage van 1,09 V wat ongeveer gelijk is aan de theoretische waarde van 1,1 V. Deze voltages worden allemaal opgewekt door de redoxreacties die plaatsvinden omdat we zoutbruggen hebben geplaatst over de scheiding. We kunnen dus zeggen dat de redoxreactie tussen koper en magnesium heviger is dan de reactie tussen koper en zink of tussen zink en magnesium.
5. Aanvullingen
De proef wordt nu uitgevoerd in een gescheiden petrischaal, om het nog wat kleiner te maken zouden we het ook kunnen uitvoeren m.b.v. een nunclonschaal.
Dan gebruiken we twee putten van de nunclonschaal in plaats van een hele petrischaal.






