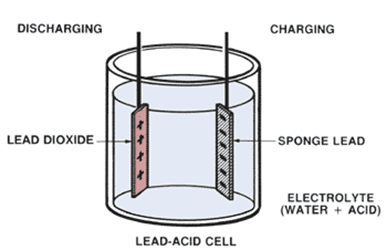
De herbruikbare batterij : de loodaccumulatiebatterij
1.Voorbereiding
Materiaal + stoffen
- bekerglas van 50ml
- loodfolie 0,2mm 250g
- zwavelzuur 0.5 mol/l
- batterij 4,5 V
- multimeter
- klemmen en kabels
- motor
- celblok
2.Uitvoeren
Werkwijze
Opstapeling van energie in een herbruikbare galvanische cel
- Snij twee strips van 1,5 op 9cm uit een loodfolie. Zet dit in een beker met de uiteinden over de beker geplooid.
- Maak een circuit door een batterij van 4.5V in serie te plaatsen. Vul nu de beker voor 2/3 met de zwavelzuuroplossing.
Waarneming:
De elektrolyse gebeurt tussen de elektroden met vrijzetting van waterstofgas aan de negatieve pool en zuurstofgas aan de positieve.
Er ontstaat een elektrolyse tussen de elektrodes met vorming van waterstofbellen aan de negatieve pool en zuurstofbellen aan de positieve pool. Bij een spanning van 4 tot 5 V bedraagt de stroom ongeveer 300 tot 500 mA.
Na 2 tot 3 minuten wordt de stroombron verwijderd en worden de strips bekeken.
Het oppervlak van de loden strip aan de positieve pool is bruin door neerslag van looddioxide, de andere strip is grijs gekleurd door de vorming van lood. Zet de motor in aan stand.
De motor draait met een hoge snelheid, geleidelijk aan vermindert dit.
De cel kan terug opgeladen worden door de motor terug te vervangen door de batterij van 4,5V. Na een halve minuut kan terug gewisseld worden.
Verklaring:
Elektrische spanning kan enkel indien gebruik wordt gemaakt van verschillende elektroden ofwel van oplossingen met verschillende concentraties. Initieel kan in de opstelling geen spanning ontstaan.
Het oppervlak van de loodstrips reageren echter met zwavelzuur ter vorming van loodsulfaat
Pb + H2SO4 –> PbSO4 + H2
Lood wordt hierbij omgezet in Pb2+
Met een opgelegde spanning ontstaat elektrolyse van het zwavelzuur. Zuurstof wordt afgegeven aan de anode en waterstofgas aan de kathode. Op hetzelfde moment gebeurt een oxydatie van lood naar Pb4+
PbSO4 + 2H20 –> PbO2+ SO42- + 4 H+ + 2 e–
Pb2+ –> Pb4+ + 2 e–
Aan de kathode wordt lood2+ gereduceerd tot lood.
PbSO4 + 2 e– –> Pb + SO42-
Pb2+ + 2 e– –> Pb°
Twee verschillende elektroden vormen een geleidingsproces met een spanningsverschil van ongeveer 2V.
Indien de cel gebruikt wordt als bron keren de reacties om.
Na 2 tot 3 minuten wordt het circuit onderbroken en wordt de batterij vervangen door een motortje.
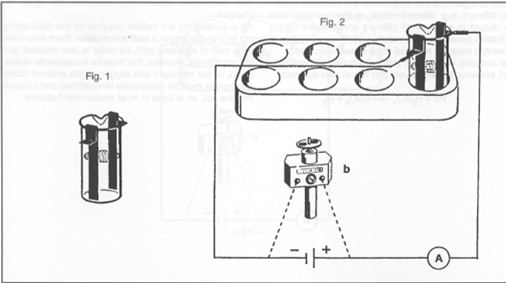
Vul de beker nu voor 2/3 met de verdunde zwavelzuuroplossing.Aan de positieve pool is de elektrode bruin, aan de andere kant grijs.
Breng nu de elektrische motor in het circuit in plaats van de batterij.