Reactie tussen ijzer(II)sulfaat en zilvernitraat
1.Onderzoeksvraag
Welke reactie treedt er op en wat gebeurt er wanneer we ijzer(II)sulfaat en zilvernitraat en later ijzer(III)nitraat bij elkaar voegen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Redoxreactie, evenwichtsreactie
b.Materiaal + stoffen
- proefbuisrek met proefbuizen
- 3 pipetten
- 3 bekerglazen 100 ml
- 0,1 mol/l FeSO4 oplossing
- 0,1 mol/l AgNO3 oplossing
- 1 mol/l Fe(NO3)3 oplossing
c.Bereiding oplossingen
M FeSO4.7H2O = 55,8 + 32,1 + (16 * 4) + (18*7) = 277,9 g/mol
m FeSO4.7H2O (oplossing van 1l) = M * n = 277,9 g/mol * 0,1 mol = 27,79 g
m FeSO4.7H2O (oplossing van 0,05l) = 27,79 g / 20 = 1,3895 g in 50 ml
M AgNO3 = 107,9 + 14,0 + (16 * 4) = 185,9 g/mol
m AgNO3 (oplossing van 1l) = M * n = 185,9 g/mol * 0,1 mol = 18,59 g
m AgNO3 (oplossing van 0,05l) = 18.59 g / 20 = 0.9295 g in 50 ml
M Fe(NO3)3.9H2O = 55,8 + (14,0 *3) + (16,0 *9) + (1,0 * 18) + (16,0 * 9) = 403.8 g/mol
m F(NO3)3.9H2O (oplossing van 1l) = M * n = 403.8 g/mol * 1 mol = 403.8 g
m Fe(NO3)3.9H2O (oplossing van 0,1l) = 403.8 g / 10 = 40.38 g in 100 ml
d.Opstelling (foto)

e.Etiketten

f. COS brochure
Reactie tussen ijzer(II)sulfaat en zilvernitraat
a.Werkwijze
- Neem van alle drie de oplossingen een beetje apart in de drie bekerglazen.
- Plaats in ieder van die drie bekertjes een aparte pipet.
- Neem dan als eerste twee ml ijzer(II)sulfaat met een pipet en doe het in een proefbuis.
- Neem daarna ook twee ml zilvernitraat met een pipet en voeg het in diezelfde proefbuis.
- Schud even met de proefbuis en kijk wat er gebeurt.
- Na twee minuten voeg je als laatste vier ml ijzer(III)nitraat aan de proefbuis toe.
- Schud weer even met de proefbuis en kijk wat er gebeurt.
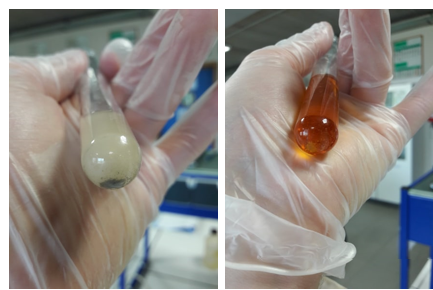
b.Waarneming (+ foto’s)
Waarneming 1: De oplossing krijgt een licht grijze kleur en op de bodem vormt er zich een grijs/zwarte neerslag.
Waarneming 2: De oplossing verandert van kleur en krijgt een licht oranje kleur. Op de bodem vormt er zich een kleine bruin/gele neerslag.
4.Reflecteren
Waarneming 1: 3 FeSO4 + 2 AgNO3 2 Ag↓+ Fe(NO3)2 + Fe2(SO4)3
Waarneming 2: Bij toevoegen van een overmaat Fe3+-ionen verloopt de omgekeerde reactie volledig. De bruine kleur is het gevolg van het toegevoegde FeCl3. In eerste instantie treedt een redoxreactie op waarbij een zilverspiegel wordt gevormd. Toegevoegde Fe3+– werken volgens de GW-wet de reactie tegen. Hierdoor wordt het zilver terug omgezet in Ag-ionen.
5. Aanvullingen
KLIK –






