Droge cel
Filmfragment
1.Onderzoeksvraag
Hoe kunnen we zelf een AA-batterij maken?
2.Voorbereiding
- Mangaanoxide
- Ammoniumchloride
- Voltmeter
- Zinkplaatje
- Kabels
- Potlood (aan beide kanten 1 punt)
- Krokodillenklemmen
- Gedemineraliseerd water

3.Uitvoeren
a.Werkwijze
- Elektrolyt oplossing wordt verkregen door het mengen van 86,0 g MnO2 en 53.5 g NH4Cl in 36 ml gedemineraliseerd water.
- Verbind het potlood met de positieve pool van de voltmeter.
- Verbind het zinkplaatje met de negatieve pool van de voltmeter.
- Breng deze elektroden in de elektrolyt oplossing.
- Zet de spanningsbron aan (1,5 V)
b.Waarneming (+ foto’s)

4.Reflecteren
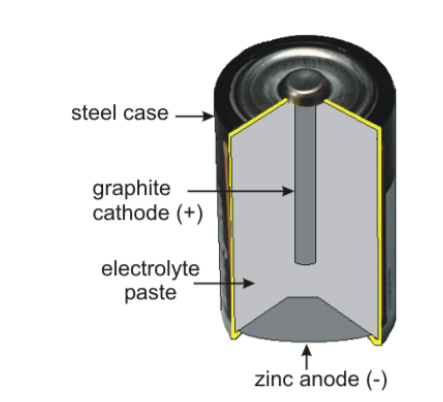
Een droge cel bestaat uit een kathode (metaal of grafiet) omgeven door een vochtige elektrolytische pasta. De pasta is ingesloten in de anode en de hele cel is meestal verpakt in een ander materiaal om lekkage te voorkomen zoals weergegeven in de figuur hieronder. In dit experiment is de chemie van een standaard droge-celbatterij aangetoond in een glazen beker. Het geslepen potlood doet dienst als grafietstaaf (een inactieve kathode) en wordt ondergedompeld in een zuur (NH4+) elektrolytische pasta met het oxidatiemiddel, MnO2. De cel is voltooid door de aanwezigheid van de zinkelektrode die als de anode dient. De twee helft reacties die plaatsvinden in deze cel worden hieronder getoond, hoewel de reactie route voor de reductie is nog steeds onduidelijk (een mogelijk pad wordt getoond). EEN referentie die mogelijke paden bespreekt wordt gegeven. Als het goed is gebouwd, deze droge cel produceert ongeveer 1,5 V en kan worden gebruikt voor het aandrijven van elektronische apparaten kleine spanningen nodig hebben.
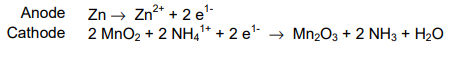
5.Onderwerpen
- batterij
- galvanische cel
- anode en kathode






