Hoofdstuk 9 – Experimenten
1. Alcoholen
1.1. Ethanol
1.1.1. Alcoholcement

- Info: Wat gebeurt er als we eiwitten behandelen met zuren? Zowel cola als azijn bevatten zuren. Cola bevat fosforzuur en azijn bestaat natuurlijk uit een lage concentratie azijnzuur. Het zuur zorgt voor de denaturatie van de eiwitten die we terugvinden in de Baileys.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Azijn – Cola – Baileys / koffiemelk/ cream
- Thema: organische stoffen – neerslagreactie – biochemie
- Tijd: 10 min
- Begrippen: denaturatie van eiwitten
1.1.2. Alcoholgehalte bepalen van jenever

- Info: Hoeveel alcohol bevat jenever? In de maatcilinder zien we dat er ongeveer 3,8ml alcohol in de maatcilinder zit. In de maatcilinder ziet wat meer dan 10ml jenever. Dus als we dit snel omrekenen komen we op 33% alcohol uit. Dit komt overeen met de opgegeven 30%.
- Moeilijkheid: eenvoudig
- Chemische stoffen: jenever – kopersulfaat – kaliumbicarbonaat/natriumcarbonaat
- Thema: organische stoffen – chemisch rekenen
- Tijd: 20 min
- Begrippen: bepaling gehalte ethanol
1.1.3. Alcoholoxidatie

- Info: Wat gebeurt er met de paars gekleurde propan-1-ol, propan-2-ol en t-butanol bij de oxidatie? Propan-1-ol wordt geoxideerd door permanganaat tot propanal en tot propionzuur. Propan-2-ol oxideert tot aceton. Het permanganaat gaat naar het groene MnO42- en tot MnO2. Tertiair butanol ondergaat geen oxidatie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KMnO4 (0,006 mol/l) – NaOH (1mol/l) – Propan-1-ol & propan-2-ol & t-butanol
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: reacties met organische stoffen – oxidatie
1.1.4. Bepalen van alcoholgehalte in alcopops

- Info: Hoeveel alcohol zit er in een alcopop? De alcopop bevat inderdaad iets van een 10 procent alcohol. De destillatie is vrij eenvoudig uit te voeren
- Moeilijkheid: gemiddeld
- Chemische stoffen:Alcoholpop
- Thema: organische stoffen – chemisch rekenen
- Tijd: 20 min
- Begrippen: concentratie -verbranding – doseren alcoholgehalte
1.1.5. Bereiding van ethanol

- Info: Hoe kun je ethanol bereiden? Het sucrose hydrolyseert tot enkelvoudige suikers in oplossing en in aanwezigheid van gist
- Moeilijkheid: gemiddeld
- Chemische stoffen: 100 ml suikeroplossing 60 g/100ml – 2 g bakkersgist
- Thema: organische stoffen – biochemie
- Tijd: 20 min
- Begrippen: concentratie – vergisting
1.1.6. Brandende zakdoek

- Info: Het water dat in de zakdoek zit, zorgt ervoor dat als het alcohol verbrand is, de doek niet verbrandt. Door de warme alcohol vlam zal er weliswaar iets verdampen maar daardoor behoudt de doek juist een lage temperatuur (tijdens een faseverandering van vloeistof naar gas blijft de temperatuur constant) en kan het niet ontbranden.De doek kan pas ontbranden als alle water verdampt is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: isopropanol-water of ethanol-water (50-50)
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: concentratie – verbranding
1.1.7. Bij welk alcoholpercentage kun je jenever doen branden?

- Info: Het water dat in de zakdoek zit, zorgt ervoor dat als het alcohol verbrand is, de doek niet verbrandt. Door de warme alcohol vlam zal er weliswaar iets verdampen maar daardoor behoudt de doek juist een lage temperatuur (tijdens een faseverandering van vloeistof naar gas blijft de temperatuur constant) en kan het niet ontbranden.De doek kan pas ontbranden als alle water verdampt is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: isopropanol-water of ethanol-water (50-50)
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: concentratie – verbranding
1.1.8. De alcoholtest

- Info: Wat zal er gebeuren als ethanol in contact komt met kaliumdichromaat? Na een minuut ontstaat een groene kleur van Cr3+ in de dichromaatoplossing welke geleidelijkaan de oranje kleur omzet naar geel-groen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 5% K2Cr2O7 oplossing – H2SO4 geconcentreerd – Ethanol 97%
- Thema: anorganische stoffen– redoxreactie – organische stoffen
- Tijd: 25 min
- Begrippen: zouten – identificatie ethanol
1.1.9. Drijven of zinken

- Info: Is de dichtheid van water groter of kleiner dan de dichtheid van alcohol?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijsblokvormpjes – water – alcohol – ijsblokjes
- Thema: organische stoffen – stofeigenschappen
- Tijd: 25 min
- Begrippen: ethanol – massadichtheid
1.1.10. Etheenbereiding uit ethanol door katalysator

- Info: Hoe kan je etheen uit ethanol bereiden? Deze proef toont aan dat door middel van een katalysator en verhitting de ethanol wordt omgezet in een gas, nl. etheen. De katalysator zorgt in dit geval voor een kraakproces en breekt dus de bindingen van ethanol door.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Staalwol – Ethanol – Katalysator
- Thema: organische stoffen – alcohol
- Tijd: 25 min
- Begrippen: ethanol – koolwaterstoffen
1.1.11. Geflambeerd geld

- Info: Wat gebeurt er wanneer we een briefje geld (of stukje papier) dat ondergedompeld is geweest in wodka, whisky of een oplossing bestaande uit 50% water/50% ethanol in brand steken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Briefje geld of een stukje papier – Alcoholrijke drank/oplossing 50% water/50% ethanol – keukenzout
- Thema: organische stoffen – alcoholen
- Tijd: 25 min
- Begrippen: ethanol – koolwaterstoffen
1.1.12. Het schenden van briefgeheim

- Info: Hoe kunnen we een brief lezen in een gesloten envelop? De tekst van een brief kan zichtbaar worden gemaakt als de envelop wordt bevochtigd met ethanol. Papier is polair en neemt ethanol op, daardoor wordt het papier enigszins doorzichtig. De inkt schijnt vervolgens door de envelop heen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanol – potlood
- Thema: stofeigenschappen – eigenschappen van stoffen – organische stoffen – alcohol
- Tijd: 15 min
- Begrippen: polariteit – polaire stoffen – waterstofbrugkrachten – ethanol
1.1.13. Hoe bekomen we de hoogst mogelijke stuiterbal?

- Info: Doe 20 ml waterglas in het plastic bekertje. Voeg 10 ml ethanol toe.Meng het mengsel m.b.v. de spatel en maak een gelijkmatige cirkelvormige beweging.. Als het mengsel vast wordt , kneed tot een bal.
- Moeilijkheid: eenvoudig
- Chemische stoffen:waterglas (natriumsilicaat) – ethanol (95%) (alcohol)
- Thema: anorganische stoffen – chemische reacties – organische stoffen – alcohol
- Tijd: 25 min
- Begrippen: zouten – katalysator – stofvorming – ethanol
1.1.14. Mysterieuze ijsblokken

- Info: In welke stof gaat het ijsblokje zinken? De dichtheid van ijs is 0,9 gram per ml, van water 1 gram per ml en van ethanol 0,79 gram per ml. Omdat de dichtheid van ijs kleiner is dan water gaat het ijsblokje blijven drijven. Omdat de dichtheid van ijs groter is dan dat van ethanol gaat het ijsblokje zinken naar de bodem.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 ijsblokjes – Water – Ethanol
- Thema: stofeigenschappen – chemische reacties – organische stoffen – alcohol
- Tijd: 25 min
- Begrippen: dichtheid – ethanol
1.1.15. Reductie van kaliumpermanganaat met ethanol

- Info: In een zure oplossing wordt permanganaat gereduceerd tot Mn(II) met ethanol. Tijdens de reductie verandert de paarse kleur in een bijna kleurloze oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1 mol/l KMnO4, – gec H2SO4, – ethanol
- Thema: redoxreacties – chemische reacties – organische stoffen – alcohol
- Tijd: 25 min
- Begrippen: oxidans – ethanol – verschillende oxidatiegetallen mangaan
1.1.16.Troebel komt en gaat met ouzo

- Info: Kunnen we een emulsie omzetten naar een oplossing? Anijs en ouzo bevatten naast alcohol (ethanol) ook olie-achtige extracten van o.a. steranijs. De olie lost op in het ethanol/watermengsel. Wordt het percentage ethanol te laag, door toevoeging van water, dan ontstaan druppeltjes olie. Dit is vergelijkbaar met de miniscule vetdruppeltjes in melk. Toevoeging van detergent maakt de fasenscheiding weer ongedaan. De vetbolletjes lossen op in zeep.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aperitief: ouzo, raki (anijssmaak) – een beetje afwasmiddel
- Thema:stofeigenschap – organische stoffen – alcohol
- Tijd: 25 min
- Begrippen: mengsel – emulsie – ethanol
1.1.17. Verbrandingsgassen

- Info: Welke dampen komen vrij als je alcohol verbrandt? Bij het verbranden van ethanol komen zowel koolstofdioxide als water vrij
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kalkwater – Ethanol – Kobaltchloridepapier
- Thema: chemische reacties – organische stoffen – alcohol
- Tijd: 20 min
- Begrippen: verbranding – ethanol
1.1.18. Verbranding van boorzuur in ethanol en methanol

- Info: Wat gebeurt er wanneer we boorzuur verbranden in combinatie met verschillende stoffen(ethanol, methanol)?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Boorzuur – Ethanol – methanol – zwavelzuur
- Thema: chemische reacties – organische stoffen – alcohol
- Tijd: 20 min
- Begrippen: verbranding – ethanol
1.1.19. Reactie tussen ethanol en koperoxide

- Info: Wat gebeurt er als we een mengsel van CuO en ethanol verwarmen? Bij het verwarmen krijgt het mengsel een roodbruine kleur. Bovenin de reageerbuis condenseert een kleurloze vloeistof. Er ontstaat koper en ethanal, dit komt doordat ethanol een grotere affiniteit voor zuurstof heeft dan koper.
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuO – Ethanol 100%
- Thema: chemische reacties – organische stoffen – alcohol – redoxreacties
- Tijd: 20 min
- Begrippen: verbranding – ethanol
1.1.20. Reactie tussen kaliumdichromaat en ethanol in zuur milieu

- Info: Wat gebeurt er als we een mengsel van K2Cr2O7 en ethanol verwarmen? Bij het samenvoegen wordt de oranje gekleurde oplossing groen. Er is een aparte geur waarneembaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: K2Cr2O7 0,1 mol/l – Ethanol 96% – Zwavelzuur 1 mol/l
- Thema: chemische reacties – organische stoffen – alcohol – redoxreacties
- Tijd: 20 min
- Begrippen: oxidans – ethanol
1.1.21. Wolken creëren

- Info: Hoe kunnen we een wolk nabootsen in een PET-fles? De wolk in de fles ontstaat er doordat de druk in de fles gaat stijgen waardoor de alcoholdeeltjes gasvormig worden. Wanneer de druk er dan vanaf gaat dan gaan de gasvormige deeltjes veranderen in vloeibare deeltjes die zich vormen zoals een wolk.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol
- Thema: organische stoffen – alcohol
- Tijd: 20 min
- Begrippen: fasenovergangen
1.1.22. Reinigen van vet met ethanol

- Info: Waarom wordt alcohol gebruikt voor glazenwassers? Ethanol is een oplosmiddel voor vet . Water daarentegen vermengt zich niet met vetten. Dit komt door de moleculaire structuur van het oplosmiddel en het vet.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 ml water – 20 ml ethanol – 5 g vet
- Thema: organische stoffen – alcohol
- Tijd: 20 min
- Begrippen: oplosbaarheid – ethanol
1.1.23. Ethanol en water op de huid
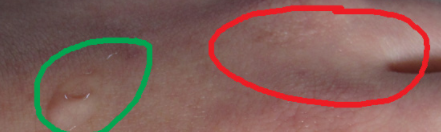
- Info: Waarom zit er in veel parfums alcohol (bijv. Ethanol)? Ethanol verdeelt zich gelijkmatig over de huid. Er vormt zich geen druppel. Het water vormt een druppel op de huid die niet wegloopt.
Als je eroverheen blaast, voelt de huid koel aan onder de ethanolfilm. - Moeilijkheid: eenvoudig
- Chemische stoffen: 1 druppel ethanol – water
- Thema: organische stoffen – alcohol – stofeigenschappen
- Tijd: 10 min
- Begrippen: oplosbaarheid – ethanol – verdamping
1.1.24. Zuurstof aantonen in ethanol

- Info: Hoe kun je bewijzen dat het ethanolmolecuul zuurstofatomen bevat? Als het zand wordt verwarmd, verspreidt zich stoom in de reageerbuis. Deze stoom kan worden ontstoken aan het uiteinde van het glazen mondstuk. Het zand droogt relatief snel en valt uiteen.
Het magnesium verbrandt heel langzaam na verhitting met de gasbrander, het wordt wit. - Moeilijkheid: eenvoudig
- Chemische stoffen: 5 ml ethanol – 2 g magnesium – 5 g zand
- Thema: organische stoffen – alcohol
- Tijd: 20 min
- Begrippen: ethanol – identificatie zuurstof
1.1.25. Koolstof aantonen in ethanol

- Info: Hoe kun je de koolstof in ethanol detecteren? De ethanol brandt met een zwakke, gele vlam. Na onderdompeling in de cilinder gaat de vlam uit. De staande cilinder stoomt van binnenuit op. Het kalkwater wordt geleidelijk troebel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 ml ethanol – 10 ml kalkwater
- Thema: organische stoffen – alcohol
- Tijd: 20 min
- Begrippen: ethanol – identificatie koolstof
1.1.26. Ethanolgehalte van wijn

- Info: Hoe bepaal je de hoeveelheid ethanol in (zelfgemaakte) wijn? De alcoholmeter wordt door de loden pellets in het onderste gedeelte zo gekalibreerd dat deze in het water zakt totdat het display 0 vol.% Aangeeft. Dit komt door de dichtheid van het water. Alcohol heeft een lagere dichtheid dan water . Hierdoor zinkt de alcoholmeter dieper dan bij water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Alcoholmeter – 100 ml wijn
- Thema: organische stoffen – alcohol -chemisch rekenen
- Tijd: 20 min
- Begrippen: ethanol – dosering alcohol – concentratie
1.1.27. Ethanolgehalte van wijn: indirect

- Info: Hoe bepaal je de hoeveelheid ethanol in (zelfgemaakte) wijn?De wijn bevat alcohol ( ethanol ), die verdampt bij circa 78 ° C. De ethanol condenseert op de koude erlenmeyer en glazen buis . Omdat ook water verdampt, bereikt de ethanol als eerste de opening van de glazen buis. Daar kan het worden ontstoken totdat het is opgebruikt. Dan stroomt er voornamelijk waterdamp uit.
Dit experiment toont alleen een brandbare, kleurloze vloeistof die verdampt in plaats van water en waarvan de dam kan worden ontstoken. Maar het is geen bewijs dat er ethanol in wijn zit . - Moeilijkheid: eenvoudig
- Chemische stoffen: 50 ml wijn
- Thema: organische stoffen – alcohol -chemisch rekenen
- Tijd: 20 min
- Begrippen: ethanol – dosering alcohol – concentratie
1.1.28. Jodoformtest op ethanol
- Info: Hoe reageren alcoholen met lugol? Ethanol wordt door dijood geoxideerd tot ethanal. Ethanal reageert verder en er vormt zich een lichtgele neerslag van trijoodmethaan met een typische kleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanol – lugoloplossing – NaOH 0,1 mol/l
- Thema: organische stoffen – alcohol
- Tijd: 15 min
- Begrippen: ethanol – dosering alcohol – concentratie
1.1.29. Nucleofiele substitutie van bromide-ionen op ethanol

- Info: Hoe gebeurt de subsititutiereactie tussen bromide-ionen en ethanol? Het reactieproduct is onoplosbaar in water en kan van het water worden afgescheiden. De groenkleuring van de vlam toont aan dat men met een gehalogeneerd product te doen heeft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanol – gec zwavelzuur – KBr
- Thema: organische stoffen – alcohol
- Tijd: 15 min
- Begrippen: ethanol – reacties in organische chemie
1.1.30. De ethanolballon

- Info: Hoe kan je via een ballon opblazen met ethanol? Ethanol heeft een kookpunt van 78,29°C. Door het water te verwarmen, begint de ethanol op dit punt te verdampen. Het verandert van de vloeibare naar de gasvormige toestand, waardoor de afstand tussen de afzonderlijke deeltjes groter wordt en het volume toeneemt. De ballon wordt opgeblazen. Na het uit het water halen van de ballon vindt het omgekeerde proces plaats. Ethanol condenseert en keert terug naar zijn vloeibare toestand.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol, Water
- Thema: organische stoffen – alcohol – stofeigenschappen
- Tijd: 15 min
- Begrippen: ethanol – invloed dichtheid
1.1.31. Alcohol verwarmen in een waterbad

- Info: Hoe verloopt het temperatuur-tijdsverloop bij het opwarmen van ethanol? Door verhitting wordt de ethanol aan de kook gebracht. De verhoudingen ethanol met een temperatuur van 76,5 °C worden ethanoldamp. De ethanoldamp stijgt op. De ethanolcomponenten blijven bij een lagere temperatuur in de vloeistof. Hierdoor blijft de temperatuur van de ethanol over een langere periode constant. Water kookt pas bij een temperatuur van 100 °C. Daarom is kokend water heter dan kokende ethanol. Elke stof heeft dus zijn eigen kooktemperatuur. De kooktemperatuur is een eigenschap van een stof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol, Water
- Thema: organische stoffen – alcohol – stofeigenschappen
- Tijd: 20 min
- Begrippen: ethanol – invloed dichtheid
1.2. Methanol
1.2.1.Aantonen van methanol in dranken

- Info: In de KMnO4 oplossing wordt methanol geoxideerd tot formaldehyde. Formaldehyde reageert met de Schiff’s base tot een paarse kleur. Deze methanol is terug te vinden in brandewijnen, niet in graanjenever.Een overmaat KMnO4 wordt toegevoegd om methanol te oxideren. De oxaalzuuroplossing reduceert deze overmaat nadien.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Schiff’s reagens:Fuchsine-oplossing (Schiff’s reagens):0,1 g fuchsine opgelost in 300 ml water, verzadigen met SO2 (Na2SO3, HCl) tot de oplossing ontkleurt. Een mespunt salicylzuur maakt de oplossing langer houdbaar – SO2 bron: 1 g Natriumsulfiet toevoegen en oplossen.Nadien 5 ml geconcentreerd HCl toevoegen. – Methanol – Ethanol – KMnO4 – H3PO4 – Oxaalzuur – Zwavelzuur
- Thema: organische stoffen – alcohol – redoxreactie
- Tijd: 20 min
- Begrippen: methanol -oxidans
1.2.2. Groene vlammen op ijs

- Info:Hoe komt het dat wanneer we het ijs in brand steken we een groene kleur krijgen ? De methanol of ethanol brandt met een doorzichtige vlam. Een groene vlam kan verkregen worden door boorzuur toe te voegen.
Het lijkt alsof ijsblokjes branden. - Moeilijkheid: eenvoudig
- Chemische stoffen: ijsblokjes – methanol of ethanol – boorzuur
- Thema: organische stoffen – bouw van atomen
- Tijd: 20 min
- Begrippen: methanol – vlamproef
1.2.3. Maken van een aanmaakblokje

- Info:Hoe maak je een aanmaakblokje? Voor dit aanmaakblokje te maken hebben we geen petroleum gebruikt maar ethanol als brandstof. De ethanol en calciumacetaat vormen een gel. Een gel is een verschijningsvorm die de materie in het midden houdt tussen een vaste stof en een vloeistof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumacetaat – Ethanol – Water
- Thema: organische stoffen – bouw van atomen
- Tijd: 20 min
- Begrippen: methanol – vlamproef
1.2.4. Oscillatie aan koper

- Info: Wat gebeurt er met een verhitte koperdraad in de buurt van methanol? Er ontstaat een wisselwerking van gloei en vlammen en dit gedurende dertig minuten.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Methanol – Aluminiumplaat – Koperdraad
- Thema: enkelvoudige stoffen – chemisch evenwicht – organische stoffen – alcoholen
- Tijd: 20 min
- Begrippen: methanol – oscillerende reactie
1.2.5. Reactie tussen koper en methanol

- Info: Wat zal er gebeuren als we verhit koper in methanol onderdompelen? Het roodbruine koper wordt bij verhitting zwart. In de methanol verdwijnt de zwarte kleur weer. Bovendien is er gasontwikkeling waarneembaar.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Dun stukje koper – Methanol
- Thema: enkelvoudige stoffen – chemisch evenwicht – organische stoffen
- Tijd: 20 min
- Begrippen: methanol – oscillerende reactie
1.2.6. De verbranding van methanol

- Info: Wat gebeurt er wanneer we verhit koper in methanol onderdompelen? We verwarmden koper en het koper werd zwart, er ontstond namelijk koperoxide. Dit komt door de verbrandingsreactie. Daarna voegde we een alcohol toe, namelijk methanol. We bekwamen opnieuw koper. De overige stoffen waren water en methanal. Methanal is waar te nemen door de aparte geur.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Dun stukje koper – Methanol
- Thema: enkelvoudige stoffen – organische stoffen
- Tijd: 20 min
- Begrippen: methanol – verbrandingsreactie
1.2.7. Methanolvlam met borax

- Info: Hoe kun je het verschil zien tussen ethanol en methanol? Het methanol – dinatriumtetraboraat ( borax ) mengsel brandt met een groene vlam, het ethanol – dinatriumtetraboraat ( borax ) mengsel met een geelblauwe vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 ml methanol – 5 ml ethanol – 2 spatelpunten borax
- Thema: enkelvoudige stoffen – organische stoffen
- Tijd: 20 min
- Begrippen: methanol – verbrandingsreactie
1.3. Andere alcoholen
1.3.1. Amoebe met kristalviolet en heptanol

- Info: Hoe kun je het verschil zien tussen ethanol en methanol? Het methanol – dinatriumtetraboraat ( borax ) mengsel brandt met een groene vlam, het ethanol – dinatriumtetraboraat ( borax ) mengsel met een geelblauwe vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumdichromaat – Zwavelzuur – Cyclohexanol
- Thema: enkelvoudige stoffen – organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: cyclohexanol
1.3.2. Biologisch plastic

- Info: Hoe maak je een biologisch afbreekbare plastic van aardappelen? Wanneer het water met daarin de zetmeelkorrels wordt verwarmt, nemen de amylose moleculen meer water op. Hierdoor zwellen de zetmeelkorrels en breken de onderling gevormde waterstofbruggen, naarmate de suspensie opzwelt en stroperiger wordt nemen ook de amylpectine moleculen water op. Hierdoor verliest de zetmeelkorrel zijn structuur en stevigheid en wordt er een maximale viscositeit bereikt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aardappelen – glycerol
- Thema: enkelvoudige stoffen – organische stoffen – kunststoffen
- Tijd: 20 min
- Begrippen: glycerol – bioplastics
1.3.3. Chemische amoebe in een petrischaal

- Info: Wat zal er gebeuren als men cyclohexanol toevoegt aan een oplossing van kaliumdichromaat en zwavelzuur?De pulserende veranderingen van grootte en vorm van de deeltjes ontstaat door de gedeeltelijke oxidatie van cyclohexanol door het kaliumdichromaat in zuur milieu tot cyclohexanon. De druppels veranderen in vorm door de verandering van oppervlaktespanning door wisselende verhouding van cyclohexanol en cyclohexanon.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Kaliumdichromaat – Zwavelzuur – Cyclohexanol
- Thema: stofeigenschappen – organische stoffen
- Tijd: 15 min
- Begrippen: osmose – diffusie – redoxreactie – microschaal – pulserende werking
1.3.4. Hygroscopische werking van glycerol

- Info: Wat zal er gebeuren als we glycerol een paar dagen laten staan? Glycerol is hygroscopisch. D.w.z. dat glycerol uit de lucht waterdamp aantrekt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Glycerine
- Thema: stofeigenschappen – organische stoffen
- Tijd: 15 min
- Begrippen: glycerol – hygroscopische werking
1.3.5. Kleuren na elkaar

- Info: Hoe laten we een stof meermaals van kleur veranderen? Terwijl fenol reageert met NaN02 en geconcentreerd H2S04, verschaft het een diep groene of blauwe kleur die bij verdunnen met water in rood verandert. terwijl de gegenereerde alkaline samen met de oorspronkelijke groene of blauwe NaOH-kleur wordt hersteld. Deze reactie wordt aangeduid als Liebermann’s nitrosoreactie en wordt gebruikt als een test voor fenol.
- Moeilijkheid: eenvoudig
- Chemische stoffen: geconcentreerd zwavelzuur – natriumnitriet – fenol
- Thema: stofeigenschappen – organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: fenol – organische reacties
1.3.6. Kleurige amoebe in een petrischaal
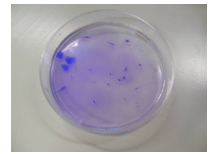
- Info: Wat gebeurt er met cyclohexanol wanneer we het op water laten vallen? We zien de druppel zichzelf delen en ‘rondspringen’ op het water. Vanwege de polariteit blijft het cyclohexanol op het wateroppervlak zonder op te lossen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cyclohexanol – Kristalviolet – water
- Thema: stofeigenschappen – organische stoffen – eigenschappen stoffen
- Tijd: 15 min
- Begrippen: organische reacties – polariteit
1.3.7. Kleurige amoebe met heptaan-1-ol
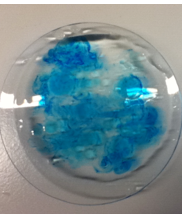
- Info: Leg onder een overhead een petrischaal die half gevuld is met water en projecteer. Los nu in 20 ml 1-heptanol wat kristalviolet op. Met een pipet wordt nu een druppel van het kristalviolet-heptanol mengsel gebracht. De druppel verdeelt zich over de waterige oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen:heptaan-1-ol – kristalviolet
- Thema: stofeigenschappen – organische stoffen – eigenschappen stoffen
- Tijd: 15 min
- Begrippen: organische reacties – polariteit
1.3.8. Meerwaardige alcoholen

- Info: Hoe gaan de verschillende meerwaardige alcoholen reageren op dezelfde stoffen? Ieder van de stoffen heeft op een andere manier met het kopersulfaat en natriumhydroxide gereageerd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol – glycol – propanol – glycerol – CuSO4 (1%) – NaOH (0.5M)
- Thema: redoxreacties – organische stoffen –
- Tijd: 15 min
- Begrippen: organische reacties – organische reacties
1.3.9. Onderscheid tussen ethanol en methanol aantonen

- Info: Hoe gaan ethanol en methanol zich gedragen bij behandeling met een basische stof? Methanol reageert niet met de andere stoffen. Ethanol daarentegen wel. De oplossing wordt daardoor geleidelijk aan geel en er wordt een gele neerslag (jodoform) gevormd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Methanol – Ethanol – NaOH 1M – Oplossing van I2 (0.5M) en KI (0.2M)
- Thema: redoxreacties – organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – organische reacties
1.3.10. Onderscheid tussen ethanol en methanol aantonen methode 2
- Info: Hoe gaan ethanol en methanol zich gedragen bij behandeling met een basische stof?Na een korte tijd ontstaat troebel in ethanol, niet in methanol. Na een paar minuten vormt zich een gele neerslag welke een ontsmettende geur heeft. Het ethanol ondergaat een oxydatie tot keton.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Methanol – Ethanol – NaOH 1M – Oplossing van I2 (0.5M) en KI (0.2M)
- Thema: redoxreacties – organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties
1.3.11. Werking van antivries

- Info: Voeg je glycol en/of glycerol toe bij water zodat het niet bevriest? Door toevoeging van natriumchloride aan het ijs, daalt de temperatuur.Zowel glycol als glycerol lost goed op in water. Ze werken vriespuntverlagend. Ze worden toegevoegd aan water om schadelijke uitzetting te voorkomen als het water bevriest.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ijs – NaCl – Glycol & glycerol
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – oploswarmte – vriespuntsverlagende werking
1.3.12. De oxidatie van alcoholen

- Info: Wat zal er gebeuren als we een mengsel van ethanol , kaliumdichromaat en zwavelzuur enkele minuten laten staan? Als het kaliumdichromaat in aanraking komt met ethanol (propaan-1-ol in dit geval) ontstaat het groene chroom(III)sulfaat. Op deze manier kan ethanol (propaan-1-ol) worden aangetoond.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kaliumdichromaat, – kaliumpermanganaat, – geconcentreerd zwavelzuur, – gedemineraliseerd water – ethanol,
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: organische reacties -oxidatie
1.3.13. Propaan-1-ol en kaliumdichromaat

- Info: Wat zal er gebeuren als we een mengsel van propan-1-ol, kaliumdichromaat en zwavelzuur enkele minuten laten staan? De oranje kleur van het mengsel verandert in blauwgroen. Er is een aparte geur waarneembaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Propan-1-ol – K2Cr2O7 (0,1mol/l) – H2SO4 (4 mol/l)
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: organische reacties – oxidatie
1.3.14. Zuur-base gedrag van alcoholen
- Info: Zorgt de OH-groep van een alcohol voor basische eigenschappen? Ga met de indicator de zuurtegraad na van zowel NaOH als de alcohol
- Moeilijkheid: eenvoudig
- Chemische stoffen:NaOH 1mol/l – methanol – indicator
- Thema: organische stoffen – zuurtegraad
- Tijd: 20 min
- Begrippen: organische reacties
1.3.15. Zuur-basegedrag van alcoholen

- Info: Hoe reageren alcoholen in zuur of basisch milieu? De oplossingen met alcoholen verkleuren niet met fft .Alcoholen vertonen geen basisch karakter
- Moeilijkheid: eenvoudig
- Chemische stoffen:NaOH 1mol/l – methanol -fft – ethanol
- Thema: organische stoffen – zuurtegraad
- Tijd: 20 min
- Begrippen: organische reacties
1.3.16. Vorming van alcoholaten
- Info: Hoe kun je alcoholaten bereiden? Ethanol reageert met Na als een zuur. De ethanolmoleculen treden op als protonendonor en vormen ethanolaationen: rooskleuring met fft wijst op het basisch karakter.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Na – fft – ethanol
- Thema: organische stoffen – zuurtegraad
- Tijd: 20 min
- Begrippen: organische reacties
1.3.17. Butaan-1-ol in water

- Info: Hoe reageert butaan-1-ol in water? Butaan-1-ol heeft een polaire kop en een apolaire staart.
Er treedt een spel op tussen polaire/apolaire moleculen in een polair midden: bolletjes die tegen elkaar botsen zonder in elkaar over te gaan (Brownse beweging) - Moeilijkheid: eenvoudig
- Chemische stoffen:methyleenblauw – butaan-1-ol
- Thema: organische stoffen – zuurtegraad
- Tijd: 20 min
- Begrippen: organische reacties
1.3.18. Verbrandingsgassen van alcoholen

- Info: Welke reactieproducten ontstaan bij de verbranding van een alcohol? Door de waterdamp bewasemen de wanden van de erlenmeyer. CO2 maakt kalkwater troebel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanol – methanol – kalkwater
- Thema: organische stoffen -redoxreactie
- Tijd: 20 min
- Begrippen: organische reacties – verbrandingsreactie
1.3.19. Dehydrogenatie van alcoholen

- Info: Hoe kun je water onttrekken van een alcohol? Door de oxidatie van ethanol wordt ethanal gevormd. Violetkleuring wijst op de vorming van een aldehyde. We herkennen de typische geur van ethanal: rijpe appelsDe koperdraad wordt terug roodbruin (koper)Secundaire alcoholen vormen ketonen, tertiaire alcoholen reageren niet.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanol – schiffsreagens – koper
- Thema: organische stoffen -redoxreactie
- Tijd: 20 min
- Begrippen: organische reacties – verbrandingsreactie
1.3.20. Dehydrogenatie van alcoholen2

- Info: Hoe kun je water onttrekken van een alcohol? Wanneer er voldoende methanoldamp is, gloeit de koperspiraal door, terwijl de methanol aan het koperoppervlak tot methanal wordt geoxideerd. Gedurende de reactie wordt de inhoud van de erlenmeyer warmer. Er ontwijkt methanal en langs de andere kant van het blik wordt lucht aangezogen. Er treden explosies op van het mengsel van methanol en lucht. Aan de rand van de erlenmeyer ziet men soms een vlammetje dat al na enkele seconden verdwijnt. Nu begint de oxidatie van methanol opnieuw bij de koperspiraal en zo gaat het geruime tijd door.
- Moeilijkheid: eenvoudig
- Chemische stoffen:methanol – staal – koper
- Thema: organische stoffen -redoxreactie
- Tijd: 15 min
- Begrippen: organische reacties – verbrandingsreactie
1.3.21. Zachte oxidatie van alcoholen

- Info: Hoe kun je alcoholen oxideren?
- Moeilijkheid: eenvoudig
- Chemische stoffen:methanol – ethanol – kaliumdichromaat – kaliumpermanganaat – t-butanol – propaan-2-ol
- Thema: organische stoffen -redoxreactie
- Tijd: 15 min
- Begrippen: organische reacties – oxidatie
1.3.22. Zelfontbranding van glycerine met kaliumpermanganaat

- Info: Hoe reageert glycerine met kaliumpermanganaat? Na enig tijd (afhankelijk van de fijnheid van het poeder) zal het glycerine tot ontbranding komen.
- Moeilijkheid: eenvoudig
- Chemische stoffen:glycerine- kaliumpermanganaat
- Thema: organische stoffen -redoxreactie
- Tijd: 15 min
- Begrippen: organische reacties – oxidatie
1.3.23. Oxidatie van alcoholen

- Info: Hoe kun je alcoholen oxideren? Na korte tijd merk je lichtflitsen en kleine explosies.
Verdere toevoeging van kristallen kan de reactie opnieuw opstarten - Moeilijkheid: eenvoudig
- Chemische stoffen: methanol – gec zwavelzuur- kaliumpermanganaat
- Thema: organische stoffen -redoxreactie
- Tijd: 25 min
- Begrippen: organische reacties – oxidatie
1.3.24. Nucleofiele substitutie van chloride ionen op 2-broompropaan-2-ol

- Info: Hoe gebeurt de subsititutiereactie tussen chloride-ionen en 2-methylpropaan-2-ol? Bij de vorming van 2-chloor-2-methylpropaan zal de oplossing zich ontmengen: het gevormde product is niet oplosbaar in de waterfase.Aan de verdamping bij het overgieten kan men merken dat men met een vluchtiger product dan met het 2-methylpropaan-2-ol te doen heeft.De groenkleuring met de Beilsteintest toont aan dat men in tegenstelling met 2-methylpropaan-2-ol met een gehalogeneerd product te doen heeft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2-methylpropaan-2-ol – gec zoutzuur – koperdraad
- Thema: organische stoffen
- Tijd: 25 min
- Begrippen: organische reacties – nucleofiele substitutie
2. Aldehyden

- Info:In een basisch milieu reageert fructose tot glucose De reactie met de basische zilveroplossing vormt een zilverspiegel
- Moeilijkheid: eenvoudig
- Chemische stoffen: honing – wijnsteenzuur – ethanol 96% – zilvernitraat – ammoniumnitraat – NaOH – water
- Thema: organische stoffen
- Tijd: 25 min
- Begrippen: organische reacties – aldehyden – identificatiereactie
2.2. De Fehling’sreactie met glucose

- Info: Hoe kunnen we de aanwezigheid van suiker aantonen m.b.v. een Fehlingsreactie? Een Fehlingsreactie wordt gebruikt om een aldehyde aan te tonen. Glucose bevat ook de aldehyde groep HC=O-Men gebruikt in deze proef een Fehlings reagens om suikers zoals glucose aan te tonen. Indien deze aanwezig is ontstaat een rood-oranje neerslag afkomstig van het kopersulfaat dat gereduceerd werd door tot koper(I)oxide.
- Moeilijkheid: eenvoudig
- Chemische stoffen:glucose-oplossing (1m/V%), )- kopersulfaat-oplossing (0,2mol/l) – natronloog (4mol/l).
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – identificatiereactie
2.3. Zilverspiegel

- Info: Hoe kunnen we een zilverspiegel maken? Glucose reduceert hierbij het zilverdiamine complex tot metallisch zilver en wordt zelf geoxideerd tot gluconzuur. Omdat de reactie in alkalisch milieu plaatsvindt zal het gevormde gluconzuur deprotoneren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KOH-oplossing (0,8 mol/l) – Zilvernitraatoplossing 0,1mol/l – Geconcentreerde ammoniakoplossing 35% -glucose
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – identificatiereactie
2.4. Nucleofiele additie op benzaldehyde

- Info: Hoe gebeurt een additiereactie op benzaldehyde? De witte neerslag is het additieproduct van de carbonylverbinding, benzaldehyde, met het nucleofiel reagens NaHSO3.Wanneer zuur toegevoegd wordt aan de neerslag komt het nucleofiele deeltje terug vrij en lost de neerslag op.
- Moeilijkheid: eenvoudig
- Chemische stoffen: benzaldehyde – gec wavelzuur – natriumwaterstofsulfiet
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – nucleofiele additie

- Info: Hoe kun je butanal bereiden? Butaan-1-ol wordt in zuur milieu geoxideerd tot aceton. Het oxidatiemiddel is K2Cr2O7 dat zelf gereduceerd wordt tot het groene Cr3+ . . Door oxidatie van butaan-1-ol met kaliumdichromaat ontstaat ook het overeenkomstig zuur, butaanzuur. Daarom wordt na droging met magnesiumsulfaat, het butanal gescheiden van het butaanzuur door destillatie
- Moeilijkheid: eenvoudig
- Chemische stoffen: butaan-1-ol – kaliumdichromaat – gec zwavelzuur – ijs
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – oxidatie
2.6. Nucleofiele additie op aldehyden en ketonen

- Info: Hoe kun je de nucleofiele additie op aldehyden of ketonen aantonen? De witte neerslag is het additieproduct van de carbonylverbinding, propanon, met het nucleofiel reagens NaHSO3.Wanneer zuur toegevoegd wordt aan de neerslag komt het nucleofiele deeltje terug vrij en lost de neerslag op.
- Moeilijkheid: eenvoudig
- Chemische stoffen:propanon – benzaldehyde – gec HCl – NaHSO3
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – nucleofiele additie
2.7. Aldolcondensatie

- Info: Hoe kun je de aldolcondensatie aantonen? Er heeft een hevige reactie plaats waarbij een roodbruin hars ontstaat. Men kan ook hier een sterke geur waarnemen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanal – ijs – NaOH 4 mol/l
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – condensatiereactie

- Info: Hoe kun je ketens maken met ethanal? De polymerisatie van aldehyden kan opgevat worden als een veelvuldig herhaalde nucleofiele additie tussen de mononmeerdeeltjes.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethanal -gec zwavelzuur
- Thema: organische stoffen – kunststoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – polymerisatie
2.9. Polymerisatie van methanal

- Info: Hoe kun je een polymeer uit methanal bereiden? Er ontstaat een witte vaste stof bij verhitten: polymethanal (ook als bezinksel in een methanaloplossing)
- Moeilijkheid: eenvoudig
- Chemische stoffen:formol
- Thema: organische stoffen – kunststoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – polymerisatie
2.10. De Schiff reactie

- Info: Hoe kun je aldehyden/ketonen aantonen? Door het verdwijnen van H2SO3 zal de violette kleur van het fuchsine terug optreden.Aldehyden reageren positief. Glucose en ketonen reageren niet met Schiff reagens
- Moeilijkheid: eenvoudig
- Chemische stoffen: schiffs reagens – enkele aldehyden
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – identificatie
2.11. De Tollenstest

- Info: Hoe kun je aldehyden aantonen? De test is positief indien er zich een zilverspiegel afzet. Alleen aldehyden reageren positief.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zilvernitraat – natriumhydroxide – ammoniak – enkele aldehyden
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – identificatie
2.12. Fehlingtest: droge stof

- Info: Hoe kun je aldehyden aantonen? De oploswarmte is voldoende om de oxidatie van aldehyden op gang te brengen. Ketonen reageren niet. De groene kleur wijst op een onvolledige oxidatie
- Moeilijkheid: eenvoudig
- Chemische stoffen: kopersulfaat – natriumhydroxide – enkele aldehyden
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – identificatie
2.13. Fehlingtest

- Info: Hoe kun je aldehyden aantonen? Aldehyden worden geoxideerd. Er wordt een roodbruine neerslag van Cu2O gevormd. Ketonen geven een negatieve reactie.Overgang van de blauwe oplossing in een groene oplossing wijst er op dat niet alle koperionen gereduceerd zijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fehling A – Fehling B – enkele aldehyden
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – aldehyden – identificatie
3. Algemeen
3.1. Aantonen van optische activiteit met fructose

- Info: Hoe kan je aantonen dat er een optische activiteit plaatsvindt bij een suikeroplossing?
- Moeilijkheid: eenvoudig
- Chemische stoffen:overhead – D-fructose
- Thema: organische stoffen – biochemie
- Tijd: 10 min
- Begrippen: organische reacties – optische activiteit – identificatie
3.2. Inductief effect van alkaanzuren

- Info: Welke carbonzuur ( methaanzuur, ethaanzuur of propaanzuur) heeft de sterkste zure eigenschappen? Het ene zuur is sterker dan het andere omdat er een verschil is in de splitsingsgraad van water. Hoe hoger de splitsingsgraad, hoe sterker het zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 stukjes Mg-lint van 3 bij 3 mm – Pipetflesje met 1 mol/liter methaanzuur – Pipetflesje met 1 mol/liter ethaanzuur – Pipetflesje met 1 mol/liter propaanzuur
- Thema: organische stoffen
- Tijd: 10 min
- Begrippen: organische reacties – inductief effect – carbonzuren
3.3. Verschil in zuursterkte van organische zuren

- Info: Welke stof reageert het snelst met Mg-lint? Naarmate de koolstofketen langer wordt daalt de zuursterkte. Dit is te verklaren door het toenemende +I-effect van de koolstofketen, waardoor het koolstofatoom van de carboxylgroep minder positief wordt
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mg-lint – Mierenzuur – Geconcentreerd azijnzuur – Propaanzuur
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – inductief effect – carbonzuren
3.4. Identificatie van organische stoffen op basis van fysische eigenschappen
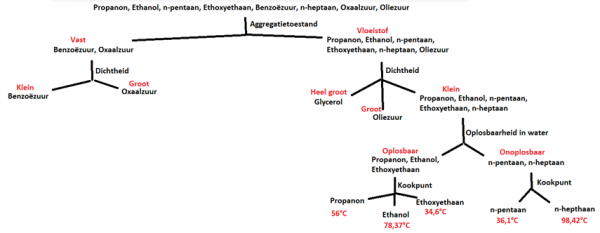
- Info: Hoe kunnen propanon, ethanol, n-pentaan, ethoxyethaan, benzoëzuur, n-heptaan, propaan-2-ol, oxaalzuur, glycerol en oliezuur van elkaar gescheiden worden op basis van fysische kenmerken? Deze methode is een handige methode om de 9 stoffen van elkaar te kunnen onderscheiden.
- Moeilijkheid: eenvoudig
- Chemische stoffen:
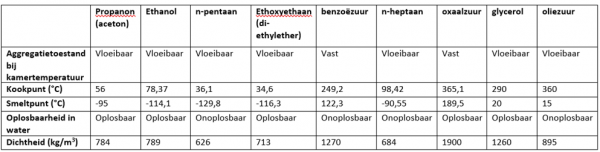
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties -identificatiereacties – fysische eigenschappen
4. Amine
4.1. Extractie van cafeïne uit koffie

- Info: Hoe verkrijg je cafeïne uit koffie? Door de paarse kleur kunnen we aanduiden dat er cafeïne in koffie zit. De cafeïne lost op in het oplosmiddel (dichloormethaan) en de rest niet. Zo verkrijgen we in het begin de twee lagen. De dichloormethaan zal verdampen waardoor er enkel nog cafeïne overblijft.
- Moeilijkheid: gemiddeld
- Chemische stoffen: cafeïne houdende stof (koffie) – natriumcarbonaat – dichloormethaan – magnesiumsulfaat – geconc HCl – Kaliumchloraat – NH4OH 2 mol/l
- Thema: organische stoffen – stofeigenschappen
- Tijd: 30 min
- Begrippen: organische reacties – extractie – identificatie – aminen
4.2. Zuur-basegedrag van aminen
- Info: Hoe reageren aminen in zuur of basisch milieu? Het vrije elektronenpaar op het N-atoom is verantwoordelijk voor het basisch gedrag van aminen. De aminen zijn typische organische basen. Ze vormen de tegenpolen van de carbonzuren.
- Moeilijkheid: gemiddeld
- Chemische stoffen: methylamine – diethylamine – ammoniak – fenolftaleïne – zoutzuur
- Thema: organische stoffen – neutralisatiereactie
- Tijd: 20 min
- Begrippen: organische reacties – aminen – zuur-base gedrag
5. Carbonzuren
5.1. Algemeen
5.1.1. Geheime boodschap met citroensap

- Info: Citroensap geeft een rode verkleuring van het rodekoolsap en daardoor zichtbaar.Een alternatief is de verhitting waarbij een thermolyse van het citroenzuur optreedt met vorming van koolstof
- Moeilijkheid: eenvoudig
- Chemische stoffen: rodekoolsap -) plantenspuit – citroensap
- Thema: organische stoffen – carbonzuren – biochemie
- Tijd: 20 min
- Begrippen: organische reacties – identificatie – zuur-base gedrag
5.1.2. Inductief effect met alkaanzuren

- Info: Welke carbonzuur ( methaanzuur, ethaanzuur of propaanzuur) heeft de sterkste zure eigenschappen? Het ene zuur is sterker dan het andere omdat er een verschil is in de splitsingsgraad van water. Hoe hoger de splitsingsgraad, hoe sterker het zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 stukjes Mg-lint van 3 bij 3 mm – Pipetflesje met 1 mol/liter methaanzuur – Pipetflesje met 1 mol/liter ethaanzuur – Pipetflesje met 1 mol/liter propaanzuur
- Thema: organische stoffen
- Tijd: 10 min
- Begrippen: organische reacties – inductief effect – carbonzuren
5.1.3. Zijn alle zuren even sterk?

- Info: Hoe kunnen we een verschil in zuursterkte tussen 2 verschillende zuren aantonen? We kunnen een verschil in zuursterkte aantonen door de zuren te laten reageren met eenzelfde base. Bij het sterkste zuur, in dit geval HCl, zal de reactie sneller verlopen (sneller opblazen van de ballon).
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,8 g bakpoeder (NaHCO3) (2 * 0,4 g) – 8 ml Azijnzuuroplossing (1 mol/l) – 8 ml HCl-oplossing (1 mol/l)
- Thema: organische stoffen – anorganische stoffen
- Tijd: 30 min
- Begrippen: organische reacties – identificatie – zuursterkte- carbonzuren
5.1.4. Zuren als antioxidans

- Info: Kunnen we het verkleuren van een gesneden appel tegen gaan door het gebruik van zuren? Wanneer we de appel in stukken snijden, reageert een enzym (tyrosinase) in het vruchtvlees met zuurstof waardoor polyfenolen in melanine veranderen (bruine kleur).Door de pH onder de 2 te brengen, wordt het enzym dat het vruchtvlees bruin maakt gedeactiveerd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing 10% – HCl oplossing 0,1 mol/l – Ascorbinezuuroplossing 0,1% – Appel
- Thema: organische stoffen – biochemie
- Tijd: 20 min
- Begrippen: organische reacties – oxidatie
5.1.5. Organische zuren reageren met magnesium

- Info: Wat gebeurt er als organische zuren reageren met magnesium? Onedele metalen reageren heftig met zuren. De reactie produceert een zout en waterstof . Hierdoor komt warmte vrij (exotherme reactie).
De zouten van mierenzuur worden formiaten genoemd, de zouten van azijnzuur worden acetaten genoemd. - Moeilijkheid: eenvoudig
- Chemische stoffen: 20 druppels mierenzuur – 20 druppels azijnzuur – 2 stukjes Mg-lint
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: organische reacties – zuursterkte
5.1.6. Nucleofiele substitutie van een zuurhalogenide tot een carbonzuur

- Info: Hoe kun je een carbonzuur uit een zuurhalogenide bereiden? Er grijpt een hevige exotherme reactie plaats waarbij een zuur ontstaat (HCl). De gevormde Cl– ionen reageren met de Ag+-ionen en vormen een witte neerslag.
Zuurchloriden zijn erg reactief omdat ze zeer goede vluchtgroepen dragen. Ze worden dan ook vaak gebruikt als tussenproducten in syntheses - Moeilijkheid: eenvoudig
- Chemische stoffen: ethaanzuurchloride – zilvernitraat – universele indicator
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: organische reacties – zuur base indicator
5.1.7. Identificatie van carbonzuren met jodaat/jodiden

- Info: Hoe kun je carbonzuren aantonen? Een violette kleur in de organische laag duidt op de aanwezigheid van een zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kaliumjodide – kaliumjodaat – white spirit
- Thema: organische stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: organische reacties – identificatie
5.1.8. Identificatie van carbonzuren met waterstofcarbonaattest

- Info: Hoe kun je carbonzuren aantonen? Opbruisen (CO2 vorming) wijst op een positieve test.
- Moeilijkheid: eenvoudig
- Chemische stoffen: verzadigde natriumwatestofcarbonaatoplossing
- Thema: organische stoffen – gasvormingsreactie
- Tijd: 10 min
- Begrippen: organische reacties – identificatie
5.2. Azijnzuur
5.2.1. Bereiding van wijnazijn uit wijn

- Info: Hoe kan je wijnazijn bereiden uit wijn?
- Moeilijkheid: eenvoudig
- Chemische stoffen:100 ml witte wijn
- Thema: organische stoffen – biochemie
- Tijd: 30 min
- Begrippen: organische reacties – vergisting
5.2.2. Bufferende werking in een petrischaaltje aantonen

- Info: Hoe werkt een buffer? Een buffer is een mengsel van een zwak zuur en zijn geconjugeerde base. Deze vertraagt de ph-verandering.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bufferoplossing (1.0 mol/l CH3COOH, 1.0 mol/l CH3COONa) – 0.1 mol/l HCl – Methyl Orange – 0.1 mol/l NaOH – Fenolftaleine
- Thema: organische stoffen – neutralisatiereactie
- Tijd: 30 min
- Begrippen: organische reacties – bufferwerking
5.2.3. Dansende rozijnen

- Info: Soda in contact met tafelazijn geeft koolstofdioxide. De rozijnen worden door dit gas naar boven geduwd in de oplossing. Bovenaan verdeelt het gas zich in de lucht. De rozijnen vallen terug in de oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen: half bekertje water – halve eetlepel soda – ¼ bekertje azijn
- Thema: organische stoffen – gasvormingsreactie
- Tijd: 30 min
- Begrippen: organische reacties – oplosbaarheid
5.2.4. Eigenschappen van azijnzuur

- Info: Hoe sterk is azijnzuur? Het zoutzuur reageert met magnesium en geeft waterstofgas af, veel meer dan het azijnzuur.Beide zuren reageren met het kopercarbonaat, maar het zoutzuur weer heviger. De kleuren van het groene koperchloride en het blauwe koperacetaat ontstaan.Het azijnzuur is een zwak zuur en ioniseert beperkt in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 15 ml Azijnzuur 0,05 mol/l – 15 ml HCl 0,05 mol/l – Na2CO3 0,4 mol/l 5 ml – CuCO3 0,5 g
- Thema: organische stoffen – neutralisatiereactie
- Tijd: 30 min
- Begrippen: organische reacties – zuursterkte
5.2.5. Exotherme reactie van azijn en staalwol

- Info: De azijn verwijdert een beschermlaagje op het staal wat belet dat het ijzer in het staal roest. Het roesten is een trage reactie tussen ijzer en zuurstof. Bij dit roesten komt warmte-energie vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: tafelazijn – staalwol
- Thema: organische stoffen – chemische reacties – carbonzuren
- Tijd: 20 min
- Begrippen: organische reacties -exotherme reacties
5.2.6. Haring in azijn
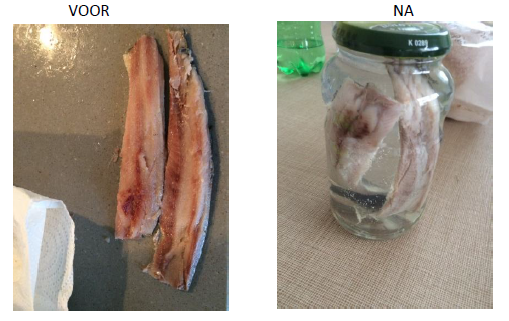
- Info: Hoe kan je een haring bewaren? We leggen de haring op in azijn. Dit is een zuur. We creëren dus een milieu waarin ongewenste micro-organismen geen kans hebben. Een ander effect dat we waarnemen is dat de haring ‘gaart’ door de inwerking van het zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Verse haring – Azijn.
- Thema: organische stoffen -biochemie
- Tijd: 20 min
- Begrippen: organische reacties -carbonzuren – conserveren
5.2.7. Het azijnzuurgehalte bepalen

- Info: Hoeveel is het azijnzuurgehalte van tafelazijn?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fenolftaleïne – NaOH 0,10 mol/l
- Thema: organische stoffen – chemisch rekenen
- Tijd: 30 min
- Begrippen: organische reacties -carbonzuren -titratie
5.2.8. Kristallisatie van azijnzuur

- Info: Waarom noemt men zuivere azijnzuur ook ijsazijn? Tussen 1,5 en 3°C begint het azijnzuur te bevriezen. Indien de kristallisatie start stijgt de temperatuur tot 16°C en blijft constant tot het azijnzuur volledig uitkristalliseert. Nadien daalt de temperatuur terug. Wanneer het proefbuisje uit het ijsbad wordt gehaald, duurt het een hele tijd voor het volledig is gesmolten.Hoewel het smeltpunt ligt bij 16,5°C, start het invriezen pas bij 0-3°C.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Azijnzuur (geconcentreerd) – IJs – Water
- Thema: organische stoffen – stofeigenschappen
- Tijd: 30 min
- Begrippen: fysische eigenschappen -carbonzuren
5.2.9. Melk en huishoudazijn samenvoegen

- Info:Melk bestaat onder andere uit water en een eiwit dat caseïne heet. Alle eiwitten kunnen alleen opgelost zijn in water bij bepaalde zuurgraden. Deze caseïnemoleculen slaan neer wanneer azijn toegevoegd wordt. De zuurgraad waar ze het minst goed oplossen heet het iso-elektrische punt. Normaal gesproken is melk bijna pH-neutraal en lost de caseïne goed op in water. Als je de melk zuurder maakt door er azijn aan toe te voegen, kan de caseïne niet opgelost blijven. Hierdoor verdwijnt de emulgerende werking rond de vetten zodanig dat ook de vetten gaan uitvlokken. De melk gaat schiften in water en losse caseïne. Als je de caseïne laat opdrogen wordt het heel hard. Daarom kun je er leuk beeldjes mee maken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: melk, (liefst volle melk) – proefbuis, – huishoudazijn
- Thema: organische stoffen – neerslagreacties
- Tijd: 30 min
- Begrippen: carbonzuren
5.2.10. Reactie koperoxide en azijnzuur

- Info:Welke kleur krijgt het azijnzuur na reactie met koper? Het koperoxide gaat reageren met het azijnzuur. Het azijnzuur krijgt hierdoor een blauwe kleur omdat er koperacetaat is gevormd. Het koper van de munten reageert met het zuur van de citroen en vormt het kopercitraat. Als de spijker in de oplossing komt, bedekt de stof de spijker met een dun laagje, wat niet is af te wrijven.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd azijnzuur – Koperen plaatje – Koperoxide
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen: carbonzuren – organische reacties
5.2.11. Verbranden van azijnzuur

- Info: Welke kleur vlam heeft azijnzuur bij het verwarmen? Het azijnzuur vormt een blauw gele vlam. Aan de rand van het porseleinen schaaltje ontstaat een beetje condenswater.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd azijnzuur
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: carbonzuren – organische reacties – verbrandingsreactie
5.2.12. Plooi een bot met azijn

- Info: Hoe kunnen we botten plooien, week maken? In een bot zit kalk en collageen. De kalk zorgt voor de hardheid van een bot, het collageen zorgt voor de elasticiteit van een bot. Kalk lost langzaam op in azijn, maar collageen niet. Na een week is een groot deel van de kalk uit het bot opgelost en dus verliest het bot zijn hardheid. Collageen lost niet op in azijn en het bot verliest daardoor niet zijn elasticiteit. Je kunt het bot dat een week in de azijn heeft gezeten buigen, omdat de kalk is opgelost en het overgebleven collageen flexibel is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kippenbot – Azijn
- Thema: organische stoffen – gasontwikkelingsreactie
- Tijd: 25 min
- Begrippen: carbonzuren – organische reacties
5.2.13. Azijnzuur maken

- Info: Wat gebeurt er als ethanol oxideert? Het koper wordt zwart in de brullende vlam en gloeit na verloop van tijd rood op. Zodra de zwarte koperplaat in de ethanol is ondergedompeld, wordt deze koperkleurig. Een deel van de ethanol verdampt. U kunt een ruisend, sissend geluid horen. De geur doet denken aan azijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 ml ethanol – koperplaatje
- Thema: organische stoffen -redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – organische reacties – oxidatie
5.3. Benzoëzuur
5.3.1. Dauw over een plant

- Info: Hoe kunnen we dauw maken op een plant? Het benzoëzuur gaat na verhitting terug sublimeren en zet zich vast op de plant.
- Moeilijkheid: eenvoudig
- Chemische stoffen: plantje aan een draad opgehangen in een fles – 10g benzoëzuur
- Thema: organische stoffen -stofeigenschappen
- Tijd: 15 min
- Begrippen: carbonzuren – sublimatie
5.3.2. Maak het mooiste sneeuwlandschap

- Info: Maak het mooiste sneeuwlandschap met benzoëzuur. Dit experiment steunt op het principe van sublimatie. Bij sublimatie wordt een vaste stof omgezet in een gas, zonder dat er tussendoor eerst een vloeistof wordt gevormd. Bij de techniek ‘sublimatie’, laat men het gas dat hierbij ontstaat onmiddellijk weer condenseren op een koud oppervlak. De stof die op het koude oppervlak condenseert is dan meestal zeer zuiver van samenstelling.
- Moeilijkheid: eenvoudig
- Chemische stoffen: plantje aan een draad opgehangen in een fles – 10g benzoëzuur
- Thema: organische stoffen -stofeigenschappen
- Tijd: 25 min
- Begrippen: carbonzuren – sublimatie
5.3.3. Snelle kristallisatie met benzoëzuur

- Info: Door verdamping van ethanol ontstaat een snelle kristallisatie
- Moeilijkheid: eenvoudig
- Chemische stoffen: absolute ethanol – benzoëzuur
- Thema: organische stoffen -stofeigenschappen
- Tijd: 15 min
- Begrippen: carbonzuren – verdamping
5.3.4. Werking van benzoëzuur als conserveermiddel

- Info: Hoe kan een zuur ervoor zorgen dat een voedingsmiddel lang goed blijft? Benzoëzuur is een sterk conserveermiddel. Zijn werking is mogelijk door de zure eigenschappen. In een neutrale en lichte zure omgeving is het onwerkbaar. Na enkele uren is het kalkwater in het rechterstaal, zonder benzoëzuur, troebel geworden door de reactie van koolstofdioxide met het kalkwater.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Glucose – Gist – Natriumbenzoaat – Kalkwater – Verdund azijnzuur
- Thema: organische stoffen – biochemie
- Tijd: 25 min
- Begrippen: carbonzuren – conserveren
5.3.5. Bereiding van benzoëzuur

- Info:Hoe kun je benzoëzuur bereiden? Het bruine MnO2 wordt afgefiltreerd. In basisch milieu wordt Na-benzoaat gevormd dat goed oplosbaar is. Door toevoegen van het sterke zuur H2SO4 slaat het weinig oplosbare benzoëzuur terug neer onder vorm van een wit poeder.
- Moeilijkheid: eenvoudig
- Chemische stoffen: benzaldehyde – kaliumpermanganaat – natriumcarbonaat – zwavelzuur
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.4. Citroenzuur
5.4.1. Bruisballen maken

- Info: Hoe maak je zelf bruisballen? Het is mogelijk om zelf een bruisbal te maken. Door het gebruiken van een apolaire bindende vloeistof kunnen we de stoffen kneden en in een vorm duwen. En begint de bruisbal pas te bruisen en op te lossen in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumwaterstofcarbonaat – Maïzena – Citroenzuur – Zonnebloemolie – Etherische olie
- Thema: organische stoffen – gasontwikkelingsreactie
- Tijd: 25 min
- Begrippen: carbonzuren
5.4.2. Complexvorming met citroenzuur

- Info: Hoe kunnen we een neerslag vormen met citroenzuur? Door het toevoegen van het citroenzuur verkrijgen we een vertroebeling van de oplossingen. Als we vervolgens de NaOH-oplossing toevoegen gaan we het citroenzuur neutraliseren waardoor de vertroebeling verdwijnt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing 1 mol/l, – kopersulfaatoplossing 0,1 mol/l, – ijzer(III)oplossing 0,1 mol/l, – NaOH oplossing 3 mol/l
- Thema: organische stoffen – neerslagreacties – complexreacties
- Tijd: 25 min
- Begrippen: carbonzuren
5.4.3. Endotherme reactie met zure hosties

- Info: Hoe kun je een endotherme reactie uitvoeren met citroenzuur? Voeg aan citroenzuur bakpoeder toe.
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder wijnsteenzuur – citroenzuur
- Thema: organische stoffen – chemische reactie
- Tijd: 15 min
- Begrippen: carbonzuren – endotherme reactie
5.4.4. Kristallisatie van citroenzuur

- Info: Wat gebeurt er met citroenzuur als we een oplossing hiervan voor lange tijd blootstellen aan de lucht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing van 5-10 %
- Thema: organische stoffen – stofeigenschappen
- Tijd: 15 min
- Begrippen: carbonzuren – kristallisatie
5.4.5. Polyester uit citroenzuur en glycerine

- Info: Hoe kunnen we met behulp van glycerine en citroenzuur polyester maken? Wanneer we de inhoud van de proefbuis een tijdje laten afkoelen (+/- 30 min) zien we dat er zich onderaan in de proefbuis een witte vaste stof heeft gevormd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: glycerine – citroenzuur
- Thema: organische stoffen – kunststoffen
- Tijd: 15 min
- Begrippen: carbonzuren – polycondensatie
5.4.6. Polyester uit citroenzuur en ricinusolie

- Info: Kunnen we met behulp van ricinusolie en citroenzuur polyester maken? Het is mogelijk om uit citroenzuur en ricinusolie polyester te maken
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ricinusolie – citroenzuur
- Thema: organische stoffen – kunststoffen
- Tijd: 25 min
- Begrippen: carbonzuren – polycondensatie
5.4.7. Identificatie citroenzuur

- Info: Hoe kunnen we citroenzuur aanduiden door identificatie van de functionele groepen? Het ceriumreagens wordt kleurloos als we citroenzuur toevoegen en troebel als we citroensap gebruiken. Het BTB wordt geel als we citroenzuur en citroensap gebruiken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cerium(IV)ammoniumnitraat – salpeterzuur 2mol/l – water – citroenzuur – broomthymolblauw – natriumloog – ethanol.
- Thema: organische stoffen
- Tijd: 25 min
- Begrippen: carbonzuren – identificatiereactie
5.4.8. Kristallisatie van citroenzuur2

- Info: Wat gebeurt er met citroenzuur als we het lange tijd blootstellen aan lucht? Het water in de citroenzuuroplossing verdampt. De overgebleven bestanddelen (zuurrest) blijven over en vormen een kristalrooster. Dit nemen we waar als de kleine kristallijnen structuren in het petrischaaltje.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing van 5-10%
- Thema: organische stoffen – stofeigenschappen
- Tijd: 25 min
- Begrippen: carbonzuren – kristallisatie
5.4.9. Conserveren met citroenzuur

- Info: Waarom worden in plakjes gesneden appels niet bruin als je er citroenzuur aan toevoegt? Wanneer de appel wordt gesneden, worden de cellen op het snijvlak vernietigd. Het vruchtvlees wordt bruin.Citroenzuur zorgt voor een zure omgeving. Deze zure omgeving verlamt de enzymatische reacties. Citroensap bevat ook veel vitamine C. En dat reageert met zuurstof in plaats van met de flavonoïden zelf . Zonder bruin te worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Appel – 5 g citroenzuur – 20 ml water
- Thema: organische stoffen – biochemie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.5. Mierenzuur
5.5.1. Mierenzuur als conserveermiddel

- Info: Hoe kan mierenzuur een conserveermiddel zijn? De niet behandelde stalen worden troebel. Met mierenzuur zijn de gemaakte mengsels niet troebel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mierenzuur/ Methaanzuur – Fruitsap – Stukken worst of ham – Gras
- Thema: organische stoffen – biochemie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.5.2. Reactie tussen mierenzuur en geconcentreerd zwavelzuur

- Info: Welk gas ontstaat bij het de ontleding van mierenzuur in een sterk zuur milieu? Bij deze verbranding komt zuiver CO vrij. Dit kan alleen bij de verbranding van mierenzuur gebeuren omdat deze de aldehydefunctie bezit waardoor het geoxideerd kan worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur – Mierenzuur
- Thema: organische stoffen –
- Tijd: 25 min
- Begrippen: organische reacties – carbonzuren
5.5.3. Bereiding van mierenzuur

- Info: Hoe kun je mierenzuur bereiden? Het toegevoegde NaOH zal de esterfunctie hydrolyseren. Zodra alle estermoleculen gehydrolyseerd zijn ontstaat er een overmaat OH- ionen. Dit is te herkennen aan de blauwkleuring van BTB.Door verhitting van het gehydrolyseerde mengsel i.a.w van geconcentreerd zwavelzuur ontstaat mierenzuur, dat door de hoge temperatuur gasvormig is en aan de prikkelende irriterende geur te herkennen is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur – ethylformiaat – broomthymolblauw – natriumhydroxide
- Thema: organische stoffen
- Tijd: 25 min
- Begrippen: organische reacties – carbonzuren – bereiding
5.6. Oliezuur
5.6.1. Sterretjes met oliezuur

- Info:Als de oliezuurlaag precies 1 molecuul dik is, kun je op grond van je metingen de grootte van een oliezuur molecuul berekenen. Door het volume en de oppervlakte te meten van een laagje oliezuur dat op water drijft, kun je een schatting maken van de lengte van een oliezuurmolecuul. Een oliezuurmolecuul is langwerpig, waarbij één kant in het water steekt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: oliezuur – diep bord – zwarte peper/zwavelpoeder
- Thema: organische stoffen – stofeigenschappen
- Tijd: 25 min
- Begrippen: carbonzuren – grootte molecule
5.7. Oxaalzuur
5.7.1. Kinetiekproef met onzichtbare inkt en oxaalzuur

- Info:Wat zou er met de paarse-blauwe inkt kunnen gebeuren als we hiermee op papier schrijven? De paars-blauwe kleur van de KMnO4-oplossing vervaagt en verkleurt naar bruin. Waarna het helemaal verdwijnt na een tijdje.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Verzadigde oxaalzuuroplossing 12g/l in ethanol en verdunningen – 0.090 mol/l KMnO4
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.7.2. Oxaalzuurgehalte in rabarber

- Info:In principe kan de hoeveeheid oxaalzuur in planten worden bepaald door titratie met kaliumpermanganaat. Planten bevatten naast oxaalzuur nog anderz zuren zoals appelzuur en melkzuur en reductoren zoals Fe(II)-ionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rabarber (80g per bepaling) – HCl 1M – ammoniak 25% – CaCl2 oplossing 15 massa% – zwavelzuur 20massa% -KMnO4 0.02M – Universeelindicatorpapier
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.7.3. Permanganaatfontein

- Info:Welke kleur ontstaat er bij het toevoegen van kaliumpermanganaat kristal bij zwavelzuur en oxaalzuur? Permanganaationen worden in zuur milieu door oxaalzuur omgezet in kleurloze Mn(II)-ionen. Hierbij oxideert oxaalzuur tot gasvormig CO2.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumpermanganaat – Verdund zwavelzuur 0,5 mol/l – Oxaalzuur
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.7.4. De reactie tussen kristalsoda en oxaalzuur

- Info: Wat gebeurt er als we kristalsoda en oxaalzuur samenvoegen? Er treedt een endo-energetische reactie op
- Moeilijkheid: eenvoudig
- Chemische stoffen: kristalsoda, – oxaalzuur
- Thema: organische stoffen – chemische reactie
- Tijd: 25 min
- Begrippen: carbonzuren – endo-energetische reactie
5.7.5. Verwijderen van roest met oxaalzuur

- Info: Hoe kun je roest verwijderen uit kledij? Oxaalzuur is een dicarbonzuur. Het oxaalzuur gaat reageren met het water. Het ijzeroxide dat voorkomt in het water gaat omgezet worden tot het trioxaalferraation. Hierdoor gaat het roest verdwijnen op de nagel. Dit kan men ook gebruiken om de roestvlekken uit kledij te verwijderen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Verroeste nagels – Oxaalzuur
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie
5.7.6. De reactie tussen ammoniumacetaat en loog

- Info: Welke stof wordt er gevormd bij het samenvoegen van ammoniumacetaat en loog? Wanneer ammoniumacetaat en loog worden samengevoegd, wordt er ammoniak gevormd. Dat kan je waarnemen aan de hand van universeel indicatorpapier en de geur die vrijkomt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniumacetaatoplossing verzadigd (CH3COONH4) – Natronloog 4 mol/l (NaOH)
- Thema: organische stoffen – neutralisatiereactie
- Tijd: 25 min
- Begrippen: carbonzuren – zuur-base reactie
5.8. Polymelkzuur
5.8.1. Polymelkzuur

- Info:Verwarm in een maatbeker van 100 ml 5ml melkzuur, spatelpunt SnCl2 en enkele kooksteentjes. Zodra de oplossing oranje bruin kleurt dien je de oplossing uit te gieten over een ingevette PE of acryl plaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: acryl plaat OF PE schelp – vaseline – melkzuur (5 ml) – SnCl2
- Thema: organische stoffen – kunststoffen
- Tijd: 25 min
- Begrippen: carbonzuren – polymerisatie
6. Esters
6.1. Bereiding van aspirine volgens microschaal

- Info:Hoe bereiden we aspirine? Estervorming
- Moeilijkheid: eenvoudig
- Chemische stoffen: zuiver azijnzuur – salicylzuur – geconcentreerd fosforzuur
- Thema: organische stoffen
- Tijd: 25 min
- Begrippen:esters – condensatiereacties – organische reacties
6.2. Bereiding van ethylbenzoaat

- Info: Hoe kun je ethylbenzoaat bereiden? Ethylbenzoaat is het ester van ethanol en benzoëzuur, de vloeistof heeft een aangename, sterke maar zoete geur die associaties opwekt met bepaalde fruitsoorten. Vandaar dat de stof vaak gebruikt wordt als kunstmatige geur en smaakstof in voedsel en snoep. Het kan bereid worden door ethanol en benzoëzuur te laten reageren. Zwavelzuur treedt hier op als een katalysator:
- Moeilijkheid: eenvoudig
- Chemische stoffen: benzoëzuur – ethanol – geconcentreerd zwavelzuur
- Thema: organische stoffen
- Tijd: 25 min
- Begrippen:esters – condensatiereacties – organische reacties
6.3. Esters vormen met de microschaalmethode

- Info: Hoe vormen we esters met microschaalmethode? Vorming van ester uit alcohol en zuur. De geur van azijn en alcohol verdwijnt
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zuiver azijnzuur – Zuiver ethanol – Geconcentreerd zwavelzuur
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen:esters – condensatiereacties – organische reacties
6.4. Oplosbaarheid van ethylacetaat
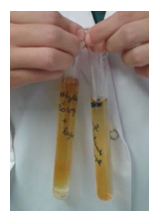
- Info: Is ethylacetaat oplosbaar in water? Ethylacetaat is zeer weinig oplosbaar in water. Het ethylacetaat dat toch opgelost is in het water, wordt in de eerste proefbuis uitgezouten. Dit wilt zeggen dat de zoutionen de plaats innemen van ethylacetaat en de dunne laag ethylacetaat bovenaan de proefbuis zit. Er treedt dus ontmenging op.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethylacetaat – Natriumchloride – dijood
- Thema: organische stoffen – oplosbaarheid
- Tijd: 20 min
- Begrippen:esters

- Info:Met welke chemische producten kunnen we een synthetische bananengeur maken? Vertrekkende van isoamylalcohol en azijnzuur kunnen we mits een uur refluxeren een ester maken die naar bananen ruikt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Isoamylalcohol – Azijnzuur – Zwavelzuur – Natriumwaterstofcarbonaat-oplossing 5%
- Thema: organische stoffen – organische reacties
- Tijd: 1 uur
- Begrippen:esters – condensatiereactie
6.6. De reactie van propaan-2-ol en azijnzuur

- Info: Wat verkrijg je wanneer je propaan-2-ol, azijnzuur en zwavelzuur samen gaat verwarmen? Er wordt een ester gevormd (daardoor geurverandering).
- Moeilijkheid: eenvoudig
- Chemische stoffen: propaan-2-ol – azijnzuur, – geconcentreerd zwavelzuur
- Thema: organische stoffen – organische reacties
- Tijd: 20 min
- Begrippen:esters – condensatiereactie
6.7. De reactie van butaan-1-ol en azijnzuur

- Info: Wat verkrijg je wanneer je butaan-1-ol, azijnzuur en zwavelzuur samen gaat verwarmen? Er wordt een ester gevormd (daardoor geurverandering).
- Moeilijkheid: eenvoudig
- Chemische stoffen: butaan-1-ol – azijnzuur, – geconcentreerd zwavelzuur
- Thema: organische stoffen – organische reacties
- Tijd: 20 min
- Begrippen:esters – condensatiereactie
6.8. Ethylpropanoaat

- Info: Wat gebeurt er als je een organisch zuur en een alkanol met elkaar laat reageren? Propionzuur splitst een OH-groep af. De ethanol splitst een waterstofatoom (H) af. De gesplitste OH-groep en waterstofatoom voorstelt (H) vormen samen water (H 2 O). Dit water wordt door het zinkchloride gebonden, zodat het evenwicht van de veresteringsreactie aan de goede kant is. Het zuurresidu en het alkanolresidu worden gecombineerd om ethylpropanoaat te vormen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 ml ethanol – 5 ml propionzuur – 1 spatelpunt zinkchloride
- Thema: organische stoffen – organische reacties
- Tijd: 30 min
- Begrippen:esters – condensatiereactie
6.9.Bereiding van een ester uitgaande van een zuurchloride
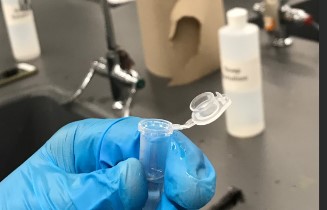
- Info: Wat gebeurt er als je ethylacetaat in water brengt? Het opgevangen gas is waterstofgas: knalgas De waterige fase geeft met zilvernitraat een witte neerslag van zilverchloride. De bovenste laag heeft een typische estergeur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zilvernitraat – natrium – ethaanzuur – propaan-1-ol
- Thema: organische stoffen – redoxreactie
- Tijd: 35 min
- Begrippen:esters – condensatiereactie – identificatie
6.10. Bereiding van een ester uitgaande van een carbonzuur

- Info: Wat kun je een ester bereiden uit een alcohol en een carbonzuur? Door condensatie ontstaan esters. Door toevoeging van de verzadigde NaCl-oplossing wordt het ester uitgezouten. Je neemt een typische geur waar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zwavelzuur – ethanol – aanwezige alcoholen – keukenzout
- Thema: organische stoffen
- Tijd: 35 min
- Begrippen:esters – condensatiereactie
6.11. De oplosbaarheid van ethylacetaat

- Info: Ethylacetaat is zeer weinig oplosbaar in water. In de eerste reageerbuis wordt ethylacetaat uitgezouten. De toegevoegde zoutionen worden gehydrateerd waardoor er minder watermoleculen beschikbaar zijn voor het ester. Er treedt ontmenging op.Dijood lost beter op in de apolaire fase: geelkleuring.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ethylacetaat – keukenzout – lugol
- Thema: organische stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen:esters – oplosbaarheid
7. Ethers

- Info: Hoe kun je de brandbaarheid van diethylether testen? We zien dat het uiteinde aan de zijkant van de buis gaat branden. De etherdampen zijn zwaarder dan de lucht en brandbaar. Hierdoor zakt de ether dus naar onder in het buisje en komen de dampen daar ook vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: diethylether – watten
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen:ethers – brandbaarheid
7.2. Bereiding van diëthylether

- Info: Hoe kunnen we een ether vormen uitgaande van een alcohol en een zuur? We kunnen een ether synthetiseren door de nucleofiele substitutie uit te voeren van een alcohol in een zuur milieu. De gevormde diëthylether kan je herkennen aan de typische vrijkomende geur. Vroeger werd diëthylether vooral gebruik als Het is echter een erg brandbare stof en kan soms zelfs leiden tot explosies. Nu worden ethers vooral gebruikt als oplos- en extractiemiddel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol – Geconcentreerd H2SO4 – Al2O3
- Thema: organische stoffen – organische reacties
- Tijd: 20 min
- Begrippen:ethers – synthesereactie
7.3. Brandbaarheid van diëthylether

- Info: Hoe gebeurt de verbranding van diëthylether? We zien dat het uiteinde aan de zijkant van de buis gaat branden. De etherdampen zijn zwaarder dan de lucht en brandbaar. Hierdoor zakt de ether dus naar onder in het buisje en komen de dampen daar ook vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: diethylether – watten
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen:ethers – brandbaarheid

- Info: Hoe gebeurt een explosie van diëthylether? Spuit uit een buis lak in een vuur
- Moeilijkheid: eenvoudig
- Chemische stoffen: diethylether – knalbus
- Thema: organische stoffen – redoxreacties
- Tijd: 20 min
- Begrippen:ethers – brandbaarheid

- Info: Hoe kunnen we een ether vormen uitgaande van een alcohol en een zuur? We kunnen een ether synthetiseren door de nucleofiele substitutie uit te voeren van een alcohol in een zuur milieu. De gevormde diëthylether kan je herkennen aan de typische vrijkomende geur. Vroeger werd diëthylether vooral gebruik als Het is echter een erg brandbare stof en kan soms zelfs leiden tot explosies. Nu worden ethers vooral gebruikt als oplos- en extractiemiddel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol – Geconcentreerd H2SO4 – Al2O3
- Thema: organische stoffen – organische reacties
- Tijd: 20 min
- Begrippen:ethers – synthesereactie
8. Halogeenalkanen
8.1. Beilsteinproef

- Info: Hoe kunnen we de halogeenalkanen identificeren? Wanneer we polypropeen en polyetheen in contact brengen met verhit koper en daarna in de vlam van de bunsenbrander houden, gebeurt er niets. Enkel bij PVC kleurt de vlam groen. PVC of polyvinylchloride is een polymeer van chlooretheen en bevat dus chloor.
- Moeilijkheid: eenvoudig
- Chemische stoffen: bunsenbrander PVC + polypropeen + polyetheen
- Thema: organische stoffen – kunststoffen
- Tijd: 20 min
- Begrippen: halogeenalkanen – identificatie
8.2. Identificatiereactie

- Info: Hoe kun je halogeenalkanen aantonen? Wanneer de spiraal terug verhit wordt merk je een groene vlamkleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: PVC – chloroform
- Thema: organische stoffen
- Tijd: 20 min
- Begrippen: halogeenalkanen – identificatie
8.3. Nucleofiele substitutie van ethyloxide op tetrabroomkoolstof

- Info: Hoe gebeurt de nucleofiele substitutie van ethyloxide op tetrabroomkoolstof? Er ontstaat snel een witgele neerslag in de reageerbuis, eventueel na zachte verwarming
- Moeilijkheid: eenvoudig
- Chemische stoffen: CBr4 – ethanol – zilvernitraat
- Thema: organische stoffen – organische reacties
- Tijd: 20 min
- Begrippen: halogeenalkanen – nucleofiele substitutie
8.4. Nucleofiele substitutie van OH-ionen op ethyljodide

- Info: Hoe gebeurt de nucleofiele substitutie van OH– op ethyljodide? Een nucleofiel reagens (OH–) valt het gepositiveerd C-atoom in ethyljodide aan en verdringt I- dat zich uit de molecule afsplitst. Het gevormde I- vormt met de zilverionen uit het Ag(NH3)2+ complex het lichtgele AgI-neerslag.
Het evenwicht verschuift naar rechts omdat het jodide-ion sterk aan het Ag+-ion wordt gebonden, zodat de weinig oplosbare ionverbinding AgI wordt gevormd. - Moeilijkheid: eenvoudig
- Chemische stoffen:ethyljodide – verdunde ammoniak – zilvernitraat
- Thema: organische stoffen – organische reacties
- Tijd: 25 min
- Begrippen: halogeenalkanen – nucleofiele substitutie
8.5. Eliminatiereactie op 2-broom-2-methylpropaan

- Info: Hoe gebeurt de eliminatiereactie op 2-broom-2-methylpropaan? Er ontstaat een gas (2-methylpropeen) dat zich bovenaan in de meetspuit verzamelt.Het broomwater wordt door het gas ontkleurd en er ontstaat een bruine neerslag van mangaandioxide wanneer het gas door de verdunde kaliumpermanganaatoplossing borrelt.
- Moeilijkheid: eenvoudig
- Chemische stoffen:KOH – 2-broom-2-methylpropaan – broomwater – ethanol
- Thema: organische stoffen – organische reacties
- Tijd: 25 min
- Begrippen: halogeenalkanen – eliminatiereactie
9. Ketonen

- Info: Wat gebeurt er als we aceton samenbrengen met NaHSO3-oplossing? Er ontstaat een neerslag aan interfase
- Moeilijkheid: eenvoudig
- Chemische stoffen: aceton – NaHSO3-oplossing
- Thema: organische stoffen – organische reacties
- Tijd: 25 min
- Begrippen:ketonen – additiereactie
9.2. Aceton en piepschuim

- Info: Wat gebeurt er als je aceton bij piepschuim voegt? Het piepschuim verdwijnt in de aceton
- Moeilijkheid: eenvoudig
- Chemische stoffen: Piepschuim – Aceton
- Thema: organische stoffen – organische reacties
- Tijd: 10 min
- Begrippen:ketonen – oplosbaarheid
9.3. Bereiding van aceton

- Info: Hoe kun je aceton bereiden?
- Moeilijkheid: eenvoudig
- Chemische stoffen: kaliumdichromaat – propaan-2-ol – gec zwavelzuur
- Thema: organische stoffen – organische reacties – redoxreactie
- Tijd: 10 min
- Begrippen:ketonen – oxidatie
10. Koolwaterstoffen
10.1. Aardappelkanon

- Info: Hoever kun je een aardappel schieten met een zelfgemaakt aardappelkanon? In de meeste spuitbussen is butaan het drijfgas. De reactie die optreedt is dus de verbranding van butaan.De afstand die we kunnen bereiken met het aardappelkanon is voornamelijk afhankelijk van de hoeveelheid gas dat we gebruiken, ook spelen de hoek waaronder we schieten en in mindere mate de aard van het gas een rol.
- Moeilijkheid: gemiddeld
- Chemische stoffen: koperdraad – (laad)stok – aardappels – alkaan
- Thema: organische stoffen – organische reacties – redoxreactie
- Tijd: 30 min
- Begrippen:alkanen – verbrandingsreactie
10.2. Bromering van pentaan

- Info: Welke stof wordt er gevormd bij de fotolyse van pentaan met dibroom? Halogeenalkanen ontstaan bij de reactie tussen het halogeen en het alkaan. Tijdens de reactie moet het mengsel bestraald worden met zichtbaar (Br2) of U.V.-licht (Cl2). De reactie verloop zeer traag. Er ontstaat bovendien een mengsel van verschillende halogeenalkanen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Al-folie – water met fft met voldoende NaOH om een paarse kleur te bekomen – dibroom – 5% AgNO3
- Thema: organische stoffen – organische reacties
- Tijd: 30 min
- Begrippen:alkanen – radicalaire substitutie
10.3. Chemische regenboog in tomatensap

- Info: Het belangrijkste pigment in tomaten is het lycopeen. In de structuur zijn geconjugeerde electronensystemen aanwezig die blauwe kleur absorberen en daardoor een rode kleur hebben. Door additie met broom verkleint de lengte van het geconjugeerd systeem waardoor de geabsorbeerde golflengte verkort. Deze gaat uiteindelijk naar kleurloos.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Tomatensap – Broomwater (verzadigd)
- Thema: organische stoffen – organische reacties
- Tijd: 20 min
- Begrippen:alkanen – radicalaire substitutie
10.4. De functie van een kaarswiek

- Info: Wat is de functie van de wiek? Exotherme reacties: verbrandingsreacties.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Wiek – Lucifers – Lampolie
- Thema: organische stoffen – redoxreactie
- Tijd: 15 min
- Begrippen:alkanen – verbranding
10.5. Etheenbereiding uit ethanol door katalysator

- Info: Hoe kan je etheen uit ethanol bereiden? Deze proef toont aan dat door middel van een katalysator en verhitting de ethanol wordt omgezet in een gas, nl. etheen. De katalysator zorgt in dit geval voor een kraakproces en breekt dus de bindingen van ethanol door. Dat de gevormde stof etheen is, kan verklaard worden d.m.v. het gas in dibroom te laten borrelen en het gas te verbranden m.b.v. een lucifer. Door eliminatie van water (dehydratering) kan men van een alcohol een alkeen maken. Door zwavelzuur te laten inwerken op ethanol bijvoorbeeld ontstaat etheen. De hoge temperatuur en de grote overmaat zwavelzuur t.o.v. ethanol zorgen ervoor dat de eliminatie gebeurt (en niet de substitutie met vorming van ether).
- Moeilijkheid: eenvoudig
- Chemische stoffen: Staalwol – Ethanol – Katalysator
- Thema: organische stoffen – organische reactie
- Tijd: 15 min
- Begrippen:alkenen – eliminatie
10.6. Gefractioneerde destillatie van ruwe aardolie

- Info: Door het afscheiden van verschillende fracties door destilleren van aardolie worden bestanddelen van aardolie bekomen
- Moeilijkheid: gemiddeld
- Chemische stoffen: aardolie – kooksteentje
- Thema: organische stoffen – organische reactie – scheidingstechnieken
- Tijd: 35 min
- Begrippen:alkanen – destillatie
10.7. Identificatie van de verbrandingsproducten van een kaars

- Info: Tot welke stoffen verbrandt een koolwaterstof? Leg een stuk blauw kobaltdichloride papier in de eerste proefbuis en vul de andere half met kalkwater.Steek de kaars aan en laat het enkele minuten branden tot de kobaltchloride verandert van blauw naar roze en kalkwater vertroebelt
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – Stukje blauw kobaltchloride papier – 20 ml van kalkwater
- Thema: organische stoffen – organische reactie
- Tijd: 15 min
- Begrippen:alkanen – verbrandingsreactie – identificatie
10.8. Inerte alkanen

- Info: Hoe reageren alkanen met zwavelzuur?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Paraffine – Kristalsuiker – Geconcentreerd zwavelzuur – kaarsenvet van een theelichtje
- Thema: organische stoffen – organische reactie
- Tijd: 15 min
- Begrippen:alkanen – corrosie
10.9. Maken van biodiesel

- Info: Hoe reageren alkanen met zwavelzuur? De bereiding van diesel is een zgn transesterificatiereactie, een bewerking waarbij de alkoxygroep van een ester wordt vervangen door die van een alcohol. De reactie is schematisch weergegeven in nevenstaande figuur. Men voegt loog aan het mengsel om een zgn methoxide of ethoxide te maken (CH3O–Na+). Het methoxide of ethoxide reageert vervolgens met de estergroep van het triglycderide. De overmaat aan methanol/ethanol die in het mengsel aanwezig is zorgt ervoor dat de reactie richting biodiesel verloopt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: zonnebloemolie – methanol – natronloog (gootsteenontstopper korrels)
- Thema: organische stoffen – organische reactie
- Tijd: 35min
- Begrippen:alkanen – biodiesel
10.10. Methaanvuurbal

- Info: Hoe maken we bellenblazen chemisch spectaculair? Nadat we de lucifer bij de bubbels houden, zien we een enorme vuurbal ontstaan. Het opmerkelijke is dat de handen van de proefpersoon niet verwond zijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: methaangas – lucifers – water
- Thema: organische stoffen – organische reactie
- Tijd: 15min
- Begrippen:alkanen – verbrandingsreactie
10.11. Onverzadigdheid in verbrand spek
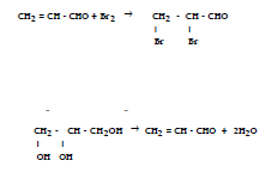
- Info: Welke invloed heeft spek op broomwater? Het broomwater ontkleurt. Bij het koken gebeurt een omzetting van glycerol naar acroleïne. Het dibroom reageert met de dubbele binding in acroleïne.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Stuk spek – Bunsen – Erlenmeyer met broomwater
- Thema: organische stoffen – organische reactie
- Tijd: 15min
- Begrippen:alkenen – additiereactie
10.12. Rijp fruit in een ommezien

- Info: Kunnen we d.m.v. een beschimmelde citroen onrijp fruit sneller laten rijpen? De groene schimmel op de citroen geeft een gas af: ethyleen.De schimmel geeft zo veel gas af dat een enkele beschimmelde citroen genoeg is om honderden stukken fruit te doen rijpen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: een citroen laten beschimmelen – papieren zak – onrijpe peren, appelen of perziken
- Thema: organische stoffen – organische reactie
- Tijd: 15min
- Begrippen:alkenen – katalysator – oxidatie
10.13. Schoonmaken op zee

- Info:Hoe kan je met piepschuim of PUR schuim olie uit water halen? De olie wordt door het piepschuim en het PUR schuim geadsorbeerd en er blijft aanzienlijk minder olie achter in het water. De apolaire olie bindt eerder aan het apolair kunststof.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Motorolie – Piepschuim of PUR schuim
- Thema: organische stoffen – oplosbaarheid
- Tijd: 15min
- Begrippen:koolwaterstoffen – apolaire stoffen
10.14. Sublimatie van luchtverfrisser

- Info:Hoe werkt het principe van een luchtverfrisser? Bij deze proef zien we dat de naftaleen o.i.v. temperatuur direct vervliegt in een gas, er is geen vloeibare fase. Ook luchtverfrissers werken op dezelfde manier. Door het grote temperatuurverschil met de lucht, gaat de luchtverfrisser bij blootstelling ervan direct vervliegen, van vast naar gas dus, of sublimatie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: heet water – vaste luchtverfrisser
- Thema: organische stoffen – stofeigenschappen
- Tijd: 15min
- Begrippen:koolwaterstoffen – sublimatie
10.15. Tomatensap met broom

- Info: Door additie met broom verkleint de lengte van het geconjugeerd systeem waardoor de geabsorbeerde golflengte verkort. Deze gaat uiteindelijk naar kleurloos.
- Moeilijkheid: gemiddeld
- Chemische stoffen:tomatensap – broomwater (verzadigd)
- Thema: chemische reacties – energetische aspecten – organische stoffen
- Tijd: 25 min
- Begrippen: endo-energetische reacties – additiereactie – koolwaterstoffen
10.16. Uitlaatgassen van auto

- Info: Uitlaatgassen van auto’s bevatten welk gas? Ca(OH)2 is een indicator voor CO2. Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig. Wanneer de oplossing troebel wordt, is er CO2 aanwezig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een staal van autouitlaatgas – Calciumdihydroxide ( Ca(OH)2)
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
10.17. Verbranden van ethyn

- Info: Welke stof wordt er gevormd door hydrolyse van calciumcarbide? Door de hydrolyse van calciumcarbide wordt er ethyn gevormd. Ethyn zal vervolgens reageren tot koolstofdioxide en water, d.m.v. verbranding.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumcarbide
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie – alkynen
10.18. Verbranding van brandstoffen

- Info: Welke stof brandt het beste: methanol, butaan-1-ol, heptaan-1-ol? Breng in 2 uitdampschaaltjes respectievelijk 2 à 3 ml methanol en evenveel butaan-1-ol en heptaan-1-ol in de anderen. Nader met een brandend lont beide brandstoffen. Neem het verschil in brandbaarheid waar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 à 6 ml methanol; – 4 à 6 ml butaan-1-ol. – 4 à 6 ml heptaan-1-ol
- Thema: organische stoffen – redoxreacties
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
10.19. Was verbranden zonder wiek

- Info: Kunnen we was laten branden zonder de wiek? De was brandt niet in vaste toestand.Exotherme reacties: verbrandingsreacties.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Was van een kaars – Lucifers
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
10.20. Was verdampen en gas ontsteken

- Info: Hoe kunnen we was toch laten branden? De was brandt niet in vaste toestand, maar wel in gastoestand
- Moeilijkheid: eenvoudig
- Chemische stoffen: Was van een kaars – Bunsenbrander
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
10.21. Welk gas ontstaat er door verbranding van een kaars?

- Info: Welk gas ontstaat er door verbranding van een kaars? Ca(OH)2 is een indicator voor CO2. Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig. Wanneer de oplossing troebel wordt, is er CO2 aanwezig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Nagel – Theelichtje – Kalkwater
- Thema: organische stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
10.22. Onverzadigde verbindingen in gummibeertjes

- Info: Hoe kunnen we dubbele bindingen in gummibeertjes aantonen? In gummibeertjes zijn onverzadigde verbindingen aanwezig met dubbele bindingen. Door additiereactie gebeurt de omzetting tot een halogeenalkaan. Hierdoor treedt er een kleurverandering op van het broomwater
- Moeilijkheid: eenvoudig
- Chemische stoffen: broomwater – kleurloos gummibeertje
- Thema: organische stoffen – organische reactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – additiereactie
10.23. De bromering van alkanen in een microschaal

- Info: Hoe kunnen we alkanen bromeren? Reactie uitvoeren in licht en aantonen dat dibroom reageert met het alkaan
- Moeilijkheid: eenvoudig
- Chemische stoffen: dibroom, – zilvernitraat-oplossing, – indicator (universeelindicator), -n-pentaan
- Thema: organische stoffen – organische reactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – radicalaire substitutie
10.24. Kaarsvlam vergelijken met vlam van de wiek

- Info: Wat zorgt voor de grootste vlam? De wiek alleen zorgt niet voor de mooi vlam van een kaars.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaars – Wiek – Lucifers
- Thema: organische stoffen – redoxreactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
10.25. Regenboog in tomantensap

- Info: Hoe kunnen we met tomatensap een regenboog in het labo proberen na te maken? Het belangrijkste pigment in tomaten is het lycopeen. In de structuur zijn geconjugeerde elektronensystemen aanwezig die blauwe kleur absorberen en daardoor een rode kleur hebben. Door additie met broom verkleint de lengte van het geconjugeerd systeem waardoor de geabsorbeerde golflengte verkort. Deze gaat uiteindelijk naar kleurloos.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Tomatensap – Broomwater
- Thema: organische stoffen – organische reactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – additiereactie
10.26. Explosief Zilver

- Info: Hoe kun je vast materiaal doen knallen? Door acetyleengas te laten reageren met Tollensreagens, krijgen we zilveracetylide. Dit een zeer instabiele neerslag die gevormd, door er een vlam aan te houden gaat de explosie plaatsvinden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumcarbide – Water – Tollensreagens
- Thema: organische stoffen – organische reactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – redoxreactie
10.27. Mottenballenkristallen

- Info: Hoe maak je kristallen van mottenballen? De vaste mottenballen verdampen zonder over te gaan in een vloeibare fase. Het proces om rechtstreeks van een vaste fase naar een gasfase te gaan, wordt sublimatie genoemd. Wanneer de kristallen van de mottenballen verhitten, stijgt de temperatuur, smelten de kristallen en vindt de overgang naar een gasfase plaats.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mottenballen (naftaleen)
- Thema: organische stoffen – organische reactie – stofeigenschappen
- Tijd: 15 min
- Begrippen: koolwaterstoffen -sublimatie
10.28. Eigenschappen van butaan

- Info: Welke eigenschappen heeft butaangas en hoe kunnen deze worden bewezen? Wanneer het n-butaan wordt verbrand , worden water en kooldioxide geproduceerd . De vlam wordt roet omdat te veel n-butaandeeltjes willen reageren met de zuurstof in de lucht, maar de hoeveelheid zuurstof is niet voldoende om alle koolstofatomen in het n-butaan kooldioxide te laten vormen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Butaan (aantal ml)
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbranding
10.29. Aanstekersgas onderzoeken

- Info: Wat zijn de eigenschappen van aanstekergas? De reageerbuis is na het omdraaien nog steeds tot de bovenkant gevuld met water . Als je de aansteker onder de opening van de reageerbuis houdt en op de gashendel drukt, stijgen er bellen van de aansteker in de reageerbuis en zakt het waterniveau. De gasbellen zijn kleurloos.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Aansteker
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbranding
10.30. Eigenschappen van aanstekersgas

- Info: Wat zijn de eigenschappen van aanstekergas? Het gas ontsteekt, het brandt met een kleine, bijna kleurloze vlam. Zodra de reageerbuis ondersteboven wordt gedraaid, wordt de vlam groter en geel. Het dooft na een paar seconden.Buiten de reageerbuis bij de opening vormt zich een grote vlam die snel uitgaat. De vlam is oranjegeel .
- Moeilijkheid: eenvoudig
- Chemische stoffen: Aansteker
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbranding
10.31. Wasexplosie

- Info: Wat gebeurt er als je brandende was (of olie) dooft met water? De wasdamp kan pas na verloop van tijd worden ontstoken, die dan verder brandt zonder een vlam. Zodra er een druppel water in de was druppelt, vormt zich een straal van vlammen, die ongeveer een meter hoog uit de porseleinen smeltkroes omhoog schiet. Wasdruppels spatten uit de porseleinen smeltkroes en laten wasvlekken achter op het keramische gaas en de vuurvaste basis. Bij elke druppel water die in de was valt, sist hij luid.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 15 g bijenwas – 2,3 druppels water
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbranding
10.32. Dochtervlam van een kaars

- Info: Hoe kunnen meerdere vlammen maken? De opstijgende wasdamp reist door de glazen buis. De stoom kan niet branden in de glazen buis omdat er geen zuurstofgas is om te verbranden. De wasdamp komt uit de bovenkant van de glazen buis en kan daar worden ontstoken omdat het brandbaar is en er zuurstofgas aanwezig is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 kaars
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbranding
10.33. Kruipende gassen in buisje

- Info: Wat zijn de gevaren van een doek die is gedrenkt in benzine of oplosmiddel?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 ml benzine – 1 kaars
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.34. Kruipende gassen

- Info: Wat maakt een benzinevlek zo gevaarlijk als je er met open vuur in de buurt komt? Beginnend bij de aansteker vlam, verspreidt een vlamfront zich naar de benzinevlek. Dit gebeurt ook als de vlam ongeveer 30 cm verwijderd is van de benzinevlek. Grote delen van de tafel verbranden plotseling, totdat aan het einde alleen nog een grote, flakkerende vlam op de benzinevlek achterblijft. Dit verdwijnt na enkele seconden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aansteker – 15 druppels benzine
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.35. Schoorsteeneffect

- Info: Hoe werkt een open haard? De hete uitlaatgassen stijgen op door de opening. Door de opgewekte onderdruk wordt via de bodem verse lucht aangezogen.Dit proces wordt het schoorsteeneffect genoemd .
- Moeilijkheid: eenvoudig
- Chemische stoffen: Twee houten stokjes – 1 smalle kaars
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.36. Geest in een fles

- Info: Wat zijn de gevaren van containers waarin benzine is opgeslagen? Benzine mag je niet met water wassen. De benzine kleeft aan de glazen wand. Door de kamertemperatuur ontstaan er keer op keer benzinedampen in de fles, die bij het kantelen van de fles boven de kaarsvlam ontbranden.Er is geen explosie omdat er niet genoeg zuurstof in de fles zit .
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 druppels benzine – 1 kaars – 100 ml water
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.37. Kaars op afstand aansteken

- Info: Wat gebeurt er als je een vlam in de rookdraad van een kaars houdt die net is uitgeblazen? Een rookdraad stijgt op uit de lont. Zodra de vlam van de aansteker of lucifer de rookdraad raakt, ontsteekt de lont van de kaars. Het lijkt erop dat de lont uit het niets ontsteekt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Vuurvast oppervlak – Kaars
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.38. Kaars aansteken

- Info: Wat gebeurt er als een kaars wordt aangestoken? Er zit vaste was rond de pit die eerst moet smelten. Was smelt bij een temperatuur van ca.65 ° C. De lichtere vlam heeft enige tijd nodig om de was boven het smeltpunt te verwarmen. De katoenen lont absorbeert de vloeibaar gemaakte was . De vloeibare was verdampt aan het uiteinde van de lont en vormt wasdamp, die brandbaar is en dus ontsteekt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Vuurvast oppervlak – Kaars
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.39. Kaars onder glas aansteken

- Info:Wat gebeurt er als je een drijvende kaars afdekt met een erlenmeyer? Hoe kun je met dit experiment het zuurstofgehalte van de lucht aantonen? Het water stijgt in de erlenmeyer, het waterpeil zakt in de schaal. De vlam wordt langzaamaan kleiner. Het duurt een paar seconden voordat de kaars uitgaat. De kaars beweegt mee met het stijgende waterpeil.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kaars – 100 ml water
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding – bepalen van gehalte zuurstofgas in lucht
10.40. Aantonen van dubbele bindingen in organische stoffen

- Info:Hoe kun je dubbele bindingen in organische stoffen aantonen? Bij de aanwezigheid van een dubbele binding zal de gele kleur van broomwater verdwijnen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Broomwater – Enkele vaste of vloeibare organische stoffen met en zonder dubbele bindingen
- Thema: organische stoffen – organische reactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – additiereactie
10.41. Additie van dibroom op ethyn en etheen

- Info:Hoe reageert dibroom met alkenen en alkynen? Bij het toevoegen van 3 ml ethyn aan dibroom is de ontkleuring in het reactievat vast te stellen. Voor de ontkleuring van 10 ml dibroom is ongeveer 5 à 6 ml ethyn nodig. Voor de ontkleuring an 10 ml dibroom et etheen zijn er ongeveer 10 à 12 ml vereist. Het gaat hier niet om een subsitutiereactie maar om een additie. Er wordt geen HBr gevormd. In het compartiment met NaOH treedt er geen ontkleuring op. In het compartiment met zilvernitraat ontstaat er geen neerslag. De Beilsteintest is positief.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Dibroom – Etheen, ethyn – Zilvernitraatoplossing 0,01 mol/l – NaOH-oplossing 0,1 mol/l – Fft
- Thema: organische stoffen – organische reactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – additiereactie
10.42. Reactie van ethyn en dichloor

- Info:Hoe reageert ethyn met dichloor? In de vloeistof ontstaat een flitsend vuurwerk. Hierbij wordt veel roet gevormd dat aan de oppervlakte van de vloeistof komt drijven. Toevoegen van zilvernitraat in het bekerglas geeft een witte neerslag van zilverchloride waardoor het gevormde zoutzuur is aangetoond.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumcarbide – Kaliumpermanganaat – Zoutzuur geconcentreerd – Zilvernitraatoplossing
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – oxidatie
10.43. Knalbusexperiment

- Info:Hoe kan je een harde knal veroorzaken met behulp van ethyn? Met een luide knal wordt de kurkstop weggeschoten
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gasgenerator voor de bereiding van ethyn
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 15 min
- Begrippen: koolwaterstoffen – oxidatie – verbranding
10.44. Eigenschappen van ethyn: verbranding

- Info: Wat zijn de eigenschappen van ethyn? Uit de waarnemingen blijkt het belang van de brandstof/dizuurstof-samenstelling voor een goede verbrandingsreactie. Voor de meeste brandstoffen levert de correcte stoechiometrische samenstelling het beste resultaat. Voor ethyn krijg je de luidste knal bij een ongeveer 50%/50% samenstelling.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gasgenerator voor de bereiding van ethyn
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – oxidatie – verbranding
10.45. Eigenschappen van ethyn

- Info: Wat zijn de eigenschappen van ethyn? De violette kleur van kaliumpermanganaat verdwijnt Indien gewerkt wordt met het Baeyerreagens worden bruine spikkeltjes van mangaandioxide gevormd. In het compartiment met broomwater treedt ook een ontkleuring op door additie van dibroom op de onverzadigde verbinding. In het derde compartiment ontstaat een grijsgele neerslag van Ag2C2
- Moeilijkheid: eenvoudig
- Chemische stoffen:Etheen of ethyngasgenerator – Broomwater – Baeyerreagens – Ammoniakale oplossing van zilver – Salpeterzuur
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – oxidatie – verbranding – identificatie
10.46. Bereiding van ethyn

- Info: Hoe kun je ethyn bereiden? Door reactie van calciumcarbide met water
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumcarbide – Fenolftaleïne – Broomwater – Kalkwater
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – identificatie
10.47. Bereiding van ethyn met gasgenerator

- Info: Hoe kun je ethyn bereiden? Door reactie van calciumcarbide met water
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gasgenerator (gesloten fles met 2 grote spuiten in stop) – Calciumcarbide
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – identificatie
10.48. Bereiding van etheen

- Info: Hoe kun je etheen bereiden?Er wordt een gas gevormd dat onoplosbaar is in water. Het gevormde gas is onverzadigd (broomwater) ontkleurt.Het gevormde gas is brandbaar en vormt koolstofdioxide dat het kalkwater troebel maakt.Ethanol in geconcentreerd zwavelzuur geeft etheen en water
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol – Geconcentreerd zwavelzuur – Broomwater – Kalkwater
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – identificatie
10.49. Bereiding van etheen met gasgenerator

- Info: Hoe kun je etheen bereiden? Na korte tijd wordt de zuiger van de grote meetspuit omhoog geduwd. De aanwezigheid van etheen in het gas in de grote meetspuit wordt opgevangen en kan via het Baeyerreagens worden gecontroleerd. Ethanol met geconcentreerd zwavelzuur geeft etheen en water
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ethanol – Geconcentreerd zwavelzuur – Broomwater – Kalkwater
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – identificatie
10.50. Bereiding van methaan

- Info: Hoe kun je methaan bereiden? Methaangas is onoplosbaar in water en lichter dan lucht.
Methaangas is brandbaar. Het verbrandingsproduct maakt kalkwater troebel. - Moeilijkheid: eenvoudig
- Chemische stoffen: Aluminiumcarbide – Kalkwater
- Thema: organische stoffen – organische reactie – redoxreactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – identificatie
10.51. Kraken van paraffine-olie

- Info: Hoe kun je paraffine-olie kraken? Door verhitten ontstaat een doorbraak in de ketens met vorming van kleine ketens.
- Moeilijkheid:gemiddeld
- Chemische stoffen: Paraffine-olie – Broomwater
- Thema: organische stoffen – organische reactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – kraken
10.52. Kraken van butaan

- Info: Hoe kun je butaan in kleinere moleculen omzetten?Door verhitten ontstaat een doorbraak in de ketens met vorming van kleine ketens.
- Moeilijkheid:gemiddeld
- Chemische stoffen: Bayerreagens – Butaangas
- Thema: organische stoffen – organische reactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – kraken
10.53. Bromeren van butaan

- Info: Hoe kun butaan laten reageren met dibroom? Wanneer butaangas met dibroom reageert ontstaan er witachtige nevels en de bruine kleur van dibroom verdwijnt.De groene vlamkleur van de Beilsteintest duidt op de vorming van een halogeenalkaan.In het vakje met NaOH ontstaat er een ontkleuring en wordt HBr gevormd.
- Moeilijkheid:eenvoudig
- Chemische stoffen: Dibroom – Butaan – Zilvernitraatoplossing 0,01 mol/l – Natriumhydroxide oplossing 0,1 mol/l – Fft
- Thema: organische stoffen – organische reactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – radicalaire substitutie
10.54. Vlamfront van n-pentaan

- Info: Hoe kun je het vlamfront van pentaan aantonen? De zware pentaandamp zakt door de buis. Als hij onderaan de vlam bereikt slaat de vlam terug in de buis. Dit gaat gepaard met een typisch geluid en vlamkleur best te zien in een verduisterd lokaal
- Moeilijkheid:eenvoudig
- Chemische stoffen: Theelichtje – Watten – n-Pentaan
- Thema: organische stoffen – organische reactie
- Tijd: 20 min
- Begrippen: koolwaterstoffen – verbranding
10.55. Verbranden van alkanen

- Info: Hoe kun de verbrandingsreactie van alkanen visueel maken? Verbrand het alkaan. Met een luide knal wordt de kurkstop weggeschoten
- Moeilijkheid:eenvoudig
- Chemische stoffen: Pastieken meetspuit – Pentaan of butaangas
- Thema: organische stoffen – organische reactie
- Tijd: 10 min
- Begrippen: koolwaterstoffen – verbranding
10.56. Elektrofiele substitutie op naftaleen

- Info:Welke reactie treedt op bij de nitrering van naftaleen? Er ontstaat een gele neerslag van 1,5-dinitronaftaleen
- Moeilijkheid:eenvoudig
- Chemische stoffen: gec salpeterzuur – gec zwavelzuur – naftaleen
- Thema: organische stoffen – organische reactie
- Tijd: 10 min
- Begrippen: koolwaterstoffen – elektrofiele substitutie
10.57. Bromering op tolueen

- Info: Welke reactie treedt op tussen tolueen en dibroom? De oplossing met dibroom ontkleurt.
- Moeilijkheid:eenvoudig
- Chemische stoffen: dibroom – tolueen
- Thema: organische stoffen – organische reactie
- Tijd: 10 min
- Begrippen: koolwaterstoffen – additiereactie
10.58. De synthese van fluoresceïne

- Info: Hoe bereid je fluoresceïne? Door additiereactie ontstaat fluoresceïne
- Moeilijkheid:eenvoudig
- Chemische stoffen: ftaalzuuranhydride – resorcinol – gec zwavelzuur – natriumhydroxide – universele indicator
- Thema: organische stoffen – organische reactie
- Tijd: 30 min
- Begrippen: koolwaterstoffen – condensatiereactie
10.59. De bereiding van fenolftaleïne

- Info: Hoe bereid je fenolftaleïne? Het centrale tetraëdrisch koolstofatoom gebonden aan drie fenylkernen, belet elke interactie tussen deze kernen. Deze stof is daarom kleurloos. Ze absorbeert geen lichtenergie. Door toevoeging van een base ontstaat een structuur waarin het centrale koolstofatoom drie sigmabindingen in éénzelfde vlak krijgt. Men bekomt dus een mesomeer systeem, waarin de elektronen zeer beweeglijk zijn.
- Moeilijkheid:eenvoudig
- Chemische stoffen: ftaalzuuranhydride – norvanol – gec zwavelzuur – natriumhydroxide – universele indicator
- Thema: organische stoffen – organische reactie
- Tijd: 30 min
- Begrippen: koolwaterstoffen – condensatiereactie
10.60. Calciumcarbide doen ontploffen

- Info: Wat gebeurt er als je calciumcarbide in water brengt? Door de hydrolyse van calciumcarbide wordt er ethyn gevormd. Ethyn zal vervolgens reageren tot koolstofdioxide en water, d.m.v. verbranding.
- Moeilijkheid:eenvoudig
- Chemische stoffen: calciumcarbide – water – indicatorpapier
- Thema: organische stoffen – organische reactie
- Tijd: 10 min
- Begrippen: koolwaterstoffen – verbrandingsreactie – alkyn
11. Uitdaging
11.1.Laat de meeste Titanics zinken.

- Info: Probeer zoveel mogelijk piepschuim in een beker met 10 ml aceton te laten verdwijnen in 10 minuten. Het toegevoegde pentaan aan polystyreen bij de bereiding van piepschuim kan zeer goed oplossen in aceton. Tijdens het oplossen ontsnapt het pentaan dat tijdens de productie van piepschuim toegevoegd werd.
- Moeilijkheid:eenvoudig
- Chemische stoffen: 10 ml aceton – piepschuim
- Thema: organische stoffen – organische reactie
- Tijd: 10 min
- Begrippen: keton – oplosbaarheid






