Zilverspiegel
Filmfragment
1.Onderzoeksvraag
Hoe kunnen we een zilverspiegel maken?
2.Voorbereiding
- Bekerglas 250ml
- Aceton (10-20 ml)
- 2 Proefbuis
- pipet
- Statief
- Warmteplaat
- KOH-oplossing (0,8 mol/l)
- Zilvernitraatoplossing 0,1mol/l
- Geconcentreerde ammoniakoplossing 35%
- glucose
3.Uitvoeren
a.Werkwijze
Los in een reageerbuis 1,4 g zilvernitraat op in ca. 100 ml gedemineraliseerd water. Neem hiervan 10%. Voeg druppelsgewijs met de pipet de ammoniakoplossing toe. Dat geeft eerst een geelgrijze troebeling die weer verdwijnt.
Los in een andere reageerbuis 0,5 gram dextrose (=glucosemonohydraat) op in 12,5 ml water. Zorg dat de oplossingen koud zijn (≤ kamertemperatuur).
Uitvoering van de proef:
Giet de zilvernitraat-oplossing in het bekerglas. Voeg met een pasteurpipet, al roerend met een roerstaafje, net zo lang druppels geconcentreerde ammonia toe totdat het in eerste instantie gevormde (bruine) neerslag weer oplost. Voeg aan de nu weer heldere vloeistof de kaliumhydroxide-oplossing toe. Er ontstaat opnieuw een neerslag. Voeg opnieuw druppels geconcentreerde ammonia toe totdat het neerslag juist is opgelost. Breng het zilvercomplexoplossing over in de erlenmeyer en voeg de glucose-oplossing toe. Sluit de erlenmeyer af met een rubber stop en schud totdat zich een complete spiegel heeft gevormd. Dit duurt circa 2 minuten.
b.Waarneming (+ foto’s)

Tijdens het schudden ontstaat aan de binnenzijde van het glas al vrij snel een donkerbruine half-doorzichtige laag die steeds meer gaat spiegelen en uiteindelijk ondoorzichtig wordt. Binnen een paar minuten is de spiegel gevormd. Na afloop van de reactie bevat de erlenmeyer een grof zandkleurig neerslag.
4.Reflecteren
De Tollens reactie wordt gebruikt voor het aantonen van aldehyden en andere reducerende functionele groepen.
Het (vereenvoudigde) reactieschema is als volgt:
Bij toevoeging van ammonia aan een oplossing die Ag+ ionen bevat ontstaat een bruin neerslag van zilveroxide:
2 Ag+ + 2 OH– –> Ag2O + H2O
Zilveroxide lost bij verdere toevoeging van ammonia weer op onder vorming van het zilverdiamine-complex:
Ag2O + 4 NH3 + H2O –> 2 Ag(NH3)2+ + 2 OH–
Het gevormde zilverdiamine complex is niet stabiel.
Om deze reden kunnen ammoniakale oplossingen van zilvernitraat niet worden bewaard.
Redoxreacties na toevoegen van glucose:
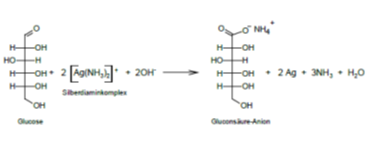
Glucose reduceert hierbij het zilverdiamine complex tot metallisch zilver en wordt zelf geoxideerd tot gluconzuur. Omdat de reactie in alkalisch milieu plaatsvindt zal het gevormde gluconzuur deprotoneren.
5.Onderwerpen
- identificatiereactie glucose
- redoxreacties
- complexeringsreacties
6.Bron






