Hoofdstuk 10 – Experimenten
1. Oplosbaarheidstabellen
1.1. Oplosbaarheidstabel met Al-ionen

1.2. Oplosbaarheidstabel met Li-ionen

1.3. Oplosbaarheidstabel met Zn-ionen

1.4. Oplosbaarheidstabel met Mg-ionen

1.5. Oplosbaarheidstabel met Pb-ionen

1.6. Oplosbaarheidstabel met Ag-ionen

1.7. Oplosbaarheidstabel met Ca-ionen

1.8. Oplosbaarheidstabel met Ni(II)-ionen

1.9. Oplosbaarheidstabel met Fe(II)-ionen

1.10. Oplosbaarheidstabel met Sr(II)-ionen

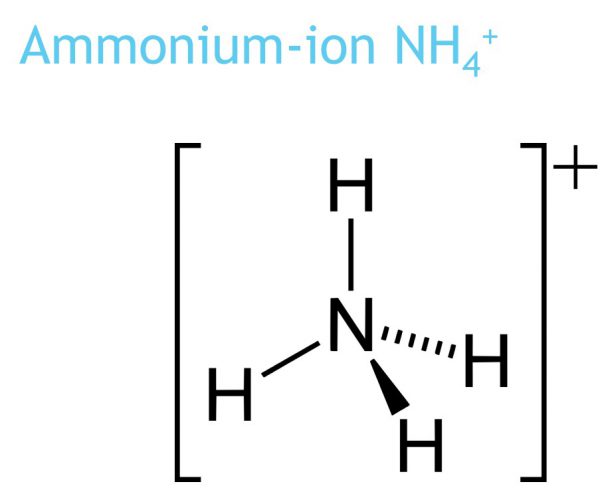
1.11. Oplosbaarheidstabel met NH4-ionen
1.12. Oplosbaarheidstabel met Fe(III)-ionen
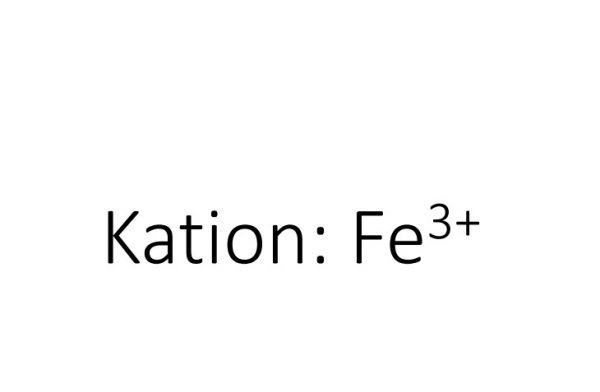
1.13. Oplosbaarheidstabel met Cu(II)-ionen

1.14. Oplosbaarheidstabel met Ba(II)-ionen

2. Neerslagen
2.1. Bereiding van Struvitkristallen

- Info: Wat gebeurt er als we een mengsel van een kaliumbromideoplossing en een kaliumfosfaatoplossing samenvoegen met een mengsel van een ammoniumchlorideoplossing en een magnesiumchlorideoplossing en dit mengsel laten uitdampen? Het KBr verhoogt de dichtheid van de oplossing. Hierdoor ontstaat een bovenstaande laag van Mg2+/NH4+. Aan het grensoppervlak bouwt zich het struvitkritstal Mg(NH4)PO4. Dit zout is beperkt oplosbaar in water en er ontstaan fijne naalden aan het contactoppervlak. Uit de oplossingen diffunderen de ionen zodat een langzame kristallisatie ontstaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magnesiumchloride hexahydraat – Ammoniumchloride – Kaliumfosfaat – Kaliumbromide
- Thema:neerslagreacties
- Tijd: 30 min
- Begrippen: oplosbaarheid
2.2. Calciumcarbonaatfraktalen in kalkwater

- Info: Bij de reactie tussen calciumcarbonaat met zoutzuur ontstaat koolstofdioxide. Deze stijgt omhoog en bedekt ook het oppervlak van het kalkwater. Dit koolstofdioxide komt in contact met het verzadigde kalkwater en vormt hier een laag calciumcarbonaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen:calciumcarbonaat – verzadigd kalkwater – zoutzuur 4M
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – diffusie – Liesegangs ringen
2.3. Diffusiesnelheid van ionen door neerslagreactie

- Info: Wat gebeurt er als we lood(II)acetaat en natriumsulfide in een petrischaaltje met water samenvoegen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Lood(II)acetaat – Natriumsulfide
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – diffusie – Liesegangs ringen
2.4. Een oude hoed met nieuwe veren
- Info: Wat als een sterk geconcentreerde zoutzuuroplossing wordt gebracht op verdunde zilver(I)-oplossing?De AgCl neerslag ontstaat door reactie tussen het HCl in gasfase en de Ag-ionen in de oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Overhead projector – 0,001 M AgNO3 – Geconc HCl
- Thema: neerslagreacties
- Tijd: 10 min
- Begrippen: oplosbaarheid – diffusie
2.5. Geprojecteerde neerslagen

- Info: Door diffusie verdelen de drie zouten zich geleidelijk in het water. Indien voldoende contact ontstaan er respectievelijk AgCl (witte neerslag )en AgI (gele neerslag). Eventueel ontstaat nog door licht Ag.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Overhead projector – zilvernitraat – NaCl – KI
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – diffusie – verschil in oplosbaarheidsproduct
2.6. Liesegangsche ring met magnesiumionen en natriumhydroxide

- Info: Door diffusie verdelen de drie zouten zich geleidelijk in het water. Indien voldoende contact ontstaan er respectievelijk AgCl (witte neerslag )en AgI (gele neerslag). Eventueel ontstaat nog door licht Ag.
- Moeilijkheid: eenvoudig
- Chemische stoffen: magnesiumchloride – gelatinepoeder – ammoniak geconc – natriumhydroxide
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – diffusie – Liesegangse ringen
2.7. Liesegangsche ringen met zilverchromaat

- Info: Wat gebeurt er als we in een mengsel van kaliumdichromaat en gelatinepoeder na geleren een druppel zilverchloride oplossing brengen? Als de chromaationen bevattende gel eenmaal vast is plaatsen we de zilvernitraat oplossing boven op de gel. De zilverionen diffunderen in de gel waar ze in contact komen met de chromaationen. Het gevormde zilverchromaat slaat neer
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gelatine poeder – Kaliumdichromaat – Zilvernitraatoplossing 1 mol/l
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – diffusie – Liesegangse ringen
2.8. Looddijodide tornado

- Info: Hoe maken we goudgele sneeuw? Er wordt een gele neerslag, loodjodide gevormd. Deze filtreren we en laten we drogen gedurende enkele dagen.Nadat het loodjodide is gedroogd, verwarmen we water tot 90° C. We lossen het loodjodide op in het water en laten het water afkoelen. Bij 40° C beginnen de kristallen zich te vormen. Hoe meer het water afkoelt, hoe beter de kristallen zichtbaar worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Oplossing van kaliumjodide (KI); – Oplossing van loodnitraat, Pb(NO3)2.
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – colloïdoplossing

- Info: Hoe maken we goudgele sneeuw? Binnen een uurtje zie je allemaal felgele, sterk glanzende kristalletjes door de vloeistof zweven. Sommige kristalletjes hebben zelfs een metaalachtige weerschijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Oplossing van kaliumjodide (KI); – Oplossing van loodnitraat, Pb(NO3)2.
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – colloïdoplossing
2.10. Maken van kalkgesteente

- Info: Wat gebeurt er als je een verzadigde oplossing van calciumhydroxide laat druipen van een doek? Na enkele dagen ontstaat er aan de doek/watten een stalactiet en op de bodem een stalagmiet die tegenover de stalactiet staat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: water – Ca(OH)2
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.11.Melk en huishoudazijn samenvoegen

- Info:Melk bestaat onder andere uit water en een eiwit dat caseïne heet. Alle eiwitten kunnen alleen opgelost zijn in water bij bepaalde zuurgraden. Deze caseïnemoleculen slaan neer wanneer azijn toegevoegd wordt. De zuurgraad waar ze het minst goed oplossen heet het iso-elektrische punt. Normaal gesproken is melk bijna pH-neutraal en lost de caseïne goed op in water. Als je de melk zuurder maakt door er azijn aan toe te voegen, kan de caseïne niet opgelost blijven. Hierdoor verdwijnt de emulgerende werking rond de vetten zodanig dat ook de vetten gaan uitvlokken. De melk gaat schiften in water en losse caseïne. Als je de caseïne laat opdrogen wordt het heel hard. Daarom kun je er leuk beeldjes mee maken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: melk, (liefst volle melk) – huishoudazijn
- Thema: neerslagreacties – biochemie
- Tijd: 20 min
- Begrippen: oplosbaarheid – coaguleren van caseïne
2.12. Neerslag in stappen

- Info: Met loodionen worden verschillende neerslagen met verschillende oplosbaarheidsproducten gevormd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 mol/l Pb(NO3)2 – 1 mol/l NaCl – 1 mol/l KI – 1 mol/l Na2S
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.13. Neerslag van calciumfosfaat

- Info: Hoe beïnvloedt natriumcitraat de reactie tussen een calciumchlorideoplossing, water en een kaliumfosfaatoplossing ? De citraationen bouwen met de calciumionen een stabiel complex. De concentratie van de vrije Ca-ionen daalt hierdoor zo sterk dat het oplosbaarheidsproduct van calciumfosfaat niet wordt overschreden waardoor neerslagvorming uitblijft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumchloride dihydraat – Kaliumfosfaat – Natriumcitraat
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.14. Neerslagen en complexen met zilver

- Info: Hoe kun je achtereenvolgens neerslagen en complexen vormen met zilverionen? Zoek de verschillende combinatie van tegenionen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 200 ml AgNO3 0.01 mol/l – 100 ml NaHCO3 0.1 mol/l – 100 ml NaOH 0.1 mol/l – 100 ml NaCl 0.1 mol/l – 100 ml NH3 0.1 mol/l – 100 ml KBr 0.1mol/l – 100 ml Na2S2O3 0.1 mol/l – 100 ml 0.1 mol/l KI – 100 ml Na2S 0.1 mol/l
- Thema: neerslagreacties
- Tijd: 30 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – complexreacties
2.15. Neerslagreactie via een gas
- Info: Hoe kunnen we een koperamine complex eenvoudig aantonen? Door een oplossing van koper(II)-ionen toe te voegen aan ammoniak
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4-oplossing (0,01 mol/l) – Geconcentreerde ammoniakoplossing
- Thema: neerslagreacties
- Tijd: 15 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – complexreacties
2.16. Reacties met loodionen
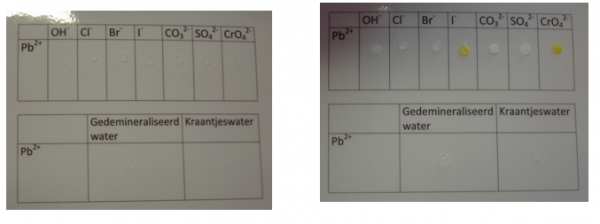
- Info: Hoe kunnen we verschillende neerslagen vormen met een lood(II)oplossing? Je zoekt de geschikte anionen die een neerslag vormen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1 mol/l – Pb(NO3)2 0,5 mol/l – KI 0,2 mol/l – NaCl 0,5 mol/l – KBr 0,2 mol/l – Na2CO3 0,5 mol/l – Na2SO4 0,5 mol/l – K2CrO4 0,2 mol/l
- Thema: neerslagreacties
- Tijd: 35 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.17. Stoichiometrische verhouding bepalen via neerslagvorming
- Info: Hoe kunnen we verschillende neerslagen vormen met een lood(II)oplossing? Je zoekt de geschikte anionen die een neerslag vormen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na0,1 mol/l CaCl2 (1,47 g CaCl2.2H2O in 100ml oplossing) – 0,1 mol/l Naoxalaat (1,34 g Na2C2O4 in 100ml oplossing) – 0,1 mol/l Na3PO4 (3,8 g Na3PO4.12H2O in 100 ml oplossing) – 0,1 mol/l Na-oleaat (3,04 g Na-oleaat in 100 ml oplossing)
- Thema: neerslagreacties – bouw van atomen
- Tijd: 35 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – wet van constante massaverhouding
2.18. Huid met zwarte thee

- Info: Hoe kunnen we een huid maken met zwarte thee? Na toevoegen van de oplossingen ontstaat een geribbelde huid.Dit ontstaat door reactie van thee met warm water en de ontstane polyfenolen met calciumionen. Door de aanwezigheid van zuurstof en bicarbonaationen ontstaan onoplosbare verbindingen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 builtje zwarte thee – Calciumdichloride (CaCl2) – Natriumwaterstofcarbonaat (NaHCO3) – Gedestilleerd water
- Thema: neerslagreacties – biochemie
- Tijd: 35 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.19. De bittere smaak van groene thee

- Info: Waarom smaakt groene thee bitter? De kleur is licht bruin tot gelig. De kleur wordt lichter als we langer wachten met het kalkwater toe te voegen. Polyfenolen worden neergeslaan, deze bepalen de bittere smaak.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 buidels groene thee – Calciumchloride – gedestilleerd water
- Thema: neerslagreacties – biochemie
- Tijd: 25 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – complexreacties
2.20. Neerslagen in een hydrogel

- Info: Wat gebeurt er met de ionen bij een neerslagreactie? Welke waarnemingen doe je wanneer je de volgende stoffen bij elkaar brengt in een gel? Vul een spuit met een oplossing die een zware metaalbinding bevat. Vul de andere spuit met een gelijke hoeveelheid reactant. Injecteer de oplossingen simultaan in de hydrogelbal.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH oplossing (1.0 mol/l) – FeCl3 oplossing (1.0 mol/l) Na2 CO3H2O oplossing (1.0 mol/l) – K4(Fe(CN)6) oplossing (1.0 mol/l) – K3(Fe(CN)6) oplossing (0.5 mol/l)
- Thema: neerslagreacties – biochemie
- Tijd: 25 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – complexreacties
2.21. Oplosbaarheid van sulfaten en carbonaten

- Info: Hoe verschilt de oplosbaarheid van sulfaten en carbonaten? De oplosbaarheid van een stof hangt niet enkel af van het anion, maar van de combinatie van het anion en kation. Lithium-, natrium-, magnesium-, calcium-verbindingen met sulfaationen lossen. Strontiumsulfaat en bariumsulfaatoplossingen zijn troebel. Lithium- en natrium-ionen vormen met carbonaationen geen neerslag. Magnesium-, calcium-, strontium- en barium- vormen een neerslag met carbonaationen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mg(NO3)2.6H2O-oplossing 0,5 mol/l – Ca(NO3)2.4H2O-oplossing 0,5 mol/l – Sr(NO3)2-oplossing 0,5 mol/l – Ba(NO3)2-oplossing 0,2 mol/l – LiBr-oplossing 1 mol/l – NaCl-oplossing 0,5 mol/l – KI-oplossing 0,1 mol/l – Na2CO3-oplossing 0,5 mol/l – Na2SO4-oplossing 0,5 mol/l
- Thema: neerslagreacties
- Tijd: 35 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.22. Loodjodide in een petrischaal

- Info: Wat gebeurt er wanneer je kaliumjodide en loodnitraat samenvoegt in een waterig milieu? Wat gebeurt er wanneer je een kaliumjodide-oplossing en een loodnitraatoplossing samenvoegt? Wat is het verschil tussen beiden proeven? Wanneer kaliumjodide en loodnitraat in contact komen met water, dissociëren ze in ionen. De gevormde ionen gaan zich recombineren waardoor er twee andere stoffen ontstaan, waaronder loodjodide dat de gele glitter vormt. Bij de eerste proef komen de twee oplossingen langzaam samen waardoor er fijne glitters gevormd worden. Bij de tweede proef voegt men de oplossingen gewoon samen, waardoor een grotere glitters/vlokken ontstaan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KI – Pb(NO3)2 – 0,2 mol/l KI – 0,1 mol/l Pb(NO3)2
- Thema: neerslagreacties
- Tijd: 35 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – diffusie
2.23. Olivijn

- Info: Als Olivijn in contact komt met water, onttrekt het CO2 uit het water en verweert het naar Silica en Mg/Fe Bicarbonaat
- Moeilijkheid: eenvoudig
- Chemische stoffen: Olivijn-zand – Bruiswater
- Thema: neerslagreacties
- Tijd: 15 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.24. Calciumsilicaat

- Info: Op welke manier kunnen we water ineens laten verdwijnen? Calciumhydroxide Ca (OH)2 reageert met natriumsilicaat Na2SiO3 en dit levert het onoplosbare calciumsilicaat CaSiO3 op. Dit is de reden waarom de oplossing direct in de lucht hardt!
- Moeilijkheid: eenvoudig
- Chemische stoffen: Glas water – Calciumhydroxide – waterglas
- Thema: neerslagreacties
- Tijd: 15 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.25. Chemisch rif

- Info: Hoe kunnen we diffusie visueel maken? In water lossen koper(II)sulfaat, kaliumhexacyanoferraat (II) en ammoniumijzer(III) sulfaat op en dissociëren in ionen. Deze ionen zijn niet stationair – ze verspreiden zich geleidelijk over de hele oplossing. Dit is een voorbeeld van diffusie.De ionen ontmoeten elkaar uiteindelijk en vormen kleurrijke, onoplosbare verbindingen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kopersulfaat (CuSO4) – K4(Fe(CN)6) – Petrischaal
- Thema: neerslagreacties – complexreacties
- Tijd: 15 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – diffusie
2.26. Neerslagen in een nunclonschaaltje maken
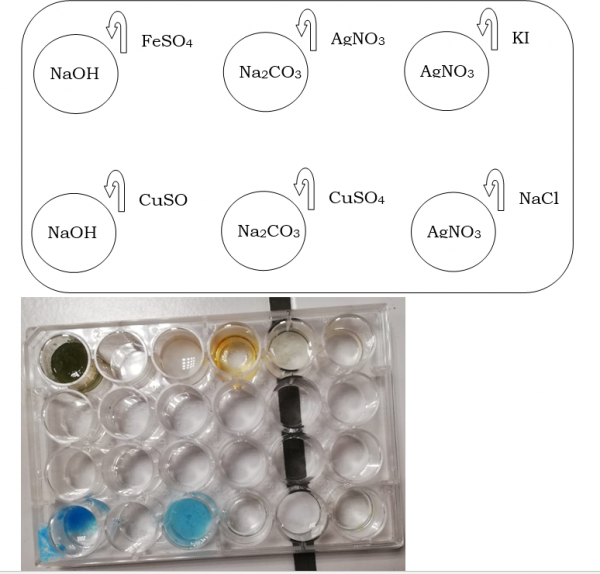
- Info: Hoe kunnen we aan de hand van een reactie voorspellen welke stoffen gaan neerslaan? Voeg de kationen bij de anionen en er ontstaan verschillende neerslagen
- Moeilijkheid: eenvoudig
- Chemische stoffen:AgNO3– Na2CO3 – NaCl – NaOH – KI – CuSO4 – FeSO4
- Thema: neerslagreacties
- Tijd: 25 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.27. Neerslagen van fosfaten

- Info: Hoe werkt de chemische behandelingsfase in een rioolwaterzuiveringsinstallatie?De twee stoffen (kaliumwaterstoffosfaat en ijzer (III) chloride ) reageren tot een in water onoplosbare, witte stof: ijzer (III) fosfaat . Deze stof nestelt zich op de bodem van de reageerbuis omdat het een hogere dichtheid heeft dan water .
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 spatelpuntje kaliumdiwaterstoffosfaat – 1 spatelpuntje ijzer(III)chloride
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.28. EscapeRoom via druppels op papier
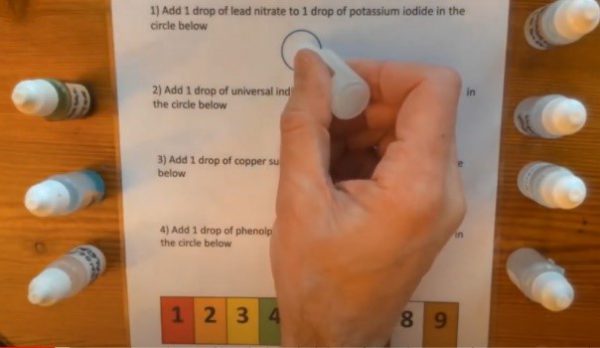
- Info: Hoe kun je via druppelreacties een escaperoom opbouwen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Pb(NO3)2-oplossing 1 mol/l – KI-oplossing 2 mol/l – HCl-oplossing 1 mol/l – CuSO4-oplosing 0,1 mol/l – NH3-oplossing 0,5 mol/l – Fft-oplossing 0,05% – NaOH-oplossing 0,1 mol/l
- Thema: neerslagreacties – complexreacties – neutralisatiereacties
- Tijd: 40 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – zuur-base indicator
2.29. Neerslag- en complexreacties in een hydrogel

- Info: Hoe kun je neerslagreacties vormen in een hydrogel? Je vormt complexen en neerslagen door toevoeging van geschikte anionen aan kationen
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 hydrogels – Natriumhydroxide (NaOH – 1 mol/l) – IJzer(III)chloride (FeCl3 – 0,1 mol/l) – Koper(II)sulfaat (CuSO4 0,1 mol/l) – Natriumsulfide (Na2S – 1mol/l) – Kaliumhexacyanoferraat(II) (K4Fe(CN)6 – 1 mol/l)
- Thema: neerslagreacties – complexreacties
- Tijd: 40 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.30. Neerslagen van transitie-elementen

- Info: Hoe reageren ionen van elementen uit de nevengroep met een hydroxide en met ammoniak
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)sulfaat (CuSO4) – Ammoniak (NH3 – 1mol/l) – Zinkchloride (ZnCl2 – 0,1 mol/l) – Natriumhydroxide (NaOH – 0,4 mol/l) – Mangaan(II)sulfaat (MnSO4 – 0,1 mol/l) – IJzer(II)sulfaat (FeSO4 – 0,1 mol/l) – IJzer(III)chloride (FeCl3 – 0,1 mol/l)
- Thema: neerslagreacties – complexreacties
- Tijd: 40 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
2.31. Stoichiometrie met calciumoxalaat

- Info: Hoe kunnen we op microschaalniveau molverhoudingen in een chemische reactie aantonen? Op basis van de hoeveelheid neerslag wordt gekeken welke de stoechiometrische verhouding is tussen Ca2+ en verschillende anionen telkens van een zelfde concentratie.De tegengestelde ionen worden in verschillende concentraties ten op zicht van elkaar gebracht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: CaCl2(aq) 0,1 mol/l – Na2C2O4(aq) 0,1 mol/l
- Thema: neerslagreacties – bouw van atomen
- Tijd: 20 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – wet van constante massaverhouding
2.32. Zeven reacties met zilverionen

- Info: Hoe kun je achtereenvolgens verschillende reacties uitvoeren in een zilverionenoplossing? Door gepaste neerslagreacties en complexreacties met de zilverionen uit te voeren
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zilvernitraat (AgNO3 – 1mol/l) – Natriumcarbonaat (Na2CO3 – 0,1mol/l) – Natriumhydroxide (NaOH – 0,4 mol/l) – Natriumchloride (NaCl – 0,1 mol/l) – Ammoniak (NH3 – 2 mol/l) – Kaliumbromide (KBr – 0,1 mol/l) – Natriumthiosulfaat pentahydraat (Na2S2O3 . 5 H2O – 0,1 mol/l) – Kaliumjodide (KI – 0,1 mol/l)
- Thema: neerslagreacties – complexreacties
- Tijd: 40 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
3. Oplosbaarheidsproduct
3.1. Bepaling van het oplosbaarheidsproduct van calciumhydroxide

- Info: Hoe kunnen we het oplosbaarheidsproduct van calciumhydroxide met een kleine titratie bepalen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: verzadigde oplossing van calciumdihydroxide – fft 1% in ethanol 95% – 100 ml 0,1 mol/l HCl –
- verzadigde calciumhydroxide oplossing
- Thema: neerslagreacties – neerslagtitratie
- Tijd: 40 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
3.2. Neerslag van calciumfosfaat

- Info: Hoe beïnvloedt natriumcitraat de reactie tussen een calciumchlorideoplossing, water en een kaliumfosfaatoplossing ? De citraationen bouwen met de calciumionen een stabiel complex. De concentratie van de vrije Ca-ionen daalt hierdoor zo sterk dat het oplosbaarheidsproduct van calciumfosfaat niet wordt overschreden waardoor neerslagvorming uitblijft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Calciumchloride dihydraat – Kaliumfosfaat – Natriumcitraat
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct
3.3. Oplosbaarheid van CO2 in cola

- Info: Gaat de CO2 van cola beter behouden blijven in een warmwaterbad of in een koudwaterbad? Bij de cola in het koudwaterbad ontsnapt er minder gas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: oplosbaarheid – invloed temperatuur
4. Vorming van organische neerslagen
4.1. Reactie tussen Baileys en Tonic

- Info: Het zuur (o.a. koolzuur ) dat aanwezig is in een frisdrank reageert met caseïne. Het caseïne treedt op als emulgator. Door deze emulgator af te breken scheiden polaire fase zich van apolaire fase. Baileys bevat room en in een zuur milieu vormt dat vlokken. Het zuur zorgt er ook voor dat de ‘melkcrème’ gaat schiften.Net zoals melk schift als je er citroensap aan toevoegt. Trouwens, als Baileys in de maag komt, gebeurt er net hetzelfde. De kinine in de tonic zit er voor niks tussen, want met fruitsap, limonade gebeurt hetzelfde.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 100 ml Baileys – 100 ml tonic
- Thema: neerslagreacties – biochemie
- Tijd: 10 min
- Begrippen: oplosbaarheid – inwerking op caseïne
4.2. Reactie tussen Cola en melk

- Info:Wat gaat er gebeuren wanneer men een mengsel van cola en volle melk maken? Melk is een emulsie van water met daarin onder andere vetten en eiwitten. Cola bestaat uit water met suiker, koolzuur, fosforzuur en kleurstof…Als je de melk bij de cola schenkt, ontstaat er schuim. De melk zorgt er dat het koolzuurgas in de cola sneller vrijkomt.Als de melk en de cola worden gemengd, dan reageren de eiwitten uit de melk en het fosforzuur uit de cola met elkaar. Bij deze chemische reactie klonteren ze samen en vormen ze vlokken
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola – Volle melk
- Thema: neerslagreacties – biochemie
- Tijd: 10 min
- Begrippen: oplosbaarheid – inwerking op caseïne
5. Complexreacties
5.1. Bewegingen in een petrischaal

- Info: Vul de petrischaal half met water. Breng aan één kant een spatelpunt K4Fe(CN)6, aan een andere zijde een spatelpunt NH4SCN en aan een derde zijde de FeCl3. Er ontstaat een rode en een blauwe linie en ook geen verkleuring.
- Moeilijkheid: gemiddeld
- Chemische stoffen: K4Fe(CN)6 – NH4SCN – FeCl3
- Thema: anorganische stoffen – chemische reacties – complexreacties – redoxreacties
- Tijd:30 min
- Begrippen: zouten – stofveranderingen – neerslagen
5.2. Blauw en oranje

- Info: Op welke manier katalyseren Cu(II)ionen de reactie tussen tartraat en zuurstofwater? Het tartraat reduceert Cu2+ tot het rode Cu+. Vervolgens wordt het Cu+ door het waterstofperoxide terug geoxideerd. Een deel van het tartraat valt daarbij uiteen in koolzuurgas en mierenzuur. Met soda wordt het aldus ontstane al te zure milieu wat geneutraliseerd waardoor ook weer het koper actief kan worden.
Uiteindelijk oxideert het peroxide al het tartraat. Op het eind kan men ook zwart koper(II)oxide in de beker waarnemen. - Moeilijkheid: gemiddeld
- Chemische stoffen: 110 ml ged. water (H2O) – 0,1 g Koper(II)sulfaat (CuSO4•5H2O) – 2,7 g Kaliumnatriumtartraat (KNaC4H4O6•4H2O) – 5 ml Waterstofperoxide 30% (H2O2) – 1 g Natriumcarbonaat (Na2CO3•nH2O) – KI oplossing 0,1 mol/l -CuSO4-oplossing 0,1 mol/l – Verzadigde Na2S2O3 oplossing
- Thema: Anorganische stoffen – redoxreacties – chemisch evenwicht – complexreactie
- Tijd: 30 min
- Begrippen: peroxiden – oscillerende reactie
5.3. Bloedende snijwonde
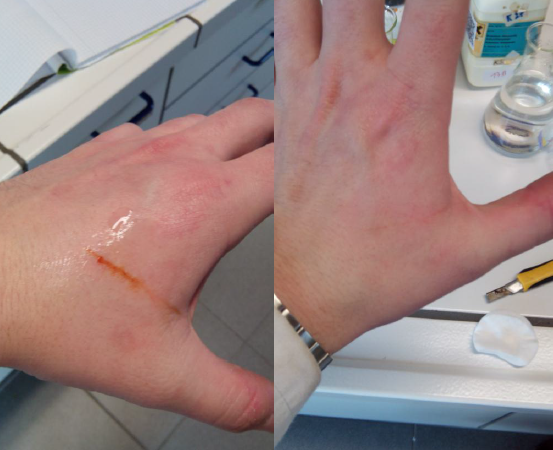
- Info: Hoe kunnen we een echte snijwonde simuleren in het labo en deze ook weer doen verdwijnen? Ijzerthiocyanaat is een stof met een rode kleur die veel wegheeft van de kleur van bloed. Het natriumfosfaat slaat het ijzer(III) neer en zorgt dat de reactie naar links beweegt. Deze stof reageert weg bij toevoeging van natriumfosfaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KSCN (3g op 100 ml) – FeCl3 (1 g op 100 ml) – Na3PO4.12H2O (10 g op 100ml)
- Thema: neerslagreactie – complexreactie
- Tijd: 20 min
- Begrippen: oplosbaarheidsproduct

- Info: Vormen van een rode neerslag en dan een blauw complex, hoe doe je dat?
- Moeilijkheid: eenvoudig
- Chemische stoffen: K4Fe(CN)6 – NH4SCN – FeCl3.6H2O
- Thema: neerslagreactie – complexreactie
- Tijd: 20 min
- Begrippen: oplosbaarheidsproduct
5.5. Chemische foto

- Info: Is er behalve stofomzetting een andere vorm van omzetting bij chemische reactie? Via verschillende oplossingen wordt op fotopapier een foto gevormd
- Moeilijkheid: moeilijk
- Chemische stoffen:fixeervloeistof – ontwikkelvloeistof
- Thema: chemische reacties – energetische aspecten –
- Tijd:80 min
- Begrippen: endo-energetische reacties – fotolyse – complexreacties
5.6. Complexvorming met citroenzuur

- Info: Hoe kunnen we een neerslag vormen met citroenzuur? Door het toevoegen van het citroenzuur verkrijgen we een vertroebeling van de oplossingen. Als we vervolgens de NaOH-oplossing toevoegen gaan we het citroenzuur neutraliseren waardoor de vertroebeling verdwijnt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuuroplossing 1 mol/l, – kopersulfaatoplossing 0,1 mol/l, – ijzer(III)oplossing 0,1 mol/l, – NaOH oplossing 3 mol/l
- Thema: neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.7. Complexvorming via een gas

- Info: Hoe kunnen we complexen vormen m.b.v. rodekool? Kaliumaluminiumsulfaat en ijzertrichloride vormen samen met rodekoolsap complexen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rodekoolsap – Magnesiumchloride – Aluin/aluminiumkaliumsulfaat – Ijzertrichloride
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct

- Info: Hoe kunnen we corrosie zichtbaar maken? De corrosie van een metaal is een redoxproces. Als metallisch ijzer oxideert wordt zuurstofgas of waterstofgas gereduceerd waarbij ferro-ionen en hydroxide ionen of waterstofgas gevormd worden. Als metalen op de een of andere manier met water in aanraking komen zal dus corrosie plaatsvinden. Op de manier waarop we dit experiment uitgevoerd hebben kunnen we corrosieprocessen zichtbaar maken. Als corrosie plaatsvindt verschijnt er een blauwe kleur bij de anodische gebieden door de reactie van de ferro-ionen met het kaliumferricyanide waarbij een diepblauw geleurde verbinding gevormd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gelatine – Nagel – Fenolftaleine – Kaliumferricyanide (K3Fe(CN)6)
- Thema: chemische reacties – neerslagreacties – corrosie
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct

- Info: Wat gebeurt er met de paars gekleurde oplossing van natriumkaliumtartraat en waterstofperoxide als we kobaltchloride toevoegen? Het Co2+ dient als katalysator en wordt tijdelijk geoxideerd tot Co3+ en dan terug tot Co2+.Bij de reactie ontstaan O2 en CO2 en zorgen in de oplossing voor een troebel.Indien de proef uitgevoerd wordt bij lage temperatuur, is de groene kleur langer zichtbaar
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200 ml natriumkaliumtartraat 0,3 mol/l; – 65 ml 6% H2O2; – 15ml CoCl2 oplossing 0,3 mol/l.
- Thema: anorganische stoffen – redoxreactie – chemisch evenwicht – neerslagreactie
- Tijd: 30 min
- Begrippen: zouten – oscillerende reactie – complexen
5.10. Geheime koperboodschappen

- Info:Hoe kunnen we een geheime koperboodschap schrijven? We stellen vast dat de kopersulfaatoplossing lichtblauw kleurt wanneer het in aanraking komt met ammoniak. Hierbij wordt koperhydroxide gevormd wat een blauwe kleur heeft.In het ammoniakexperiment worden de druppels CuSO4 geleidelijk donkerder blauw door vorming van Cu(OH)2 en dan donker blauw door vorming van Cu(NH3)42+.
- Moeilijkheid: eenvoudig
- Chemische stoffen:cAmmoniak (3% is genoeg)- Zeer verdunde kopersulfaatoplossing
- Thema: compexreactie- neerslagreactie
- Tijd: 30 min
- Begrippen: zouten
5.11. Groei van kristallen door osmose

- Info: Ferrocyanide ionen en de koperionen reageren ter vorming van een colloïdaal half permeabel membraan rond de kopersulfaat kristallen. Water beweegt door het membraan als de kopersulfaatcellen oplossen wat een verhoging van osmotische druk geeft in het membraan en de cellen doet vergroten.
- Moeilijkheid: niet zo eenvoudig
- Chemische stoffen: 100ml 3% K4Fe(CN)6.3H20 – 6-8 kleine kristallen kopersulfaat (kopspeld groot)
- Thema: stofeigenschappen – complexreacties
- Tijd: 10 min
- Begrippen: oplosbaarheid – osmose
5.12. Ijzerevenwicht

- Info: Ferrocyanide ionen en de koperionen reageren ter vorming van een colloïdaal half permeabel membraan rond de kopersulfaat kristallen. Water beweegt door het membraan als de kopersulfaatcellen oplossen wat een verhoging van osmotische druk geeft in het membraan en de cellen doet vergroten.
- Moeilijkheid: niet zo eenvoudig
- Chemische stoffen: FeCl3 0.2 g/100 ml – KSCN 0.2 g/100 ml – K4Fe(CN)6 1g/100 ml – tanninezuur 0.2 g/100 ml – salicylzuur 0.2 g/100 ml – EDTA 2g/100 ml
- Thema: stofeigenschappen – complexreacties – neerslagreacties
- Tijd: 30 min
- Begrippen: oplosbaarheid
5.13. Kerstbal maken

- Info:Hoe maak je je eigen spiegel?
- Moeilijkheid:gemiddeld
- Chemische stoffen: Salpeterzuur 70% – AgNO3 – KOH – Glucose – Ammoniak 35%
- Thema: enkelvoudige stoffen – redoxreacties – complexreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – zilverspiegel
5.14. Klein oerwoud in een bekerglas

- Info: Wat gebeurt er als we geel bloedloogzout en kopersulfaat in water samenvoegen? Het kopersulfaat verandert onmiddellijk van kleur, van blauw naar bruin, als het in de oplossing valt: koperhexacyanofereraat (II). Na ca. 20 minuten heeft zich op de bodem een soort “plant” . De oorspronkelijke bedekte kopersulfaatkristallen hebben zich omgezet in een bruine verbinding.
- Moeilijkheid: gemiddeld
- Chemische stoffen:Geel bloedloogzout (K4Fe(CN)6) – Kopersulfaat (CuSO4.5H2O)
- Thema: anorganische stoffen – chemische reacties – complexreacties
- Tijd: 30 min
- Begrippen: zouten – stofveranderingen – neerslagen – complexen
5.15. Kunstbloed

- Info: Hoe kunnen we een echte snijwonde simuleren in het labo en deze ook weer doen verdwijnen? Ijzerthiocyanaat is een stof met een rode kleur die veel wegheeft van de kleur van bloed. Het natriumfosfaat slaat het ijzer(III) neer en zorgt dat de reactie naar links beweegt. Deze stof reageert weg bij toevoeging van natriumfosfaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KSCN (3g op 100 ml) – FeCl3 (1 g op 100 ml) – Na3PO4.12H2O (10 g op 100ml)
- Thema: neerslagreactie – complexreactie
- Tijd: 20 min
- Begrippen: oplosbaarheidsproduct
5.16. Liesegangsche ring met hexaaminokobalt

- Info: Op welke manier ontstaan Liesegangse ringen? Reactie met vorming van een kobaltcomplex waar afhankelijk van concentratie een afzetting gebeurt
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine – CoCl2 – Geconcentreerde ammoniak
- Thema: anorganische stoffen – liesegangse ringen- chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – diffusie – complexreactie
5.17. Neerslag en complexen met zilver

- Info: Op welke manier ontstaan Liesegangse ringen? Reactie met vorming van een kobaltcomplex waar afhankelijk van concentratie een afzetting gebeurt
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200 ml AgNO3 0.01 mol/l – 100 ml NaHCO3 0.1 mol/l – 100 ml NaOH 0.1 mol/l – 100 ml NaCl 0.1 mol/l – 100 ml NH3 0.1 mol/l – 100 ml KBr 0.1mol/l – 100 ml Na2S2O3 0.1 mol/l – 100 ml 0.1 mol/l KI – 100 ml Na2S 0.1 mol/l
- Thema: anorganische stoffen – neerslagreacties
- Tijd: 40 min
- Begrippen: zouten – complexreactie
5.18. Synthese van Pruisisch blauw

- Info: Wat gebeurt er als we een oplossing van ijzerchloride en kaliumhexacyanoferraat samenvoegen? Het Pruisisch blauw wordt gevormd als neerslag.Pruisisch blauw is vooral bekend als een blauw pigment dat gebruikt wordt in verf en vroeger in blauwdrukken. Het staat bekend onder veel verschillende chemisch namen IJzer (III) ferrocyanide, ferri ferrocyanide, IJzer (III) hexacyanoferraat, en ferrihexacyanoferraat.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Ijzertrichloride – Kaliumhexacyanoferraat (ll)
- Thema: anorganische stoffen – neerslagreacties
- Tijd: 20 min
- Begrippen: zouten – complexreactie
5.19. Complexvorming rodekool

- Info: Hoe kunnen we complexen vormen m.b.v. rodekool? Kaliumaluminiumsulfaat en ijzertrichloride vormen samen met rodekoolsap complexen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rodekoolsap – Magnesiumchloride – Aluin/aluminiumkaliumsulfaat – Ijzertrichloride
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.20. Schrijven met thee, koffie en cacao

- Info: Hoe kan je een tekst schrijven met thee, koffie of cacao? Door toevoegen van ijzersulfaat ontstaat een zwarte oplossing die wordt aangedikt met de arabische gom. Hierdoor kan je schrijven. De geschreven tekst wordt donkerder na verloop van tijd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: thee – ijzer(II)sulfaat – arabische gom
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.21. Oplosbaarheid in water met vorming van ijzer(III)hexacyanoferraat

- Info: Hoe kunnen we 2 stoffen die niet reageren toch laten reageren? Je vormt uiteindelijk Pruisisch blauw complex
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzer(III)chloride – Kaliumhexacyanoferraat(II)
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.22. Schrijven met onzichtbare inkt

- Info: Welke reactie treedt er op en wat gebeurt er wanneer we koper(II)sulfaat en ammoniumcarbonaat samenvoegen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: blad papier – 0,5 mol/l CuSO4 oplossing – 0,5 mol/l (NH4)2CO3 oplossing
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.23. Wit-blauw reactie

- Info: Wat gebeurt er wanneer je ijzer(III)-ionen toevoegt aan zinkhexacyanoferraat(II)? Zinkionen vormen een geelachtige-witte neerslag met -ionen. Het oplosbaarheidsprodukt van zinkhexacyanoferraat is groter dan dat van ijzerhexacyanoferraat. Daarom wordt Berlijns blauw gevormd wanneer het ferri-ionen ontmoet.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1 mol/lK4Fe(CN)6 3 H2O – 0,1 mol/l ZnCl2 – 0,1 mol/l FeCl3
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.24.Geactiveerd complex

- Info: Hoe kunnen we diffusie visueel maken? In water lossen koper(II)sulfaat, kaliumhexacyanoferraat (II) en ammoniumijzer(III) sulfaat op en dissociëren in ionen. Deze ionen zijn niet stationair – ze verspreiden zich geleidelijk over de hele oplossing. Dit is een voorbeeld van diffusie.De ionen ontmoeten elkaar uiteindelijk en vormen kleurrijke, onoplosbare verbindingen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kopersulfaat (CuSO4) – K4(Fe(CN)6) – Petrischaal
- Thema: neerslagreacties – complexreacties
- Tijd: 15 min
- Begrippen: oplosbaarheid – oplosbaarheidsproduct – diffusie
5.25. Onzichtbaar koper

- Info: Hoe kunnen we een onzichtbare koperboodschap terug zichtbaar maken? De oplossing van ammoniumcarbonaat (NH4)2CO3 ontleedt in koolstofdioxide CO2 en een gas met een nogal onaangenaam geur – ammoniak NH3 gas. Ammoniakmoleculen (zoals bij andere gassen) kunnen het stuk papier doordringen met de geheime boodschap.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)sulfaat 1 mol/l – Ammoniumcarbonaat verzadigde oplossing
- Thema: chemische reacties – neerslagreacties
- Tijd: 20 min
- Begrippen: complexreacties – oplosbaarheidsproduct
5.26. Het bloedend hart

- Info: Hoe kunnen we ijzeren nagel laten “bloeden”? Het geconcentreerd zoutzuur samen met het waterstofperoxide zorgt voor een oxidatie van het Fe naar Fe2+. Waterstofperoxide zorgt ervoor dat het Fe2+ verder oxideert naar Fe3+. Het Fe3+ reageert met het thiocyanaation tot ijzer(III)thiocyanaat, wat een rood complex is.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 10 gram ammoniumthiocyanaat – Geconcentreerd zoutzuur – 3 % waterstofperoxide
- Thema: enkelvoudige stoffen – chemisch evenwicht – complexreactie
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – chemisch evenwicht – complexreactie
6. Gassen
6.1. Ammoniumchloride
6.1.1. Liesegangsche ringen met gassen
- Info: Hoe kunnen we imet zoutzuur en ammoniak liesegangse ringen maken?
- Moeilijkheid: gemiddeld
- Chemische stoffen: geconcentreerd ammoniak – geconcentreerd zoutzuur
- Thema: enkelvoudige stoffen – chemisch evenwicht – complexreactie
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – chemisch evenwicht – complexreactie
6.1.2. Salmiakrook in een doos

- Info: Kunnen we witte rook vormen met twee gassen? In de schoendoos wordt er witte rook gevormd, dit verdwijnt via het gat in de schoendoos. Er treedt een reactie op tussen ammoniak en zoutzuur, de gevormde witte rook is NH4Cl
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd ammoniak – Geconcentreerd zoutzuur
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 20 min
- Begrippen: zuren – reactie zuur en base
6.2. Koolstofdioxide
6.2.1. Aantonen van koolstofdioxide met kalkwater

- Info: Hoe kun je de aanwezigheid van koolstofdioxide aantonen? Neerslagreactie met kalkwater
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20ml koolstofdioxidegas – 3 tot 5 ml kalkwater
- Thema: Anorganische stoffen – neutralisatiereactie – neerslagreactie
- Tijd: 10 min
- Begrippen: zuren – reactie zuur en base
6.2.2. Bereiding van koolstofdioxide

- Info: Hoe kun je de koolstofdioxide bereiden? Door het gas op te vangen van de reactie tussen bakpoeder en tafelazijn
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,22 g vast NaHCO3 – 5ml azijn of 1M HCl – De hoeveelheid van natriumbicarbonaat levert ongeveer 60ml CO2 op.
- Thema: Anorganische stoffen – neutralisatiereactie – neerslagreactie
- Tijd: 10 min
- Begrippen: zuren – reactie zuur en base – gasvorming
6.2.3. Blaas het meeste koolstofdioxide

- Info: Hoe kun je de koolstofdioxide bereiden? Door fel blazen in kalkwater toon je dit gas aan. Door het blazen komt er koolstofdioxide (CO2) in het kalkwater. Het kalkwater bevat Ca(OH)2. Het gas reageert met dit calciumhydroxide en vormt het CaCO3 of calciumcarbonaat. Dit is vast te stellen door de vorming van een witte troebel. Bij het blijvend blazen lost de troebel terug op vermits het toegevoerde koolstofdioxide de oplossing ook gaat verzuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rietje – Kalkwater
- Thema: Anorganische stoffen – neutralisatiereactie – neerslagreactie
- Tijd: 10 min
- Begrippen: zuren – reactie zuur en base – gasvorming
6.2.4. Bruisballen maken

- Info: Hoe maak je zelf bruisballen? Het is mogelijk om zelf een bruisbal te maken. Door het gebruiken van een apolaire bindende vloeistof kunnen we de stoffen kneden en in een vorm duwen. En begint de bruisbal pas te bruisen en op te lossen in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumwaterstofcarbonaat – Maïzena – Citroenzuur – Zonnebloemolie – Etherische olie
- Thema: Anorganische stoffen – neutralisatiereactie – neerslagreactie
- Tijd: 10 min
- Begrippen: zuren – oplosbaarheid – gasvorming
6.2.5. Calciumcarbonaatfraktalen in kalkwater

- Info: Bij de reactie tussen calciumcarbonaat met zoutzuur ontstaat koolstofdioxide. Deze stijgt omhoog en bedekt ook het oppervlak van het kalkwater. Dit koolstofdioxide komt in contact met het verzadigde kalkwater en vormt hier een laag calciumcarbonaat.
- Moeilijkheid: gemiddeld
- Chemische stoffen: calciumcarbonaat – verzadigd kalkwater – zoutzuur 4M
- Thema: Anorganische stoffen – reacties tussen anorganische stofklassen
- Tijd: 25 min
- Begrippen: zouten– vorming van koolzuurgas – gasvormin
6.2.6. Construeer het strafste blusapparaat

- Info: Hoe kun je koolzuurgas maken om vuur te blussen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – gasvorming
6.2.7. Dansende rozijnen

- Info: Hoe kunnen we rozijnen laten dansen? Eerst bruist het mengsel hevig en zien we een hevige gasvorming. Na enkele ogenblikken stijgen de rozijnen en dalen ze weer. Zolang als er gas aanwezig is, blijven de rozijnen deze beweging maken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rozijnen – halve eetlepel soda – ¼ bekertje azijn
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen: zouten – vorming van koolstofdioxide – massadichtheid – gasvorming
6.2.8. Eitje wordt springbal

- Info: Hoe kunnen we een ei laten springen? De eierschaal is hoofdzakelijk opgebouwd uit kalk. Dit kalk is reageert met het tafelazijn. Het resultaat is dat slechts het vlies onder deze schaal overblijft. Door de permeabiliteit van dit vlies wordt tafelazijn opgenomen door diffusie en zal het ei verder opzwellen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een rauw ei – Tafelazijn
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen: zouten – vorming van koolstofdioxide – massadichtheid – gasvorming
6.2.9. Gistkanon

- Info:De gistcellen gaan in deze oplossing zich vermenigvuldigen en eveneens starten met de vergistingsreactie waarbij de suikers omgezet worden naar ethanol en koolstofdioxide. De gevormde koolstofdioxide gaat opstapelen boven de oplossing en door de hoger wordende gasdruk wordt de stop weggeschoten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: sucrose – gist
- Thema: gasvorming – biochemie
- Tijd: 20 min
- Begrippen:vorming van koolstofdioxide – gasvorming
6.2.10. Hoe kan je koolstofdioxide maken uit eierschalen?

- Info: Op welke manier kunnen we koolstof bereiden uit eierschalen? Eierschalen bevatten calciumcarbonaat. Dit gaat met magnesium koolstof vormen. Het wit licht dat tijdens de verbranding ontstaat, is afkomstig van het magnesium en de oranje vonkjes zijn afkomstig van het calciumcarbonaat in de eierschalen. Door verwarming gaat de reactie starten. Het mengsel gaat bij toevoeging van zoutzuur bruisen doordat er waarschijnlijk kleine hoeveelheden eierschalen en magnesium niet hebben gereageerd. Hierdoor kunnen ze nog een reactie aangaan met het zoutzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Droge eierschalen – Magnesiumpoeder – Zoutzuur 1mol/l
- Thema: gasvorming – biochemie – redoxreactie
- Tijd: 20 min
- Begrippen:vorming van koolstofdioxide – gasvorming
6.2.11. Hoe kunnen we de kaarsvlam doven?
- Info: Hoe kunnen we vuur blussen met koolstofdioxide? Een kaars kan niet verbranden in kooldioxide. Kooldioxide brandt niet. Een kaars kan in zuurstof verbranden. In feite is het zuurstof nodig (lucht bevat 21% zuurstof). Kooldioxide heeft een grotere dichtheid dan lucht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Spuit + slang – CO2
- Thema: gasvorming – redoxreactie
- Tijd: 20 min
- Begrippen:vorming van koolstofdioxide – verbranding
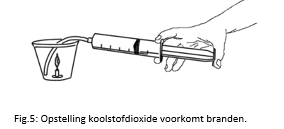
6.2.12. Koolstofdioxide voorkomt branden

- Info: Wat als koolzuurgas zuurstofgas vervangt boven een brandende kaars? Geleidelijk dooft de kaars
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2 (g), 50 ml – kaarsje
- Thema: Anorganische stoffen – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen:oxide -verbrandingsreactie
6.2.13. Koolstofdioxide en waterig natriumhydroxide

- Info: Calcium oxide reageert exothermisch met water en vormt Calciumdihydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2 (g), 50 ml – NaOH(aq), 6 mol/l, 10 mL
- Thema: Anorganische stoffen – chemische reactie – reactie stofklassen – gasvorming
- Tijd: 15 min
- Begrippen:oxide – stofklassen – reactie oxide en hydroxide
6.2.14. Koolstofdioxide koolzuur evenwicht
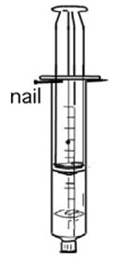
- Info: Hoe kun je het evenwicht van opgelost CO2 en CO2 aantonen? Door in spuit ijswater en het gas te brengen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ijswater – 40ml CO2
- Thema: Anorganische stoffen – chemisch evenwicht – gasvorming
- Tijd: 15 min
- Begrippen:oxide – oplosbaarheid gassen
6.2.15. Lanceer de sterkste bakpoederraket

- Info: Hoe kan je een raket het hoogst omhoog laten schieten door gebruik te maken van slechts 1 bruistablet?
- Moeilijkheid: eenvoudig
- Chemische stoffen: -bruistablet;
- Thema: anorganische stoffen – chemische reacties
- Tijd:25 min
- Begrippen: zouten – onderscheid fysisch en chemisch – gasvorming
6.2.16. Lanceer je bruistabletraket

- Info: Hoe kan je een raket het hoogst omhoog laten schieten door gebruik te maken van slechts 1 bruistablet? In bruistabletten zitten natriumwaterstofcarbonaat en citroenzuur. Als de bruistablet nat wordt, gaan deze twee stoffen met elkaar reageren. Er ontstaat bij de reactie koolstofdioxide.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Klein afsluitbaar plastic doosje (oud filmroldoosje) – Plakband – Stevig papier – Een half bruistablet – Ongeveer 10 ml water
- Thema: anorganische stoffen – chemische reacties
- Tijd:15 min
- Begrippen: zouten – onderscheid fysisch en chemisch – gasvorming
6.2.17. Maak je eigen brandblusapparaat

- Info: Kunnen we vuur blussen met bakpoeder?
- Moeilijkheid: eenvoudig
- Chemische stoffen: koffielepel bakpoeder – 40 ml tafelazijn – 20 ml ontsmettingsalcohol
- Thema: anorganische stoffen – chemische reacties
- Tijd:15 min
- Begrippen: zouten – onderscheid fysisch en chemisch – gasvorming
6.2.18. Magisch stijgende eieren

- Info: Kunnen we vuur blussen met bakpoeder? De bepalende factor in de proef is de massa van het ei en de concentratie van de HCl oplossing. Met een ei van 70g en 70ml HCl en 1000ml water begint het experiment na 10 minuten en duurt ongeveer 50 minuten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: twee eieren van 65-70g NaCl – 6mol/l HCl
- Thema: anorganische stoffen – chemische reacties
- Tijd:15 min
- Begrippen: zouten – onderscheid fysisch en chemisch – gasvorming
6.2.19. Magische kleurenwissel in een spuit

- Info:Een oplossing van broomthymolblauw met spuitwater verandert van kleur onder invloed van druk
- Moeilijkheid: eenvoudig
- Chemische stoffen: broomthymolblauw-indicatoroplossing – spuitwater – dun drankrietje
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd:25 min
- Begrippen: zouten – invloed van druk op evenwicht – gasvorming
6.2.20. Onderzoek bruisend mineraalwater

- Info: Is er CO2 aanwezig in bruisend mineraalwater? Er ontstaat een neerslag in het kalkwater als er CO2 vrijkomt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Flesje sprankelend mineraalwater Helder kalkwater
- Thema: anorganische stoffen – gasvorming
- Tijd:25 min
- Begrippen: zouten – identificatie koolzuurgas – gasvorming
6.2.21. Opname van koolstofdioxide door hydroxiden

- Info: De base zal reageren met het …CO2… uit de ballon.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KOH – NaOH – Ca(OH)2 – droog ijs
- Thema: anorganische stoffen – gasvorming
- Tijd:20 min
- Begrippen: reactie niet-metaaloxide en hydroxide – identificatie koolzuurgas – gasvorming
6.2.22. Reacties met koolstofdioxide

- Info: Wat gebeurt als we calciumcarbonaat gaan verwarmen? Calciumcarbonaat ontleedt bij voldoende verhitting in calciumoxide en kooldioxide te geven.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 marmer stukje
- Thema: anorganische stoffen – gasvorming
- Tijd:20 min
- Begrippen: ontleding zout – analysereactie
6.2.23. Schuimvorming

- Info: Hoe kunnen we aantonen dat aluminiumkaliumsulfaat een protonendonor is? Donor van protonen aan natriumwaterstofcarbonaat
- Moeilijkheid: eenvoudig
- Chemische stoffen:Aluminiumkaliumsulfaat – Natriumwaterstofcarbonaat – Gedestilleerd water
- Thema: Anorganische stoffen – neutralisatiereactie – gasvorming
- Tijd: 15 min
- Begrippen: zouten– protonendonor
6.2.24. Snel ijs

- Info: Hoe kunnen we ijs maken zonder diepvries? Doordat het droog ijs een temperatuur heeft van ongeveer -79°C bekomen we veel sneller ijs dan wanneer we het in de diepvries steken.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Blik verse slagroom – 0,5l melk – Suiker / Vanillesuiker – CO2-blusser
- Thema: Anorganische stoffen – neutralisatiereactie – gasvorming
- Tijd: 15 min
- Begrippen: zouten
6.2.25. Spontane endotherme reactie

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en citroenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd. Deze chemische reactie is een endo-energetische reactie.In het proefje is de vorming van het koolzuurgas de oorzaak van de voorstuwing
- Chemische stoffen: bakpoeder – vast citroenzuur watervrij
- Thema: chemische reacties – energetische aspecten – gasvorming
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
6.2.26. Tovertabletten

- Info: Wat gebeurt er met de pH wanneer we een bruistablet oplossen ? De pH gaat dalen. Kleurverandering naar het gele toe. Door de productie van CO2 gaat de pH dalen, hierdoor gaat de pH omslaan waardoor we een gele kleur krijgen.De meeste tabletten bevatten citroenzuur als vast zuur.Citroenzuur reageert met natriumwaterstofcarbonaat.Hierbij daalt de pH van broomthymolblauw : geel (pH6) –blauw (pH 7,6).
- Chemische stoffen: Bruistablet – Broomthymolblauwoplossing
- Thema: chemische reacties – energetische aspecten – gasvorming
- Tijd: 20 min
- Begrippen: zuur-base indicator
6.2.27. Uitlaatgassen van auto

- Info: Uitlaatgassen van auto’s bevatten welk gas? Ca(OH)2 is een indicator voor CO2. Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig. Wanneer de oplossing troebel wordt, is er CO2 aanwezig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een staal van autouitlaatgas – Calciumdihydroxide ( Ca(OH)2)
- Thema: organische stoffen – redoxreacties – gasvorming
- Tijd: 25 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
6.2.28. Welk gas ademen we uit?

- Info: Welk gas ademen we uit? Ca(OH)2 is een indicator voor CO2. Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig. Wanneer de oplossing troebel wordt, is er CO2 aanwezig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rietje – Kalkwater
- Thema: Anorganische stoffen – chemische reactie – reactie stofklassen – gasvorming
- Tijd: 15 min
- Begrippen:oxide – stofklassen – reactie oxide en hydroxide
6.2.29. Welk gas ontstaat er door thermolyse van bakpoeder?

- Info: Welk gas ontstaat er door thermolyse van bakpoeder? Aantonen dat koolstofdioxide ontstaat
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder (NaHCO3) – kalkwater
- Thema: anorganische stoffen – chemische reacties – energetische aspecten – gasvorming
- Tijd: 20 min
- Begrippen: zouten – endo-energetische reacties – thermolyse – ontledingsreactie – identificatie koolstofdioxide
6.2.30. Welk gas ontstaat er door verbranding van een kaars?

- Info: Welk gas ontstaat er door verbranding van een kaars? Ca(OH)2 is een indicator voor CO2. Wanneer de oplossing doorzichtig blijft, is er geen CO2 aanwezig. Wanneer de oplossing troebel wordt, is er CO2 aanwezig.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Nagel – Theelichtje – Kalkwater
- Thema: organische stoffen – redoxreacties – gasvorming
- Tijd: 15 min
- Begrippen: koolwaterstoffen – verbrandingsreactie
6.2.31. Zuurgraad van koolstofdioxide

- Info: Hoe met de zuurheid van koolstofdioxide een regenboog maken en dit met de universele indicator? Initieel is de indicator basisch gemaakt met een verdunde NaOH-oplossing. Het resultaat is een blauwe kleur. Bovenaan wordt nu koolstofdioxideKooldioxide vormt koolzuur in water. Sommigen reageren met water dat het bicarbonaation, HCO3– (aq) vormt
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniakoplossing – Water – Universeelindicator
- Thema: neutralisatiereactie – gasvorming
- Tijd: 25 min
- Begrippen: zuur-base indicator – titratie
6.2.32. Aanduiden koolzuurgas in cola

- Info: Hoe tonen we aan dat er koolzuurgas in cola zit? De vrijgezette gassen lossen op in de bariumhydroxide oplossing en vormen een neerslag. Deze neerslag toont CO2 aan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: bariumhydroxideoplossing – cola
- Thema: neerslagreactie – gasvorming
- Tijd: 25 min
- Begrippen: identificatie koolzuurgas
6.2.33. Oplosbaarheid van CO2 in cola

- Info: Gaat de CO2 van cola beter behouden blijven in een warmwaterbad of in een koudwaterbad? Bij de cola in het koudwaterbad ontsnapt er minder gas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola – Water 50 graden – Water kamertemperatuur
- Thema: oplosbaarheid
- Tijd: 25 min
- Begrippen:invloed temperatuur op oplosbaarheid van gas
6.2.34. Bereiding en eigenschappen van koolstofdioxide

- Info: Hoe kunnen we CO2 aantonen? Een neerslag is een onoplosbare vaste stof die wordt gevormd uit een waterige oplossing. Gewoonlijk worden precipitaten waargenomen als een troebel in de oplossing of als gesuspendeerde deeltjes. Uiteindelijk vestigen ze zich op de bodem.De neergeslagen stof is calciumcarbonaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 mL CO2 – 3 – 5 mL kalkwater
- Thema: neerslagvorming – gasvorming
- Tijd: 15 min
- Begrippen: identificatie koolzuurgas
6.2.35.Reactie van koolstofdioxide met kalkwater
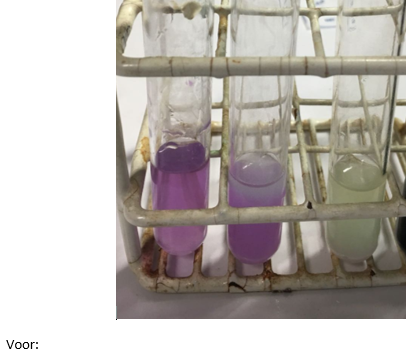
- Info: Welke veranderingen gebeuren er als je koolstofdioxide en kalkwater mengt? Hoe beïnvloedt de hoeveelheid koolstofdioxide de reactie? Reactie volgen met universele indicator
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universeelindicator – Kalkwater – Azijn – Bakpoeder
- Thema: neerslagvorming – gasvorming – neutralisatiereactie
- Tijd: 15 min
- Begrippen: identificatie koolzuurgas – zuur-base indicator
6.2.36. De baby-ademmachine

- Info: Wat is het verschil in CO2-gehalte tussen in- en uitgeademde lucht? In fles 2 komt uitgeademde lucht. De CO2 uit de uitgeademde lucht reageert met het kalkwater waardoor het troebel wordt.
Fles 1 blijft ongewijzigd omdat er in ingeademde lucht amper CO2 zit. - Moeilijkheid: eenvoudig
- Chemische stoffen: Kalkwater
- Thema: neerslagvorming – gasvorming – neutralisatiereactie
- Tijd: 25 min
- Begrippen: identificatie koolzuurgas – zuur-base indicator
6.2.37. De reactie van koolstofdioxide met water

- Info: Wat gebeurt er met het volume gas wanneer je 2 keer een bruistablet in de maatcilinder na elkaar brengt? Een bruistablet bestaat doorgaans uit natriumwaterstofcarbonaat en een zuur zoals barnsteenzuur of citroenzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 bruistabletten
- Thema: neerslagvorming – gasvorming
- Tijd: 25 min
- Begrippen: oplosbaarheid van gassen
6.2.38. Marmeronderzoek

- Info: Wat gebeurt als we calciumcarbonaat gaan verwarmen? Als men calciumcarbonaat gaat verhitten, ontleedt het in calciumoxide en koolstofdioxide. Het calciumcarbonaatblokje brokkelt af tot poeder.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 marmer stukje
- Thema: chemische reactie – gasvorming
- Tijd: 25 min
- Begrippen: ontledingsreactie
6.2.39. Reactie tussen zuren en carbonaten

- Info: Wat gebeurt er wanneer we zuren en carbonaten met elkaar laten reageren? Hoe kun je hieruit afleiden dat de samenstelling van schoolkrijt verschillend kan zijn? Bij een reactie tussen de meeste zuren en carbonaten ontstaat er CO2, H2O en een zout. We kunnen de gasvorming van CO2 waarnemen door de belletjes.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl opl. 1 mol/l, – 2 soorten krijt (een op basis van CaCO3 en een van CaSO4), – NaHCO3 en Na2CO3
- Thema: chemische reactie – gasvorming – neutralisatiereactie
- Tijd: 20 min
- Begrippen: gasvorming – identificatie
6.2.40. Poeder verdwijnt spoorloos

- Info: Welke reactie treedt er op en wat gebeurt er wanneer we ammoniumcarbonaat verwarmen? (NH4)2CO3 ontleedt en vormt andere kleinere gasmoleculen: H2O, CO2 en NH3.
- Moeilijkheid: eenvoudig
- Chemische stoffen: (NH4)2CO3 vast poeder
- Thema: chemische reactie – gasvorming
- Tijd: 20 min
- Begrippen: gasvorming – ontleding
6.2.41. Natuurlijke kalkafzetting gesimuleerd

- Info: Welke reactie treedt er op en wat gebeurt er wanneer we kalkwater en koolstofdioxide samenbrengen in een afgesloten systeem? Tussen het kalkwater(Ca(OH)2) en het koolzuurgas(CO2), afkomstig van koolzuur(H2CO3), treedt er een neutralisatie reactie op. De base Ca(OH)2 en het zuur CO2 reageren samen tot de vorming van een zout CaCO3 en water H2O.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kalkwater (verzadigde oplossing van Ca(OH)2) – bakpoeder (NaHCO3) – tafelazijn (CH3COOH) – universele indicator
- Thema: chemische reactie – gasvorming – neutralisatiereactie
- Tijd: 20 min
- Begrippen: gasvorming – zuur-base indicator
6.2.42. Oplosbaarheid van CO2

- Info: Welke reactie treedt er op en wat gebeurt er wanneer we kalkwater en koolstofdioxide samenbrengen in een afgesloten systeem? CO2 lost beter op in water onder gewone druk dan onder onderdruk. Bij de spuit onder onderdruk zie je belletjes ontstaan in de vloeistof zelf. Deze belletjes zijn het opgeloste gas (CO2) dat weer uit die oplossing komt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: wasknijper of nagel – bakpoeder (NaHCO3) -) azijn (CH3COOH) – universele indicator
- Thema: chemische reactie – gasvorming – oplosbaarheid
- Tijd: 20 min
- Begrippen: invloed van druk op de oplosbaarheid
6.2.43. Diffusie van koolstofdioxide en zwaveldioxide in alginaatballetjes

- Info: Wat gebeurt er met de alginaatballetjes wanneer je ze in contact brengt met de reactie tussen NaHCO3 en azijn?Wat gebeurt er met de alginaatballetjes wanneer je ze in contact brengt met de reactie tussen NaHSO3 en H2SO4?Wat kan je besluiten als je beiden met elkaar vergelijkt? Met behulp van indicatoralginaatballetjes kan men besluiten dat bij de reactie tussen NaHCO3 en azijn het zure gas koolstofdioxide wordt gevormd. Bij de reactie tussen NaHSO3 en H2SO4 wordt er ook het zure gas zwaveldioxide gevormd. Verder kan men besluiten dat zwaveldioxide een zuurder gas is dan koolstofdioxide.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaHCO3 – azijn – NaHSO3 – 1 H2SO4-oplossing – alginaatballetjes met universeelindicator
- Thema: chemische reactie – gasvorming
- Tijd: 30 min
- Begrippen: zuur-base indicator – diffusie
6.2.44. Eitje wordt springbal

- Info: Hoe kunnen we een ei laten springen? De eierschaal is hoofdzakelijk opgebouwd uit kalk. Dit kalk is reageert met het tafelazijn. Het resultaat is dat slechts het vlies onder deze schaal overblijft. Door de permeabiliteit van dit vlies wordt tafelazijn opgenomen door diffusie en zal het ei verder opzwellen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een rauw ei – Tafelazijn
- Thema: chemische reacties – anorganische stoffen – stofeigenschappen
- Tijd: 20 min
- Begrippen: zouten – vorming van koolstofdioxide – massadichtheid – gasvorming
6.2.45. Verbranding van een kaars stoppen door het verdringen van lucht

- Info: Welk gas verdringt lucht door verbranding van een kaars? De vlam van het theelichtje heeft O2 nodig, dus dooft de vlam wanneer O2 volledig heeft gereageerd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kalkwater
- Thema: chemische reacties – stofeigenschappen
- Tijd:15 min
- Begrippen: vorming van koolstofdioxide – massadichtheid – gasvorming
6.2.46. Krijtcocktail maken

- Info: Welk gas veroorzaakt het schuim in mijn cocktail? Door de reactie van citroenzuur en krijtpoeder ontstaat er CO2. Ca(OH)2 is een indicator voor CO2.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Citroenzuur – Krijtpoeder – Water – Kalkwater – Detergent
- Thema: chemische reacties – gasvorming – neerslagreactie
- Tijd:15 min
- Begrippen: vorming van koolstofdioxide
6.2.47. CO2 opnamen door algen en plankton

- Info: Door de CO2 van het bruiswater in de flessen heeft het een lage/ pH. Na een aantal minuten stijgt/ de pH van het water met het fytoplankton. Dit duidt aan dat de planten het oplosbaar CO2 opnemen/
- Moeilijkheid: eenvoudig
- Chemische stoffen:Jonge fytoplankton cultuur in een fles – Bruiswater
- Thema: chemische reacties – gasvorming – biochemie
- Tijd:25 min
- Begrippen: opname van koolstofdioxide
6.2.48. Onderzoek uitgeademde lucht

- Info: Bevat uitgeademde lucht CO2? De universeelindicator wordt geel-groen als ze in een zure omgeving is en is paars als ze in een basisch milieu is.Er is CO2 aanwezig in uitgeademde lucht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een rietje – Universeelindicator – NaOH oplossing 0.1 mol/l
- Thema: chemische reacties – gasvorming – neutralisatiereactie
- Tijd:25 min
- Begrippen: zuur-base indicator
6.2.49. Invloed van temperatuur op de oplosbaarheid van CO2

- Info: Wat is het effect van temperatuur op de oplosbaarheid van CO2 in water? Hoe hoger de temperatuur, hoe beter vaste stoffen oplossen, maar hoe slechter gassen oplossen.Hoe lager de temperatuur, hoe beter gassen oplossen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijs – Fenolftaleïne – Natriumhydroxide 0,1M
- Thema: chemische reacties – gasvorming – neutralisatiereactie – oplosbaarheid
- Tijd:25 min
- Begrippen: zuur-base indicator – invloed temperatuur op oplosbaarheid
6.2.50. Hoe kunnen we brand zelf blussen met een chemische reactie?

- Info: Hoe blussen we een brand met een chemische reactie? Omdat we bij het uitgieten van het CO2-gas de zuurstof wegnemen bij de vlam, zullen al de kaarsen doven.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rode kleurstof – Citroensap – Bakpoeder
- Thema: chemische reacties – gasvorming
- Tijd:25 min
- Begrippen: massadichtheid
6.2.51. Citroenvulkaan

- Info: Wat ontstaat er bij de reactie tussen bakpoeder en citroensap? In het proefje is de vorming van het koolstofdioxide de oorzaak van het bruisen. Omdat er een gas gevormd wordt, is er sprake van een gasontwikkelingsreactie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 koffielepel bakpoeder of maagzout – 40 ml tafelazijn
- Thema: chemische reacties – gasvorming
- Tijd:15 min
- Begrippen: vorming van koolzuurgas
6.2.52. Kalkwater als CO2 – indicator

- Info: Hoe kunnen we aantonen dat er meer koolstofdioxide zit in uitgeademde dan in ingeademde lucht? Kalkwater is een indicator voor koolstofdioxide. Bij voldoende koolstofdioxide kunnen we dat aantonen doordat het kalkwater troebelwit wordt Door deze wasfles adem ik de lucht in en hier blaas ik de lucht weer uit door het kalkwater.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kalkwater
- Thema: chemische reacties – gasvorming – neerslagreactie
- Tijd:25 min
- Begrippen: vorming van koolzuurgas – identificatie
6.2.53. De chemische auto

- Info: Hoe kunnen we een speelgoedautootje laten rijden met citroenzuur en bakpoeder? In deze reactie word een gas gevormd. Het gevormde gas is koolstofdioxide. Koolstofdioxide is een kleurloos gas. Een reactie waarbij een gas gevormd wordt noemen we een gasontwikkelingsreactie. We merken dat de auto begint te rijden zodra de duimspijker uit de dop is gehaald. Als je je oor bij het gat houdt, hoor je dat er een gas ontsnapt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: natriumbicarbonaat – citroenzuur
- Thema: chemische reacties – gasvorming
- Tijd:25 min
- Begrippen: vorming van koolzuurgas – invloed van druk
6.2.54. Muziek ijs

- Info: Hoe hoor je dat droogijs sublimeert bij kamertemperatuur? Het droog ijs sublimeert, het contact met de lepel gaat ervoor zorgen dat dit sneller gebeurt en dat de gasbelletjes door kleinere ruimtes moeten om te kunnen ontsnappen, hierdoor ontstaat er een geluid.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Droogijs
- Thema: stofeigenschap – gasvorming
- Tijd:15 min
- Begrippen: sublimatie
6.2.55. Suctiekrachten

- Info:Hoe kunnen we een glazen plaat met gewicht optillen, zonder het zelf aan te raken? Nadat de verbranding van de kaars is gedoofd, is er een drukverschil ontstaan, tussen de lucht in het glas en de lucht errond buiten. Door de verbranding is het zuurstofgas weg gereageerd en hierdoor ontstaat onder het glas een onderdruk. Het glas gaat dus “ vastzitten” aan het vochtige papier dat hierdoor vast hangt aan de glazen plaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Glas – Kaars – Waterfles
- Thema: stofeigenschap – gasvorming
- Tijd:25 min
- Begrippen: onttrekken van gas- chohesiekracht
6.3. Stikstofdioxide
6.3.1. Proeven met stikstofdioxide

- Info: Hoe kunnen we in een kleine opstelling stikstofdioxide bereiden? Welke reacties zijn uit te voeren. Vorming met koper en salpeterzuur. Verder kunnen eigenschappen worden opgespoord.
- Moeilijkheid: gemiddeld
- Chemische stoffen: HNO3 5 mol/l – Universele indicator – KI 0,2 mol/l – KBr 0,2 mol/l – KIO3 0,1 mol/l – KBrO3 0,1 mol/l – NH3 3 mol/l – Koperkrullen
- Thema: Anorganische stoffen – redoxreacties – gasvorming -neutralisatiereactie
- Tijd: 25 min
- Begrippen: identificatie gas – oxidatie – zuur-base indicator
6.3.2. Bereiding van stikstofdioxide
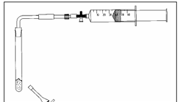
- Info: Hoe kunnen we in een kleine opstelling stikstofdioxide bereiden? Door reactie tussen bariumnitraat en ureum.
- Moeilijkheid: gemiddeld
- Chemische stoffen: bariumnitraat (watervrij) – ureumoplossing (c = 2 mol / l)
- Thema: Anorganische stoffen – organisch stoffen – gasvorming
- Tijd: 25 min
- Begrippen: oxiden – reactie met zout en ureum
6.4. Stikstofgas
6.4.1. Geheime boodschappen met ammoniumdichromaat

- Info: Hoe kan men stikstofgas verkrijgen uit ammoniumdichromaat? Door het verwarmen van ammoniumdichromaat, ontstaat er door ontleding stikstofgas, chroomoxide en water.
- Moeilijkheid: gemiddeld
- Chemische stoffen: ammoniumdichromaat – gedestilleerd water
- Thema: enkelvoudige stoffen – redoxreactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – gasvorming door redoxreactie
6.4.2. Variërend bruisen

- Info: Hoe kunnen we een pulserende gasoplossing maken? Het oscilleren van het bruisen bij deze reactie: evenwichten tussen oplossingen, condensatiekernen, kleine en grote belletjes en gasvormig stikstof.Doordat er nog steeds stikstof gevormd wordt, groeien de kerntjes uit tot kleine belletjes en die weer tot grotere die bruisend stikstof uit de oplossing drijven. Nu is de oplossing niet meer verzadigd; de bellen stijgen op en verdwijnen, en nieuw gevormde stikstof lost op tot de oplossing verzadigd raakt, et cetera. Als de stoffen nagenoeg zijn opgebruikt, wordt de vorming van stikstof te traag voor het oscillerend effect.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zoutzuur (2 mol/l) – Ammoniumchloride – Natriumnitriet – Gedestilleerd water
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht – gasvorming
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
6.5. Waterstofgas
6.5.1. Bereiding van waterstofgas

- Info: Hoe kunnen we waterstofgas bereiden?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Mg lint – HCl 2mol/l
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks metalen – reactie metaal en zuur
6.5.2. Explosie van een ei

- Info: Breng wat waterstofgas in een uitgeblazen ei door het op een proefbuis met HCl 3M en Zn poeder te zetten. Steek het op afstand aan met een lont.
- Moeilijkheid: eenvoudig
- Chemische stoffen: uitgeblazen ei – waterstofgas
- Thema: chemische reacties – energetische aspecten – gasvorming
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – knalgas
6.5.3. Migratie van waterstof is sneller dan lucht

- Info: Het waterstofgas is in staat te migreren door de ballon
- Moeilijkheid: eenvoudig
- Chemische stoffen: ballon van 25cm diameter – elastieken – waterstofgas 60ml
- Thema: enkelvoudige stoffen – stofeigenschappen
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – diffusie
6.5.4. Reductie van diijzertrioxide met waterstofgas

- Info: Welke reactie treedt op tussen roest en waterstofgas? Er ontstaat waterstofgas
- Moeilijkheid: eenvoudig
- Chemische stoffen: 40ml waterstofgas – 0,25 g Fe2O3 – Magneet
- Thema: enkelvoudige stoffen – redoxreactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks metalen
6.5.5. Verschijnen en verdwijnen van een kaarsvlam met waterstofgas

- Info: Hoe beïnvloedt kokend water de verbranding van magnesiumlint? Verhit magnesium reageert met water waarin zuurstof gebonden zit. Magnesium is onedeler dan waterstof
- Moeilijkheid:gemiddeld
- Chemische stoffen: HCl 2 mol/l 5ml- 1 cm Mg lint
- Thema: enkelvoudige stoffen – redoxreacties
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – spanningsreeks van metalen – verbrandingsreactie
6.6. Waterstofsulfide
6.6.1. Reacties met waterstofsulfide
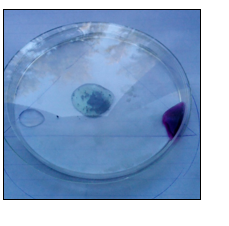
- Info:Identificatiereacties van waterstofsulfide
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 1 mol/l – Pb(NO3)2 0,5 mol/l – KMnO4 0,01 mol/l – AgNO3 0,2 mol/l – H2SO4 1 mol/l – ZnS poeder
- Thema: Anorganische stoffen – neerslagreactie – redoxreactie – gasvorming
- Tijd:20 min
- Begrippen: zuren -identificatie – identificatiereactie
6.7. Zuurstofgas
6.7.1. Bereiding van zuurstofgas
- Info: Hoe kan je zuurstofgas maken? Je kan zuurstofgas maken door gebruik te maken van MnO2, H2O2 en KI. Deze laatste treedt op als katalysator.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,05 g KI – 5 ml 6% H2O2 – spatelpunt MnO2– poeder
- Thema: enkelvoudige stoffen – redoxreactie – gasvorming
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – katalysator – ontledingsreactie
6.8.2. Exotherme reactie met gedroogde gist

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van
gist.Het gist bevat namelijk het katalase enzyme. - Moeilijkheid: eenvoudig
- Chemische stoffen: 1 pakketje of koffielepel gedroogde gist- 5% H202
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – katalyse
6.8.3. Identificatie van zuurstof

- Info: Hoe kan je aantonen dat er na een reactie, zuurstofgas is gevormd? Met behulp van een houtenspaander/lucifer kan men aantonen dat er zuurstofgas gevormd is. Deze houtenspaander/lucifer zal meer vlam vatten wat te wijten is aan een hogere concentratie zuurstof. Bij de verbranding wordt er CO2 gevormd.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 30 ml zuurstofgas – 2 ml kalkwater
- Thema: enkelvoudige stoffen – redoxreactie
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – identificatiereactie zuurstofgas – verbrandingsreactie
6.8.4. Maak de meeste olifantenpasta

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van
gist.Het gist bevat namelijk het katalase enzyme. - Moeilijkheid: eenvoudig
- Chemische stoffen: KI-oplossing (10 g in 10 ml water); – detergent; – gedestilleerd water; – H2O2 (30%).
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – katalyse
6.8.5. Olifantenpasta voor kinderen

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van
gist.Het gist bevat namelijk het katalase enzyme. - Moeilijkheid: eenvoudig
- Chemische stoffen: 10% H202 oplossing (eventueel te bekomen bij de apotheker. Let wel dat de oplossing redelijk vers is en minstens een 6% H2O2 )bevat – Actieve gist – Vloeibaar afwasmiddel
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – katalyse
6.8.6. Reactie tussen zuurstofgas en methyleenblauw
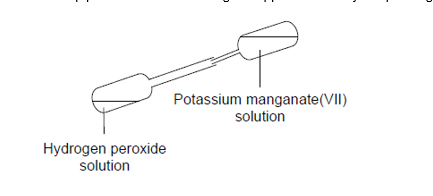
- Info:Eerst ontstaat in de pipet door reactie tussen H2O2 en KMnO4 O2 gas. De kleurloze oplossing van methyleenblauw wordt terug blauw door contact met zuurstofgas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: H202 – 5%KMnO4 0,1 mol/l – Methyleenblauwoplossing – Glucose
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – katalyse
6.8.7. Produceren van zuurstofgas
- Info: Hoe kunnen we aantonen dat we te maken hebben met een katalysator? Hoe kan ik gemakkelijk een katalysator terug uit een vloeistof halen? Doordat er niets gebeurd is met de korrel (niet opgelost of poreus geworden) heb je aangetoond dat MnO2 een katalysator is in deze reactie. Doordat de MnO2 in de korrel zit kan je door het decanteren van H2O2 de MnO2 makkelijk terug uit de vloeistof halen en ze steeds weer hergebruiken
- Moeilijkheid: eenvoudig
- Chemische stoffen: 4 ml 5% H2O2 – een korrel van 1: 1 cement met MnO2
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – gasvorming
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – katalyse
6.9. Zwaveldioxide
6.9.1.Reacties met zwaveldioxide

- Info: Hoe kunnen we neutralisaties en redoxreacties visualiseren in een petrischaaltje?Verschillende reacties met zwaveldioxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1g Na2S2O5 – 1mol/l HCl – 0,1mol/l NaOH + universele indicatorvloeistof – 1 mol/l BaCl2 – 0,02mol/l KMnO4 – 0,1 mol/l I2 – Blauw lakmoespapier – Rode kool
- Thema: Anorganische stoffen – redoxreacties – neutralisatiereacties – gasvorming
- Tijd: 20 min
- Begrippen: oxiden – identificatiereactie van zwaveldioxiden – niet-metaaloxide
6.9.2. Diffusie van koolstofdioxide en zwaveldioxide in alginaatballetjes

- Info: Wat gebeurt er met de alginaatballetjes wanneer je ze in contact brengt met de reactie tussen NaHCO3 en azijn?Wat gebeurt er met de alginaatballetjes wanneer je ze in contact brengt met de reactie tussen NaHSO3 en H2SO4?Wat kan je besluiten als je beiden met elkaar vergelijkt? Met behulp van indicatoralginaatballetjes kan men besluiten dat bij de reactie tussen NaHCO3 en azijn het zure gas koolstofdioxide wordt gevormd. Bij de reactie tussen NaHSO3 en H2SO4 wordt er ook het zure gas zwaveldioxide gevormd. Verder kan men besluiten dat zwaveldioxide een zuurder gas is dan koolstofdioxide.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaHCO3 – azijn – NaHSO3 – 1 H2SO4-oplossing – alginaatballetjes met universeelindicator
- Thema: chemische reactie – gasvorming
- Tijd: 30 min
- Begrippen: zuur-base indicator – diffusie
6.9.3. Bereiding en eigenschappen van zwaveldioxide

- Info: Hoe kunnen we SO2 aantonen? Door verschillende identifcatiereacties uit te voeren
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumsulfiet – Zwavelzuur (1 mol/l) – Universeelindicator – Kaliumpermanganaat – Broomwater
- Thema: chemische reactie – gasvorming -redoxreactie – neutralisatiereactie
- Tijd: 30 min
- Begrippen: zuur-base indicator
6.9.4. Luchtverontreiniging met zwaveldioxide
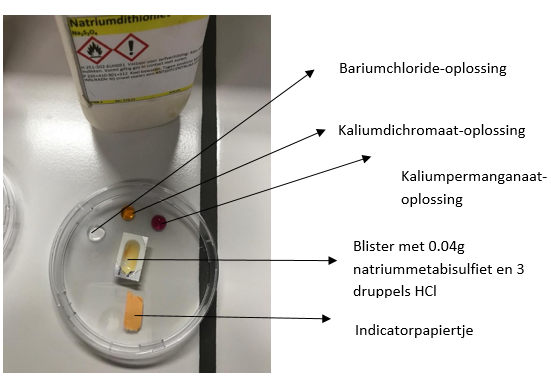
- Info: Hoe kan je luchtverontreiniging door SO2 aantonen?Door verschillende identifcatiereacties uit te voeren
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumdichromaat (2mol/l) – Kaliumpermanganaat (0,05mol/l) – Natriummetabisulfiet – Waterstofchloride (1mol/l) – Bariumchloride
- Thema: chemische reactie – gasvorming -redoxreactie – neutralisatiereactie
- Tijd: 30 min
- Begrippen: zuur-base indicator
6.9.5. Reactie van zwaveldioxide met water

- Info: Wat gebeurt er als we natriumsulfiet en zwavelzuur bij elkaar mengen? Hoe kunnen we zwaveldioxide aantonen? Voordat zwavelzuur aan natriumsulfiet wordt toegevoegd, kleurt de universeel indicator groen. Dit wijst op een pH van 7. Wat ook logisch is aangezien dat gedemineraliseerd water is. Na toevoeging van het zwavelzuur aan de natriumsulfiet, vormt er zich een reactie waardoor er een gasvorming ontstaat. Aangezien de petrischaal is afgedekt, kan het gas niet ontsnappen.
Hierdoor reageert het gas met het gedemineraliseerd water met als gevolg dat de universeel indicator rood/oranje kleurt. Dit wijst op een zeer zure pH. Het betreffende kleurloze gas is zwaveldioxide en in reactie met water vormt het zwaveligzuur. - Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumsulfiet – Geconcentreerd zwavelzuur – Appel – Rode roos
- Thema: chemische reactie – gasvorming -redoxreactie – neutralisatiereactie
- Tijd: 30 min
- Begrippen: zuur-base indicator – oxidatie






