Calciumsilicaat
Filmfragment – Filmfragment
1. Onderzoeksvraag
Op welke manier kunnen we water ineens laten verdwijnen?
2. Voorbereiding
- Glas water
- Calciumhydroxide
- Keukenrolpapier
- Veiligheidsbril
- Handschoenen
- 2 plastieken bekertjes
- Lepel

3. Uitvoeren
a.Werkwijze
- Leg al de benodigdheden klaar op de werktafel.
- Doe in het 1ste plastieken bekertje 2 cm glaswol en in het 2de plastieken bekertje calciumhydroxide.
- Voeg aan het 2de bekerglas 10 ml water toe door gebruik te maken van een injectiespuit.
- Giet de oplossing van de 1ste beker over in de tweede. Blijf de oplossing overgieten van de ene beker naar de andere totdat er een verandering optreedt.
b.Waarneming (+ foto’s)

Het mengsel stolt als gevolg van een chemische reactie tussen Ca(OH)2 en het vloeibaar glas.
4.Reflecteren
Calciumhydroxide Ca (OH)2 reageert met natriumsilicaat Na2SiO3 en dit levert het onoplosbare calciumsilicaat CaSiO3 op. Dit is de reden waarom de oplossing direct in de lucht hardt!
Na2SiO3 + Ca(OH)2 –> CaSiO3 + 2 NaOH
Vloeibaar glas is in feite natriumsilicaat Na2SiO3 wat zeer goed oplost in water.
Ca2 + uit Ca(OH)2 vervangt gemakkelijk natrium Na + om calciumsilicaat CaSiO3 te produceren dat bijna volledig onoplosbaar is. Normaal gezien ziet deze verbinding eruit als een wit poeder. Het calciumsilicaat absorbeert alle vloeistof in de beker en vormt een stevige zeepachtige vaste stof in plaats van een neerslag. De reactie vindt meestal plaats op de oppervlakken van minuscule onopgeloste Ca (OH)2-deeltjes, waardoor ze CaSiO3-kristalnaalden krijgen, die uiteindelijk in elkaar grijpen met die van de naburige deeltjes, waardoor de aanwezige vloeistof vast wordt gehouden.
De aard van calciumhydroxide Ca(OH)2 bepaalt de traagheid van het proces.Er zijn niet veel calcium Ca2 + -ionen in de oplossing. Wanneer het in water dissocieert komen heel weinig calciumionen Ca2 + in de oplossing: Ca(OH)2 ↔ Ca2 + + 2OH– Dit is de reden waarom het materiaal zich relatief langzaam en overal in de oplossing vormt.Aan het begin van dit proces vormen zich kleine maar constant groeiende stukjes onoplosbaar calciumsilicaat.
Geleidelijk aan materialiseren dunne bruggen tussen deze stukjes en verbinden ze in een cluster dat zich geleidelijk over de oplossing verspreidt. Watermoleculen spelen ook een sleutelrol in de flexibiliteit van de silicaatkunststof. Ze fungeren als een tijdelijke buffer, waardoor de clusters niet aan elkaar blijven plakken.
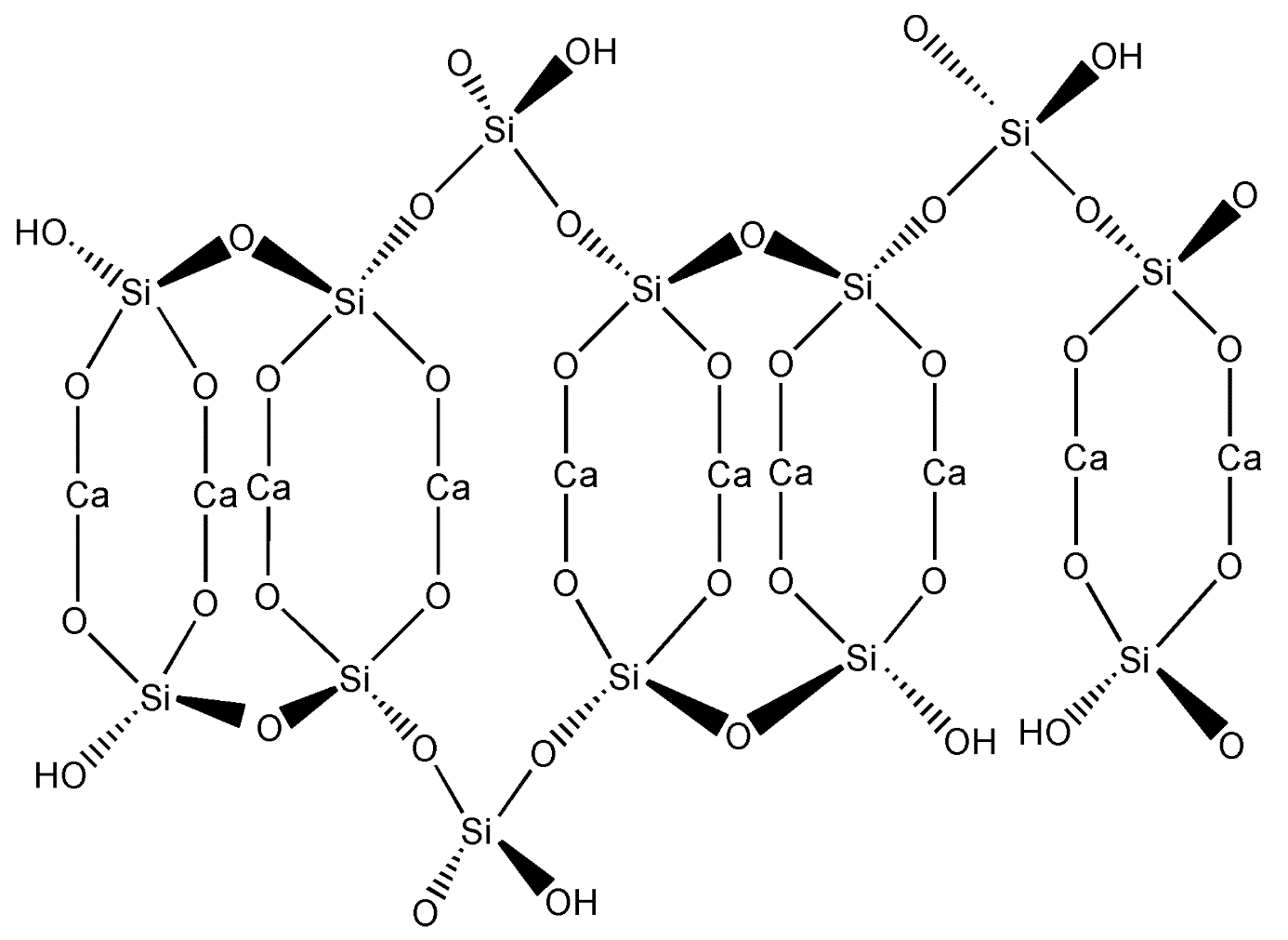
Deze watermoleculen zitten eigenlijk gevangen tussen deze clusters van natriumsilicaat. Ze hebben geen andere keus dan te blijven – het natriumsilicaat kristalliseert overal in de oplossing en neemt tegelijkertijd alle vloeistof op
5.Onderwerpen
-neerslagvorming
-Speciale toestand waarbij water wordt vastgehouden in de neerslag. Vergelijking maken met kunststoffen. Kunststoffen zijn C-verbindingen. Hier vind je een soort polymeer met Si-verbindingen. Net zoals C vereist Si ook 4 bindingen.
6.Bron






