Hoofdstuk 11 – Experimenten
1. Begrip pH
1.1. De zuurstok

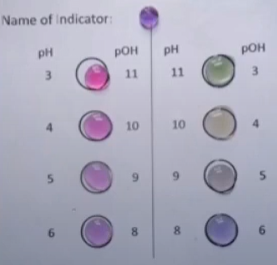
- Info: Hoe kunnen we het omslaggebied van een indicator duidelijk maken ? De pH van de oplossing kan worden aangevgeven door een indicator. In deze proef is dit universeelindicator, die kleuren vertoont in een groot pH bereik. De indicator zit in een lange buis tussen een zure HCl en een basische NaOH oplossing in. Als je de buis kantelt, zullen, geholpen door de luchtbel , de oplossingen van de uiteinden naar elkaar toekomen en ontstaat een pH verloop van 1,7 tot 12,3 wat duidelijk is door de kleurindicator.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 ml HCl-oplossing 0,1 mol/liter – 0,02 mol/liter – 5 ml NaOH-oplossing 0,1 mol/liter – 0,02 mol/liter – universele indicator
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH – pH-indicator

- Info: Welk effect heeft verwarmen op een 5% ammoniakoplossing? We voegen aan een klein beetje ammoniakoplossing 50ml water en 10 druppels fenolftaleïne toe. We verdelen dit over 2 erlenmeyers. 1 van de twee erlenmeyers verwarmen we op de kookplaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5% ammoniakoplossing – Fenolftaleïne
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH – invloed temperatuur op dissociatie
1.3. Druppelpracticum
- Info: Hoe kunnen we met eenvoudige stoffen het volledige kleurenpalet van de universeelindicator maken? We zien nu het volledige kleurenpalet van de universeelindicator.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1mol/l – HCl 1mol/l – H2SO4 1mol/l – HNO3 1mol/l – Na2CO3 0,5 mol/l – NH3 1mol/l – Azijnzuur – Citroensap – Zeepoplossing
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH – werking van indicator
1.4. Is een alcoholfunctie een base?
- Info: Zorgt de OH-groep van een alcohol voor basische eigenschappen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1mol/l -methanol – indicator
- Thema: neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH – werking van indicator – zuurconstant

- Info: Wat gaat er gebeuren als je een bruistablet in de broomthymolblauwoplossing laat vallen? De kleur van de basische broomthymolblauwoplossing gaat van blauw naar geel door toevoeging van de bruistablet. Dit komt doordat de bruistablet koolzuurgas vrijlaat en samen met water vormt dit waterstofcarbonaat (H2CO3). Dit is een zuur.Door de beker een tijdje te laten staan krijgen we een neutraal milieu. Dit kunnen we zien aan de groene kleur en verklaren doordat het koolzuurgas de zure oplossing gaat neutraliseren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bruistablet – Broomthymolblauwoplossing
- Thema:biochemie – neutralisatiereacties
- Tijd: 15 min
- Begrippen: indicator– identificatiereactie
1.6. pH van de verbrandingsproducten van een sigaret
- Info: Welke pH hebben alledaagse producten? Zowel de rook en de nicotine zijn basisch. Nicotine is met een pKa van 8,0 licht basisch.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Sigaret, – universele indicator,
- Thema:biochemie – neutralisatiereacties
- Tijd: 15 min
- Begrippen: indicator– identificatiereactie – zuurconstante
1.6. pH van verschillende soorten water

- Info: Verschilt de pH van plat, licht en fel bruisend water? De pH’s verschillen, hoe meer bruis hoe zuurder. Dit als resultaat van de grotere aanwezigheid CO2.
- Moeilijkheid: eenvoudig
- Chemische stoffen:
- Van hetzelfde merk: water zonder bruis, met lichte bruis en met felle bruis
- Thema:biochemie – neutralisatiereacties
- Tijd: 15 min
- Begrippen: indicator– identificatiereactie – zuurconstante
1.7. pH van water in functie van temperatuur
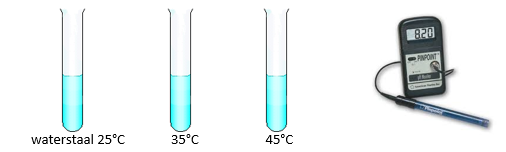
- Info: Hebben waterstalen op verschillende temperaturen een verschillende pH? Bij 45°C bevat water tweemaal zoveel H3O+ ionen en OH– ionen als bij 24°C.
- Moeilijkheid: eenvoudig
- Chemische stoffen:
- Van hetzelfde merk: waterstalen
- Thema: neutralisatiereacties
- Tijd: 25 min
- Begrippen:pH– invloed van temperatuur – zuurconstante
1.8. Regenboog geleidelijk gevormd

- Info: Hoe kunnen we een regenboog geleidelijk aan vormen met indicatoren? De reactie is een nucleofiele substitutiereactie. Protonen komen in oplossing en gaan in reactie met de aanwezige OH- ionen. De pH van de oplossing daalt.
- Moeilijkheid: eenvoudig
- Chemische stoffen:
- Van hetzelfde merk: t-butylchloride 2 ml – NaOH 0,1 mol/l – Universele indicatoroplossing – Indicatoren: m.o., broomcresolgroen, broomthymolblauw, thymolblauw, fft
- Thema: neutralisatiereacties
- Tijd: 25 min
- Begrippen:pH– indicatoren
1.9. Schuimvorming

- Info: Hoe kunnen we aantonen dat aluminiumkaliumsulfaat een protonendonor is? Donor van protonen aan natriumwaterstofcarbonaat
- Moeilijkheid: eenvoudig
- Chemische stoffen:Aluminiumkaliumsulfaat – Natriumwaterstofcarbonaat – Gedestilleerd water
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: zouten– protonendonor
1.10. Tovertabletten

- Info: Wat gebeurt er met de pH wanneer we een bruistablet oplossen ? De pH gaat dalen. Kleurverandering naar het gele toe.Door de productie van CO2 gaat de pH dalen, hierdoor gaat de pH omslaan waardoor we een gele kleur krijgen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bruistablet – Broomthymolblauwoplossing
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator
1.11. Verzamel dagelijkse stoffen van alle pH-waarden

- Info: Verzamel dagdagelijke stoffen en bouw zo een reeks waarbij de pH gaat van 0 tot 14 en waarbij elk staal een andere pH waarde heeft..
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zoutzuur (1 mol/l) – Fruitsap – Cola – Melk – Sojasaus – Zeep – Ammoniak – Lotion – Toiletreiniger – Spuitwater – Citroensap – Ketchup – Tandpasta – Motorolie – Isobetadine – Red Bull
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator
1.12. Zuur basegedrag van alcoholen

- Info: Zorgt de OH-groep van een alcohol voor basische eigenschappen? Ga met de indicator de zuurtegraad na van zowel NaOH als de alcohol
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1mol/l – methanol
- Thema: organische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator – zuurconstante
1.13. Zuurgraad van koolstofdioxide

- Info: Ammoniakgas neutraliseert het zure milieu bekomen door koolzuurgas.
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2 (g), 20 – 40 ml – universele indicator-oplossing, 10 ml (of rode kool sap oplossing) – geconcentreerde ammonia
- Thema: anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator -neutralisatie
1.14. Zuurheid van zuren en zouten

- Info: Hoe zuur zijn zuren en zouten? Magnesium gaat net iets feller reageren met azijnzuur, omdat azijnzuur een iets lagere pH heeft dan wijnsteenzuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universele indicator – Magnesiumlint – Azijnzuur – Wijnsteenzuur – AlCl3 gehydrateerd – Bi(NO3)3
- Thema: anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator – zuursterkte
1.15. pH van zure snoepjes

- Info: Wat nemen we waar wanneer we een “zure mat” snoepje in water doen? De zure snoepjes bevatten citroenzuur als deze in contact komen wat water lost dit op in het water en daalt de pH van dit water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zure maten – Gedemineraliseerd water
- Thema: neutralisatiereactie – biochemie
- Tijd:10 min
- Begrippen: pH-meting
1.16. Vruchtzuren in gummibeertjes
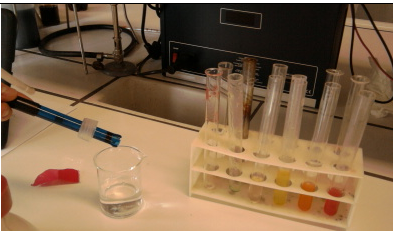
- Info: Wat is de pH van de verschillende gummibeertjes? We leiden uit de metingen af dat de pH van witte beertjes 3,8 bedraagt, de pH van gele en oranje beertjes 3,9 bedraagt , de pH van groene beertjes 4,0 bedraagt en de pH van rode beertjes 4,6 bedraagt
- Moeilijkheid: eenvoudig
- Chemische stoffen: gummibeertjes in verschillende kleuren
- Thema: neutralisatiereactie – biochemie
- Tijd: 20 min
- Begrippen: pH
1.17. Cola ontkleuren + pH

- Info: Hoe ontkleuren we Cola? Cola wordt met de actieve kool in verhouding 10 op 1 ongeveer 5 minuten opgewarmd in een warmwaterbad.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Actieve kool – Coca-Cola
- Thema: biochemie – scheidingstechnieken – neutralisatie
- Tijd: 20 min
- Begrippen: adsorptie – filtratie
1.18. De pH van cola

- Info: Welke pH heeft cola? Doordat cola fosforzuur bevat is het een sterk zuur met een pH-waarde van 3.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola – Ontkleurde cola
- Thema: biochemie – neutralisatiereactie
- Tijd: 20 min
- Begrippen: adsorptie – filtratie – pH
1.19. Meten van pH van huishoudproducten
- Info: Welke pH hebben alledaagse producten?
- Moeilijkheid: eenvoudig
- Chemische stoffen: gedemineraliseerd water, – citroensap, – suiker, – ethanol
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH
1.20. Zuurgehalte van melk

- Info: Hoeveel zuur bevat melk? Je bepaalt de concentratie door een titratie met een sterke base
- Moeilijkheid: eenvoudig
- Chemische stoffen: Melk – NaOH 0,1 mol/l – 2% fft; – 5% kobaltdichlorideoplossing
- Thema: biochemie – neutralisatiereacties
- Tijd: 20 min
- Begrippen: titratie
1.21. Koken en schilderen met huishoudproducten

- Info: Is chemie ook iets van alledaagse dingen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: een verse citroen – 10 druppels afwasmiddel – een eetlepel bakpoeder
- Thema: biochemie – neutralisatiereacties
- Tijd: 20 min
- Begrippen: pH – neutralisatie
1.22. Zure adem

- Info: Welke pH heeft onze adem? Blaas via een rietje in een oplossing met pH-indicator. Blijf dit doen. Geleidelijk aan ontkleurt de oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0.025 mol/l NaOH oplossing – fft oplossing
- Thema: biochemie – neutralisatiereacties
- Tijd: 20 min
- Begrippen: pH – neutralisatie
1.23. pH regenboog

- Info: Hoe kunnen we een regenboog maken met behulp van een universele indicator? De universele indicator is een stof dat via een kleur aangeeft indien een bepaalde zuur of base is en hoe sterk dat dit dan is. Hoe roder de kleur, hoe zuurder bijvoorbeeld.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl (0,1 mol/l) – Na2CO3 (0,5 mol/l) – Universele indicator
- Thema: neutralisatiereacties
- Tijd: 30 min
- Begrippen: pH – pH-indicator
1.24. Blauwe bessen als zuur-base indicator

- Info: Hoe kunnen we blauwe bessen als zuur-base indicator gebruiken? Het blauwe bessensap verkleurt in de verschillende oplossingen. In een zuur milieu, citroensap of azijn, geeft het een roze kleur. In een alkalisch milieu, NaHCO3-oplossing, kleurt het sap blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Blauwe bessensap – Natriumwaterstofcarbonaatoplossing 10 g/ 100 ml oplossing – natriumhydroxide
- Thema:neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie
1.25. Blauwe letters op een geel papier

- Info: Hoe kunnen we een papiertje een gele achtergrond geven en vervolgens blauw laten kleuren zonder pennen of stiften te gebruiken? Broomthymolblauw is een zuur-base-indicator en kleurt geel in een zuur milieu en blauw in een basisch milieu. De alkoholische broomthymolblauwoplossing is geel gekleurd en daarom dus zuur. Het natriumchloride dissocieert in het water en dient als elektrolyt om de stroom te geleiden. Aan de – pool zal een chemische reactie gebeuren waardoor plaatselijk NaOH gevormd wordt, en aangezien dit een base is zorgt dit ervoor dat de broomthymolblauw blauw kleurt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Spijker – Tafelzout (natriumchloride) of kaliumchloride
- Thema:neutralisatiereactie – redoxreacties
- Tijd: 20 min
- Begrippen: elektrolyse – werking pH-indicator
1.26. Betekenis van een lage en hoge pH voorstellen

- Info: Wat is de betekenis van een hoge en een lage pH? De pH is een maat voor de zuurgraad (ook wel zuurtegraad) van een waterige oplossing. De pH van een neutrale waterige oplossing ligt bij kamertemperatuur rond de 7. Zure oplossingen hebben een pH lager dan 7, en dus een hoge zuurgraad. Basische oplossingen hebben een pH hoger dan 7 en dus een lage zuurgraad.
- Moeilijkheid: eenvoudig
- Chemische stoffen: citroensap – soda oplossing 0,1 mol/l – NaOH-oplossing 0,1 mol/l – HCl-oplossing 0,1 mol/l
- Thema:neutralisatiereactie
- Tijd: 20 min
- Begrippen: begrip pH – werking pH-indicator
2. Buffers
2.1.Bufferende werking aantonen met ballon

- Info: Welk effect heeft een buffer op reactievergelijking? NaAc treedt op als een buffer. Dit vertraagt de reactie aanzienlijk. We zien dus dat buffers reacties vertragen.De pH-waarde van azijnzuur zit rond pH 2. De pH van uw buffer is rond de 4,7 (= Ka-waarde). Dus we kunnen vaststellen dat er minder H+-ionen aanwezig zijn (wanneer we de buffer toevoegen) om te reageren met Mg.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 6 g magnesiumpoeder – 500ml tafelazijn – 15 g natriumacetaat
- Thema:neutralisatiereactie
- Tijd: 20 min
- Begrippen: begrip pH – buffers
2.2. Kan koolstofdioxide als buffer functioneren?

- Info: Kan CO2 als buffer functioneren? Indien we Na2CO3 of NaHCO3 aan de oplossing toevoegen zal hierbij CO2 oplossen in de oplossing. Als we in deze oplossingen blazen merken we op dat de pH-waarde constant blijft.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kraantjeswater – Na2CO3 – NaHCO3
- Thema:neutralisatiereactie
- Tijd: 20 min
- Begrippen: begrip pH – buffers
2.3. Bufferoplossingen

- Info: Hoe reageert een buffer na toevoeging van een zuur of een base in vergelijking met andere stoffen? De pH van koolzuurhoudend mineraalwater verloopt door het verdampen van CO2. Op een warm oppervlak is de rode oplossing na 10 minuten al oranjegeel, na 15 minuten is de oplossing geelgroen en na 20 minuten groen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Azijnzuur – Natriumacetaat – Zoutzuur 0,1 mol/l – NaOH 0,1 mol/l – Universeelindicator – Natriumwaterstofcarbonaat
- Thema:neutralisatiereactie
- Tijd: 30 min
- Begrippen: begrip pH – buffers
2.4. Bereiding bufferoplossingen tussen pH 6 en 9

- Info: Hoe kan je een buffer van een zwak zuur en geconjugeerde base maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universele indicator – 𝑁𝑎𝐻2𝑃𝑂4 ∙ 2𝐻2𝑂 – 𝑁𝑎2𝐻𝑃𝑂4 ∙ 2𝐻2𝑂
- Thema:neutralisatiereactie
- Tijd: 20 min
- Begrippen: begrip pH – buffers
2.5. Invloed van acetaationen op de zuurtegraad van azijnzuur

- Info: Hoe beïnvloeden acetaationen de zuurtegraad van azijnzuur? De aanwezigheid van acetaationen drukt de ionisatie van azijnzuur nog meer terug. Het is beter calciumcarbonaat te gebruiken dan een ander carbonaat omdat dit onoplosbaar is in water. Een oplosbaar carbonaat wordt verspreid in de zure oplossing waardoor de reactie te snel verloopt om nog enige waarneming te kunnen doen. Bovendien kleven de calciumcarbonaatdeeltjes aan de gasbellen wat het schuimen doet ontstaan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 ml universeelindicator – 75 g calciumcarbonaat – 180 ml 2 mol/l azijnzuur – 27 g natriumacetaat – 20 ml gedestilleerd water – 100 ml 2 mol/l zoutzuur
- Thema:neutralisatiereactie
- Tijd: 20 min
- Begrippen: begrip pH – buffers
3. Energetische aspecten

- Info: Welk effect heeft verwarmen op een 5% ammoniakoplossing? We voegen aan een klein beetje ammoniakoplossing 50ml water en 10 druppels fenolftaleïne toe. We verdelen dit over 2 erlenmeyers. 1 van de twee erlenmeyers verwarmen we op de kookplaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5% ammoniakoplossing – Fenolftaleïne
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH – invloed temperatuur op dissociatie
3.2. Warmtevorming bij een neutralisatie

- Info: Hoeveel zal de calorimetrische waarde van een mol neutralisatiewarmte zijn? Doe de meting van de gevormde warmte bij de neutralisatie
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 1 mol/l – NaOH 1mol/l
- Thema: neutralisatiereactie – thermodynamica
- Tijd: 20 min
- Begrippen: pH – neutralisatiewarmte
4. Indicatoren

- Info: Hoe kunnen we bloemen laten verkleuren door toevoeging van een bepaalde stof ? ele van deze plantaardige kleurstoffen zijn afgeleid van anthocyanen, dat is een groep rode, blauwe of paarse kleurstoffen. Deze groep heeft een duidelijke indicatorwerking, bv. cyanidines (afgeleid van anthocyaan). De rode kleur in bieten wordt ook veroorzaakt door een anthocyaanverbinding. Anthocyanidines zijn planten kleurstoffen die in de cel vakuole gelokaliseerd zitten. Ze veroorzaken de rode, paarse en blauwe verkleuring van vele bloemen en fruitsoorten.Als ringsysteem bevatten ze een flaveen, als 3 of als 3,5 glycoside.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 36% ammoniakoplossing – blauwe of paarse bloemen
- Thema: neutralisatiereactie
- Tijd: 10 min
- Begrippen: pH – pH-indicator
4.2. Blauwe rozen
- Info:De kleurpigmenten in de rode roos veranderen door de pH. In zuur milieu zijn de pigmenten rood, in basisch milieu blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: aceton – ammoniakoplossing 25% – rode half uitgebloeide rozen
- Thema: neutralisatiereactie – biochemie
- Tijd: 25 min
- Begrippen: pH indicator
4.3. Buitenaards water

- Info: Op welke manier kunnen we water van kleur te veranderen en zelfs te laten verdwijnen? We kunnen water van kleur laten veranderen op basis van indicator. Het water doen verdwijnen doen we met een superabsorber, die we kunnen aankopen of terugvinden in pampers.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1mol/l – HCl 2 mol/l – Fenolftaleïne – Superabsorber
- Thema: neutralisatiereactie – kunststoffen
- Tijd: 25 min
- Begrippen: pH indicator
4.4. Curcumapoeder als zuur-base indicator

- Info:Hoe is curcumapoeder te gebruiken als indicator? Curcumarine is goed oplosbaar in alcohol en basen. Het neemt dan een roodbruine kleur aan
- Moeilijkheid: eenvoudig
- Chemische stoffen: Curcuma poeder – Water
- Thema: neutralisatiereactie – biochemie
- Tijd: 15 min
- Begrippen: pH indicator

- Info: Hoe kunnen we het omslaggebied van een indicator duidelijk maken ? De pH van de oplossing kan worden aangevgeven door een indicator. In deze proef is dit universeelindicator, die kleuren vertoont in een groot pH bereik. De indicator zit in een lange buis tussen een zure HCl en een basische NaOH oplossing in. Als je de buis kantelt, zullen, geholpen door de luchtbel , de oplossingen van de uiteinden naar elkaar toekomen en ontstaat een pH verloop van 1,7 tot 12,3 wat duidelijk is door de kleurindicator.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 ml HCl-oplossing 0,1 mol/liter – 0,02 mol/liter – 5 ml NaOH-oplossing 0,1 mol/liter – 0,02 mol/liter – universele indicator
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH – pH-indicator
4.6. Fenolftaleïne

- Info: Hoe kunnen we een geheime boodschap met fft schrijven? Schrijven in zuur milieu en opsporen in basisch milieu
- Moeilijkheid: eenvoudig
- Chemische stoffen: 50 ml ethanol 96% – thymolftaleïne in druppelflesje (3 g op 97 ml ethanol 96%) – natriumhydroxideoplossing 1.0 mol/l
- Thema: neutralisatiereactie
- Tijd: 10 min
- Begrippen: pH – pH-indicator
4.7. Fluorescerende indicator in groene markeerstiften

- Info: Wat gebeurt er wanneer we de inkt van een groene fluo-stift belichten met UV-licht ? In groene inkt zitten de volgende kleurstoffen: Basic Blue, C.I.Yellow en Solvent Yellow 160.
Deze stoffen gaan als een indicator optreden.
Wat gebeurt hiermee onder invloed van zuren en/of basen ? - Moeilijkheid: eenvoudig
- Chemische stoffen: sodaoplossing (1 M) – HCl-oplossing met een concentratie van 1 M – UV-lamp – markeerstift
- Thema: neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH – pH-indicator
4.8. Groen gebakken eitje

- Info: Wat is het effect van rode koolsap bij het bakken van een ei? De pigmenten in de rode kool zijn anthocyanen. De anthocyanen veranderen van kleur door de pH-waarde. De rode kool is rood in zure omstandigheden en verandert naar blauw-groen in basisch mileu. Het ei-wit is alkalisch (pH 9) en wordt zo groen. De pH verandert wanneer we het eitje bakken, namelijk het wordt minder basisch. We zien dit aan de blauwere kleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ei – Rode koolsap
- Thema: neutralisatiereactie– biochemie
- Tijd: 20 min
- Begrippen: pH-indicatoren
- Info: Anthocyanidines zijn planten kleurstoffen die in de cel vakuole gelokaliseerd zitten. Ze veroorzaken de rode, paarse en blauwe verkleuring van vele bloemen en fruitsoorten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 100g plantenmateriaal
- Thema: stofeigenschappen – biochemie
- Tijd: 15 min
- Begrippen: pH-indicator
4.10. Indicatorpatronen door gassen

- Info: De HCl damp die zwaarder is dan lucht, komt in contact met het oppervlak, lost daar op en reageert met de natronloog. De indicator slaat daarbij om naar de kleur in het zure pH-gebied. Door toevallige convectiestromen in de vloeistof ontstaan steeds andere kleurpatronen: meestal basisch, plaatselijk zuur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 17% HCl oplossing – 0,1 mol/l NaOH oplossing – 0,1% broonkresolgroen
- Thema: neutralisatie – biochemie
- Tijd: 15 min
- Begrippen: pH-indicator
4.11. Kleurenkettingreacties met voedingsmiddelen

- Info:Een kettingreactie is een keten van reacties waarbij een stof onstaat in de eerste reactie reageert in de volgende reactie. Tijdens deze kettingreactie vinden vijf verschillende reacties plaats met voedingsmiddelen
- Moeilijkheid: gemiddeld
- Chemische stoffen: Rodekoolsap (voor het maken van rodekoolsap kook je de groente 10 minuten in een beetje water) – Maïzena (zetmeel van maïs) – Water – Ammonia (VOORZICHTIG! Irriteert ogen en neus) – Schoonmaakazijn – Zuiveringszout (verkrijgbaar bij de drogist) – Betadine (jodium) – Vitamine C-bruistablet
- Thema: chemische reacties – complexreactie – redoxreactie – neutralisatiereacties
- Tijd:20 min
- Begrippen: stofveranderingen – kleurreacties
4.12. Kleurige ontleding
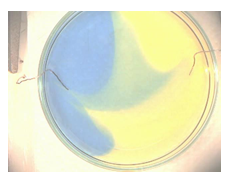
- Info: Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen? Er worden H+ -ionen gevormd aan de positieve pool en OH– -ionen gevormd aan de negatieve pool. Aan de positieve pool krijgen we dus een meer zurige oplossing, geel, en aan de negatieve pool krijgen we een meer basische oplossing, blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ged. water – Natriumsulfaat – Broomthymolblauwoplossing 0,1%:1 mL
- Thema: redoxreacties – neutralisatiereactie
- Tijd: 20 min
- Begrippen: elektrolyse – identificatie – indicator
4.13. Kunnen we indicatoren gebruiken om koolstofdioxide aan te tonen?

- Info: Kunnen we indicatoren gebruiken om het effect van de toevoeging van CO2 aan te tonen? Bij het oplossen verandert de pH wat met indicator is aan te tonen
- Moeilijkheid: eenvoudig
- Chemische stoffen: Enkele ml NaOH 1mol/l – Universele indicator – Droog ijs (vaste CO2)
- Thema: redoxreacties – neutralisatiereactie
- Tijd: 20 min
- Begrippen: identificatie – indicator
4.14. Kunst met kleuren door indicatoren

- Info: Kunnen we kunst maken met indicatoren?
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 0.1 mol/l – NaOH 0.1 mol/l – dreft – kleurstoffen
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: identificatie – indicator
4.15. Kunst van kleuren met indicatoren

- Info: Kunnen we kunst maken met indicatoren? Elke indicator heeft zijn kleur in neutraal milieu.
- Moeilijkheid: eenvoudig
- Chemische stoffen: fluoresceïne, – congorood, – indigocarmine, – methyleenblauw,
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: identificatie – indicator
4.16. Maak de zuurstok met de meeste kleuren

- Info: Hoe kunnen we het omslaggebied van een indicator duidelijk maken ? In de buret zit universeelindicator. Bovenaan wordt een base aangebracht, onderaan zuur. Beide oplossingen diffunderen in de universele indicator en zorgen respectievelijk voor basenkleuring (blauw) en zuurkleuring (rood) naar het midden toe gaat de kleur over naar geel/groen/paars).
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl (0,02 mol/L); – NaOH (0,02 mol/l); – universeelindicatoroplossing
- Thema: neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH – pH-indicator
4.17. Magische kleurenwissel in een spuit

- Info:De broomthymolblauwoplossing wordt bereid door O,1 g broomthymolblauw te brengen in 8 ml van een licht basische oplossing van NaOH (O,2M). Leng aan tot 50 ml. Verdun nu verder dit staal totdat een doorzichtige blauwe oplossing wordt bekomen.Breng niet te veel staal in de meetspuiten. Je hebt voldoende ruimte nodig om de gevormde CO2 in de vrije ruimte te laten bewegen.Het duur een tijdje eer de overgang van groen naar geel terug verschijnt. Schud tussen door.
- Moeilijkheid: gemiddeld
- Chemische stoffen: broomthymolblauw-indicatoroplossing – spuitwater
- Thema: Anorganische stoffen – chemisch evenwicht – neutralisatiereactie
- Tijd:20 min
- Begrippen: zuren – invloed druk op evenwichtsreactie
4.18. Micro-elektrolyse met indicatorpapier

- Info: Het toegevoegde zuur en de base die aan de kathode ontstaat neutraliseren elkaar.De toegevoegde base en het zuur dat aan de anode ontstaat neutraliseren elkaar.Aan de anode kan men ook de corrosie van ijzer tot Fe2+-ionen aantonen, bijvoorbeeld met hexacyanoferraat(III)
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2SO4-opl verzadigd – NaOH 1M – HCl 1M
- Thema: redoxreacties – neutralisatiereactie
- Tijd: 20 min
- Begrippen: elektrolyse – identificatie – indicator
4.19. Omslaggebieden van een zuur

- Info: Hoe kunnen we de kleuren van indicatoren voorstellen en bepalen hoeveel zuur of base nodig is om de indicator van kleur te doen veranderen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 0,1 mol/l – HCl 0,1 mol/l – indicatoren: fft, methylrood, methyloranje, lakmoespapier, universeelindicator
- Thema: neutralisatiereactie
- Tijd: 25 min
- Begrippen: identificatie – pH-indicator
4.20. Ontkleurde regenboog
- Info: Hoe kunnen we een regenboog namaken met indicatoren en hoe kunnen we de kleuren wegkrijgen? Door de verandering van de pH waarde kunnen we de indicatoren in de bekers kleuren/ontkleuren
- Moeilijkheid: eenvoudig
- Chemische stoffen:
- -oplossing NaOH 0.01 M
- -oplossing van NaOH 3 M
- -oplossing van HCl 0.01 M
- -oplossing van HCl 3 M
- -indicatoren:
- -violet: 0.45 g fft en 0.2 g tff in 30 ml 95% ethanol
- -blauw: 0.2 g tff in 30 ml 95% ethanol
- -groen: 0.2 g tff, 2 g p-nitrofenol in 30 ml 95% ethanol. Voeg 5 druppels 1 M HCl toe.
- -geel: 1 g p-nitrofenol in 30 ml 95% ethanol. Voeg 5 druppels 1 M HCl toe.
- -oranje: 2 g p-nitrofenol en 0.15 g fft in 30 ml 95% ethanol. Voeg 5 druppels 1M HCl toe
- -rood: 1.5 g p-nitrofenol en 0.75 g fft in 30 ml 95% ethanol. Voeg 5 druppels 1M HCl oplossing toe.
- Thema: neutralisatiereactie
- Tijd: 45 min
- Begrippen: identificatie – pH-indicator
4.21. pH doorlopen met een gas

- Info: Wat gaat er gebeuren als je een bruistablet in de broomthymolblauwoplossing laat vallen? De kleur van de basische broomthymolblauwoplossing gaat van blauw naar geel door toevoeging van de bruistablet. Dit komt doordat de bruistablet koolzuurgas vrijlaat en samen met water vormt dit waterstofcarbonaat (H2CO3). Dit is een zuur.Door de beker een tijdje te laten staan krijgen we een neutraal milieu. Dit kunnen we zien aan de groene kleur en verklaren doordat het koolzuurgas de zure oplossing gaat neutraliseren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bruistablet – Broomthymolblauwoplossing
- Thema:biochemie – neutralisatiereacties
- Tijd: 15 min
- Begrippen: indicator– identificatiereactie
4.22. Poetsen met een indicatorspons

- Info: Hoe kunnen we op een leuke manier congorood gebruiken? We zien de indicator reageren met de gemorste stoffen.
Kleuromslag van blauw (zuur milieu onder pH 3) tot rood vanaf pH 5,2 - Moeilijkheid: eenvoudig
- Chemische stoffen: 1 g congorood indicator – 100 ml gedestilleerd water – 100ml 1 mol/l azijnzuur – 100 ml verzadigd NaHCO3
- Thema:biochemie – neutralisatiereacties
- Tijd: 15 min
- Begrippen: indicator– identificatiereactie
4.23. Productie van twee gassen uit ammoniumchloride

- Info: Welke gassen ontstaan er als we ammoniumchloride verhitten? Een deel van het ammoniumchloride ontleedt. De gevormde ammoniak, lichter dan lucht, stijgt in de reageerbuis omhoog en kleurt het indicatorpapier blauw. De ammoniak verdwijnt uit de buis. Na enige tijd verzamelt zich steeds meer HCl in de buis.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universele indicator – ammoniumchloride
- Thema: neutralisatiereacties
- Tijd: 15 min
- Begrippen: indicator– identificatiereactie
4.24. Puzzeltitratie

- Info: Het is mogelijk om aan de hand van de verkleuring van fenolftaleïne in een zuur of basisch milieu te achterhalen welke oplossing in welke fles zit. Deze proef steunt op de zelfde basis als het uitvoeren van een eenvoudige zuur-base titratie, namelijk de kleuromslag van de indicator in een zuur of basisch milieu.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,5 mol/ l HCl met fft – 1 mol/l HCl met fft – 1 mol/l NaOH – 0,5 mol/l NaOH – 0,1 mol/l NaOH
- Thema: neutralisatiereacties
- Tijd: 35 min
- Begrippen: indicator– identificatiereactie
4.25. Regenboog wordt geleidelijk gevormd

- Info: Hoe kunnen we een regenboog geleidelijk aan vormen met indicatoren? De reactie is een nucleofiele substitutiereactie. Protonen komen in oplossing en gaan in reactie met de aanwezige OH- ionen. De pH van de oplossing daalt.
- Moeilijkheid: eenvoudig
- Chemische stoffen:
- Van hetzelfde merk: t-butylchloride 2 ml – NaOH 0,1 mol/l – Universele indicatoroplossing – Indicatoren: m.o., broomcresolgroen, broomthymolblauw, thymolblauw, fft
- Thema: neutralisatiereacties
- Tijd: 25 min
- Begrippen:pH– indicatoren
4.26. Rode wijn als indicator

- Info: Hoe kunnen we huishoudmiddeltjes als zuurbase-indicator gebruiken? De indicatorstof in de wijn zijn de anthocyanen. Dit zijn kleurstoffen die in plantencellen voorkomen, zoals die van druiven. Men heeft al meer dan 500 soorten anthocyanen kunnen isoleren uit planten. Deze zijn allemaal gelijkaardig opgebouwd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: actieve kool eventueel zelf gemaakt – wijn
- Thema: neutralisatiereactie- biochemie
- Tijd: 10 min
- Begrippen: titraties – pH-indicator
4.27. Rood-gouden boodschappen

- Info: Hoe kan je een geheime boodschap schrijven die verdwijnt? De zuurbase indicator in het roodgeel papier is op basis van Curcumine
- Moeilijkheid: eenvoudig
- Chemische stoffen: Goud-rood papier – NH3-oplossing (5%)
- Thema: neutralisatiereactie- biochemie
- Tijd: 10 min
- Begrippen: titraties – pH-indicator
4.28. Schilderij met indicatoren in melk
- Info: Hoe kan je een uniek schilderij maken met melk, kleurstoffen en afwasmiddel? Melk bevat veel vetten, deze vetten zorgen ervoor dat alles op zijn plaats blijft. Doordat je een zeep toevoegt, zullen de zwakke chemische bindingen die de eiwitten in de oplossing houden veranderen. Hierdoor gaan alle kleurstofdeeltjes in alle richtingen en krijg je vervolgens een kleurenfestijn op je bord.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Melk – Enkele indicatoren met verschillende kleuren – afwasmiddel
- Thema: biochemie – neutralisatiereacties
- Tijd: 20 min
- Begrippen: indicatoren
4.29. Thymolftaleïne als onzichtbare inkt

- Info: In een neutraal milieu is de boodschap niet zichtbaar. Door de boodschap te overschrijven met NaOH verschijnt de boodschap in blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 50 ml ethanol 96% – thymolftaleïne in druppelflesje (3 g op 97 ml ethanol 96%) – natriumhydroxideoplossing 1.0 mol/l
- Thema: neutralisatiereacties
- Tijd: 10 min
- Begrippen: pH-indicatoren
4.30. Tovertabletten

- Info: Wat gebeurt er met de pH wanneer we een bruistablet oplossen ? De pH gaat dalen. Kleurverandering naar het gele toe.Door de productie van CO2 gaat de pH dalen, hierdoor gaat de pH omslaan waardoor we een gele kleur krijgen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bruistablet – Broomthymolblauwoplossing
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator
4.31. Werking van indicatoren
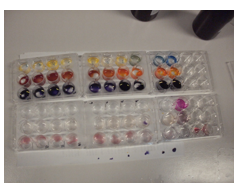
- Info: Wat gebeurt er met met de kleur van indicatoren bij verschillende zuurtegraden?
- Moeilijkheid: eenvoudig
- Chemische stoffen: broomthymolblauw – methyloranje – methylviolet – fenolfthaleïne – Alizarine geel – natuurlijke indicatoren
- Thema: Anorganische stoffen – neutralisatiereactie
- Tijd: 30 min
- Begrippen: pH indicator
4.32. Zuren en basen op wandel

- Info: Wat gebeurt er als zuren en basen onder invloed van stroom worden gezet? De ionen bewegen onder invloed van de stroom
- Moeilijkheid: eenvoudig
- Chemische stoffen: universele indicator – HCl 1 mol/l en NaOH 1 mol/l – Geconcentreerde KNO3 oplossing
- Thema: redoxreacties – neutralisatiereactie
- Tijd: 30 min
- Begrippen: pH indicator – elektrolyse
4.33. Zuren en basen uit dagelijks leven met rode koolsap en universele indicatoroplossing
- Info: Zuurtegraad zoeken van (dagdaagelijkse)oplossingen
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1 mol/l – HCl 1 mol/l – H2SO4 1 mol/l – HNO3 1 mol/l – Na2CO3 0,5 mol/l – NH3 1 mol/l – Azijnzuur – Citroensap – Zeepoplossing – Universele indicatoroplossing of rodekoolsap
- Thema: neutralisatiereactie
- Tijd: 30 min
- Begrippen: pH indicator – zuurtegraad
4.34. Indicatorpapier maken

- Info: Hoe kunnen we zelf indicatorpapier maken? Door een papier te impregneren met rodekoolsap. Kleurt roze wanneer we te maken hebben met een zuur en kleurt groen bij een basen. Rode koolsap is een goede universele indicator.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rodekoolsap
- Thema: neutralisatiereactie– biochemie
- Tijd: 15 min
- Begrippen: pH-indicator – indicator
4.35. pH afhankelijkheid kleurstoffen

- Info: Verandert de kleur van kersensap bij een verschillende pH? Als er een zuur wordt toegevoegd aan het kersensap wordt dit lichter, wordt er een base toegevoegd wordt het kersensap groen. Het kersensap krijgt dus een andere kleur bij een verschillende pH en kan als indicator gebruikt worden. De stof die zorgt voor de kleurverandering is anthocyaan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: kersensap, – water, – zoutzuur 2mol/l, – natriumhydroxide 2 mol/l
- Thema: neutralisatiereactie – biochemie
- Tijd: 25 min
- Begrippen: pH indicatoren
4.36. Geheime boodschap

- Info: Hoe kunnen we met rode koolsap een geheime boodschap schrijven? De kleurstof is paarsblauw. Dit komt omdat het rodekoolsap van nature een pH van 7 à 8 heeft. Maar in een zure vloeistof wordt het rodekoolsap rood. Citroensap is zuur en staat daarom protonen (H+) af. Deze reageren met het anhydrobase (de kleurstof in het rodekoolsap) en vormt zo flavylium cation. Dit heeft een rode kleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 400 gram rode kool (fijn gesneden) – 500 ml water – Citroensap
- Thema: neutralisatiereactie– biochemie
- Tijd: 15 min
- Begrippen: pH-indicatoren
4.37. Effect van verdunde zuren en basen op indicatoren

- Info:Tussen welke pH-waarde zit het omslaggebied van de zuur-base indicatoren? Broomthymolblauw en methyloranje zijn indicatoren die bij HCl en buffer A een andere kleur hebben dan hun oorspronkelijke kleur. Bij buffer B en NaOH zie je duidelijk dat ze hun eigen kleur hebben.Broomthymolblauw heeft bij H₂O zijn oorspronkelijke kleur nog niet helemaal terwijl methyloranje wel al zijn oorspronkelijke kleur heeft bij H₂O.Thymolftaleïne behoudt zijn oorspronkelijke kleur tot NaOH. Bij NaOH heeft Thymolftaleïne zijn oorspronkelijke kleur niet meer. Hier verkregen we een donkerblauwe kleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Broomthymolblauw – Methyloranje – Thymolftaleïne – Buffer A pH 4: Citroenzuur 2,86 g en Boorzuur 3,1 g op 250 ml. – Buffer B pH 9: NaHCO₃ en Na₂CO₃: Verhouding: NaHCO₃ 9x en Na₂CO₃ 1x – Gedestilleerd water – Zoutzuur (HCl) 0,1 mol/l – Natriumhydroxide (NaOH) 0,1 mol/l
- Thema: neutralisatiereactie– biochemie
- Tijd: 35 min
- Begrippen: pH-indicatoren
4.38. pH range van indicatoren
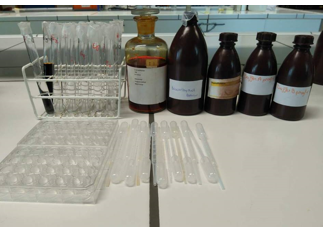
- Info:Hoe reageren indicatoren op verschillende pH’s ? Indicatoren hebben verschillende kleuromslag gebieden .
- Moeilijkheid: eenvoudig
- Chemische stoffen: Broomthymolblauw – Methyloranje – Thymolftaleïne – Buffer A pH 4: Citroenzuur 2,86 g en – Boorzuur 3,1 g op 250 ml. – Buffer B pH 9: NaHCO₃ en Na₂CO₃
- Thema: neutralisatiereactie– biochemie
- Tijd: 35 min
- Begrippen: pH-indicatoren
4.39. Zuur-base indicatoren in blisters

- Info: Welke kleuren krijgen de zuur-base indicatoren in een zuur en basisch milieu?
- Moeilijkheid: eenvoudig
- Chemische stoffen: gedestilleerd water – rode koolsap – citroenzuur – kalkwater huishoudammoniak – HCl-oplossing – NaOH-oplossing – methylrood – thymolftaleïne
- Thema: neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH-indicatoren
4.40. Microschaal en rode koolsap
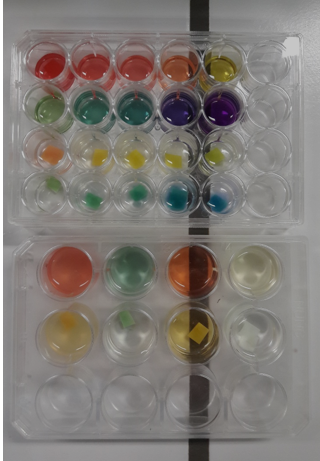
- Info: Hoe kunnen we de pH van verscheidene producten en voedingsmiddelen waarnemen en bepalen? De indicatoren in de oplossingen zijn allemaal van kleur veranderd door de aanwezige componenten in de oplossingen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universele indicator – Oplossing A: H3BO4 opl. 0,2mol/l + C6H8O7 opl. 0,05mol/l – Oplossing B: Na3PO4.12H2O opl. 0,1mol/l – citroensap – cognac – bleekwater
- Thema: neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH-indicatoren
4.41. Microschaalexperimenten met zuur-base indicatoren

- Info: Hoe reageren bepaalde zuur-base indicatoren op NaOH- en HCl-oplossing? Welke invloed heeft concentratie van deze oplossingen op de kleur van de indicatoren? Alle indicatoren hebben een bepaald punt(een bepaalde pH waarde) waarop ze van kleur veranderen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH opl. 0,01 mol/l – NaOH opl. 0,1 mol/l – HCl opl. 0,01 mol/l – Universele indicator – methyloranje – thymolblauw – thymolftaleïne
- Thema: neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH-indicatoren
4.42. Omslaggebieden van zuur-base indicatoren in een nunclonschaaltje

- Info: Hoe kunnen we de kleuren van indicatoren voorstellen en bepalen hoeveel zuur of base nodig is om de indicator van kleur te doen veranderen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 0,1 mol/l – HCl 0,1 mol/l – indicatoren: fft, methylrood, methyloranje, lakmoespapier, universeelindicator
- Thema: neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH-indicatoren
4.43. Druppelpracticum: zuren en basen onderzoeken met indicatoren

- Info: Hoe kunnen we met eenvoudige stoffen het volledige kleurenpalet van de universeelindicator maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 1mol/l – HCl 1mol/l – H2SO4 1mol/l – HNO3 1mol/l – Na2CO3 0,5 mol/l – NH3 1mol/l – Azijnzuur – Citroensap – Zeepoplossing – Universele indicatoroplossing
- Thema: neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH-indicatoren
4.44. Voedingsmiddelen als indicatoren

- Info: Welke natuurlijke producten kunnen we gebruiken als indicator? Rodekoolsap bevat een pigment genaamd cyanidine. Het wordt gebruikt om de zuurgraad van oplossingen te meten. De stof is rood in zeer zure oplossingen (pH < 2), roze in zure oplossingen (pH 2-7), paars in neutrale oplossingen (pH ~ 7), groen in basische oplossingen (pH 7-12) en geel in zeer basische oplossingen (pH > 12) waar het pigment volledig gereduceerd is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: enkele verse koolbladeren, – een theezakje (zwarte thee), – citroensap, – azijn
- Thema: neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH-indicatoren – zuurtegraad
4.45. pH bepalen met zo weinig mogelijk indicatoren

- Info: Het is mogelijk om aan de hand van de verkleuring van fenolftaleïne in een zuur of basisch milieu te achterhalen welke oplossing in welke fles zit. Deze proef steunt op de zelfde basis als het uitvoeren van een eenvoudige zuur-base titratie, namelijk de kleuromslag van de indicator in een zuur of basisch milieu.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,5 mol/ l HCl met fft – 1 mol/l HCl met fft – 1 mol/l NaOH – 0,5 mol/l NaOH – 0,1 mol/l NaOH
- Thema: neutralisatiereacties
- Tijd: 35 min
- Begrippen: indicator– identificatiereactie
4.46. pH bepalen met zo weinig mogelijk indicatoren

- Info: Het is mogelijk om aan de hand van de verkleuring van fenolftaleïne in een zuur of basisch milieu te achterhalen welke oplossing in welke fles zit. Deze proef steunt op de zelfde basis als het uitvoeren van een eenvoudige zuur-base titratie, namelijk de kleuromslag van de indicator in een zuur of basisch milieu.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,5 mol/ l HCl met fft – 1 mol/l HCl met fft – 1 mol/l NaOH – 0,5 mol/l NaOH – 0,1 mol/l NaOH
- Thema: neutralisatiereacties
- Tijd: 35 min
- Begrippen: indicator– identificatiereactie
4.47. Schilderwerk met zuur-base indicatoren
- Info: Een petrischaal wordt met gedestilleerd water gevuld en op de projector geplaatst. Aan de oplossing worden enkele druppels thymolblauw toegevoegd. De oplossing kleurt geel . Eventueel kan ter controle de pH van gedestilleerd water bepaald worden a.h.v. een teststrip met universeel indicator.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Indicatoren: vb. thymolblauw, methyloranje, broomcresolgroen, broomthymolblauw, fenolftaleïne, – Zure en basische oplossingen – Natriumwaterstofsulfaat en natriumwaterstofcarbonaat (soda) poeder.
- Zure en basische producten uit het dagelijkse leven
- Thema: neutralisatiereacties
- Tijd: 35 min
- Begrippen: pH-indicator– identificatiereactie
4.48. Verkleuring bloemblaadjes

- Info: Heeft de pH een invloed op de kleur van bloembladeren? Veel kleurstoffen in bloemen zijn indicatoren die verkleuren indien ze van een zuur naar een basisch milieu (of omgekeerd) gaan. Aangezien ammonia basisch is zien we hier het effect van een basisch milieu op de donkerkleurige kleurstoffen in het bloemblad.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammonia – Gekleurde bloemen
- Thema: neutralisatiereacties
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.49. Kleurrijke cocktail

- Info: Hoe maak je alginaatballetjes en waarvoor kan je ze gebruiken? Je kan alginaatballetjes vormen met binnenin een indicator. Wanneer je deze balletjes in contact laat komen met een stof, gaat deze stof in het balletje doordringen en verandert de indicator van kleur volgens de pH van de stof waarmee het balletje in contact komt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: calciumchloride – natriumalginaat
- Thema: neutralisatiereacties – kunststoffen
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.50. Zuurpatronen
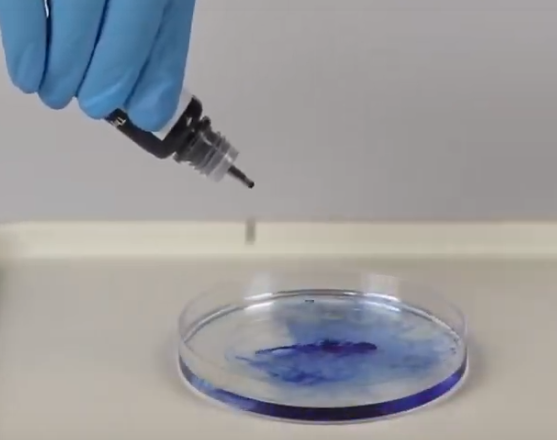
- Info: Hoe kunnen we in oplossing bepaalde kleurpatronen vormen? Thymol blauw verandert van kleur afhankelijk van het medium waarin het zich bevindt. Het is een pH-indicator. In een basisch medium wordt het blauw; in een zuur medium wordt het rood, in een bijna neutraal medium wordt het geel. Blauw, rood en geel worden als primaire kleuren beschouwd omdat het combineren ervan vele extra variaties kan opleveren: blauw + geel = groen, geel + rood = oranje, rood + blauw = violet.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2CO3 oplossing 5% – NaHSO4 oplossing 5% – Thymol blauw – Water
- Thema: neutralisatiereacties – kunststoffen
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.51. Water in wijn veranderen

- Info: Hoe kunnen we in het labo water in wijn doen veranderen? Fenolftaleïne (3,3-bis (4-hydroxyfenyl) ftalide) is een wit kristallijn poeder, onoplosbaar in water, en slecht oplosbaar in alcohol of base. In het basische bereik (pH 8,4-10,0) weegt het zwaarder dan het chinoïde structuur (zie figuur 1). Deze gedeprotoneerde vorm van de indicator heeft een gedelokaliseerd pi-elektron-systeem, waarbij de Fenolftaleïenoplossing roze zal kleuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumwaterstofcarbonaat – Fenolftaleïne – Gedemineraliseerd water
- Thema: neutralisatiereacties
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.52. Zwarte thee als pH indicator

- Info: Hoe kunnen we thee gebruiken als zuur-base indicator? De bladeren van zwarte thee bevatten een grote hoeveelheid thearubigin – het pigment dat verantwoordelijk is voor de kleur van de drank.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zwarte thee – NaOH 0,1 mol/l – Citroensap
- Thema: neutralisatiereacties
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.53. pH rainbowtube

- Info: Rode kool bevat een in water oplosbaar pigment, anthocyanine genaamd, dat van kleur verandert wanneer het wordt gemengd met een zuur of een base. Het pigment wordt rood in zure milieus met een pH lager dan 7 en het pigment wordt blauwachtig groen in alkalische (basische) omgevingen met een pH groter dan 7.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 0,1 mol/l – NaOH 0,1 mol/l – rode koolsap
- Thema: neutralisatiereacties
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.54. pH papiertjes met rodekoolsap

- Info: Rode kool bevat pigmenten die bekend staan als anthocyanen. Anthocyanen zijn ook te vinden in veel fruit, groenten en bessen, zoals bosbessen, rode druiven, rode uien, enzovoort. Ze veranderen van kleur in overeenstemming met de zuurgraad van hun omgeving – een eigenschap die u kan helpen bij het bepalen van de pH van verschillende stoffen om u heen!
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 0,1 mol/l – NaOH 0,1 mol/l – rode koolsap
- Thema: neutralisatiereacties
- Tijd: 15 min
- Begrippen: pH-indicator– identificatiereactie
4.55.Blauwe bessen als zuur-base indicator

- Info: Hoe kunnen we blauwe bessen als zuur-base indicator gebruiken? Het blauwe bessensap verkleurt in de verschillende oplossingen. In een zuur milieu, citroensap of azijn, geeft het een roze kleur. In een alkalisch milieu, NaHCO3-oplossing, kleurt het sap blauw.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Blauwe bessensap – Natriumwaterstofcarbonaatoplossing 10 g/ 100 ml oplossing – natriumhydroxide
- Thema:neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie – pH indicator
4.56. Blauwe letters op een geel papier

- Info: Hoe kunnen we een papiertje een gele achtergrond geven en vervolgens blauw laten kleuren zonder pennen of stiften te gebruiken? Broomthymolblauw is een zuur-base-indicator en kleurt geel in een zuur milieu en blauw in een basisch milieu. De alkoholische broomthymolblauwoplossing is geel gekleurd en daarom dus zuur. Het natriumchloride dissocieert in het water en dient als elektrolyt om de stroom te geleiden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Spijker – Tafelzout (natriumchloride) of kaliumchloride – Broomthymolblauw – Ethanol
- Thema:neutralisatiereactie – redoxreactie
- Tijd: 20 min
- Begrippen: elektrolyse – pH indicator
4.57. Universele indicator

- Info: Hoe werkt een universele indicator? De universele indicator is een mix van verschillende indicatoren. Het toont zuren geel, oranje tot diep rood. In alkalische oplossingen wordt het lichtblauw tot diep paars. Neutrale vloeistoffen zijn groen gekleurd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10 ml universele indicator – 10 ml zoutzuur 0.1 mol/l – 10 ml natriumhydroxide 0.1 mol/l
- Thema:neutralisatiereactie
- Tijd: 20 min
- Begrippen: pH indicator
4.58. Zuurdetectie met gummibeertjes

- Info: Bevat een gummibeer zuur? De gummibeertje bevat fruitzuur dat oplost in het water . Organische zuren verkleuren ook de universele indicator geel-rood. Organische zuren zijn meestal zwakke zuren, zodat er geen dieprode kleurverandering te zien is, maar alleen lichtgeel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gummibeertjes – 10 druppels universele indicatoroplossing
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator
4.59. Bereiding van pH indicatorpapier

- Info: Hoe kun pH indicatorpapier maken met natuurlijke stoffen ? Tannines zijn condensaten met meerdere fenolgroepen. In de basissubstantie zijn twee fenolverbindingen terug te vinden pyrocatechine en pyrogallol. Deze tanninens kunnen uit kastanjes, eikels en bladeren worden gewonnen.De tannines kunnen aangewend worden bij kleurstoffen. Met galluszuur kunnen de pyrogalloltanninen een pH indicator geven. De galluszuren reageren met ijzer(III)ionen tot complexe kleurpigmenten die verschillende kleuren geven afhankelijk van de pH.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Galluszuur 0.05 mol/l – Ijzer(III)chloride oplossing 0.015 mol/l – Zoutzuur 2 mol/l – Natriumhydroxide oplossing 2 mol/l
- Thema:neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH indicator
4.60. Onzichtbare verf

- Info: Hoe kun je een tekening “terugtoveren”?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,5 g fft – 60 ml 95% ethanol – 0,5 g thymolftaleïne – 2 g m-nitrofenol – 0,2 g NaOH – 500 ml water
- Thema:neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH indicator
4.61. Zwavel als zuur-base indicator

- Info: Hoe kan zwavel optreden als zuur-base-indicator? Zwavel, dat verwarmd wordt in een geconcentreerde oplossing van natriumhydroxide, lost op en vormt polysulfide-ionen. De reactie is tamelijk traag omdat de hydroxide-ionen moeten reageren met octazwavelmoleculen aan het oppervlak van vast zwavel. Zwavelpoeder wordt gebruikt om de reactiesnelheid te verhogen. De hydroxide-ionen in de oplossing vallen aan op één van de bindingen in het S8-molecule.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 250 ml natriumhydroxide-oplossing 1 mol/l – 15 g zwavelpoeder – vloeibaar detergent – 100 ml 0,1 mol/l azijnzuuroplossing – 100 ml 0,1 mol/l zoutzuuroplossing – 100 ml 0,1 mol/l zwavelzuuroplossing – 100 ml 0,1 mol/l salpeterzuuroplossing – 100 ml 0,1 mol/l fosforzuuroplossing – 100 ml gedestilleerd water – 100 ml 0,1 mol/l natriumchloride-oplossing – 100 ml 0,1 mol/l natriumhydroxide-oplossing – 25 ml 1 mol/l zoutzuuroplossing
- Thema:neutralisatiereactie
- Tijd: 25 min
- Begrippen: pH indicator
4.62. Anthocyanen en metaalionen.
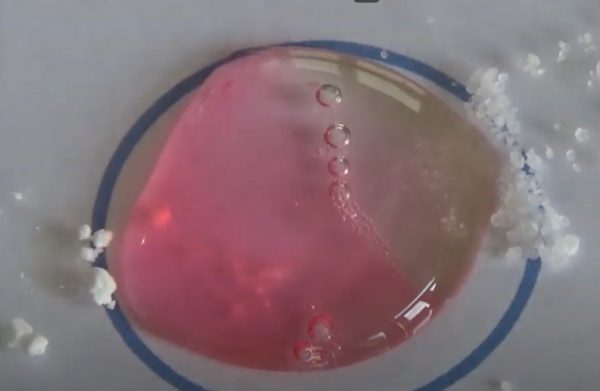
- Info: Hoe kun je met rode koolsap de pH schatten van een aantal zoutoplossingen? Aan de hand van de zelfgemaakt kleurindicator met rode kool en de verschillende pH buffers kunnen de pH van de metaalionen achterhaald worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: rodekoolsap als indicator – bufferoplossingen met pH – Telkens 0,1 mol/l FeCl2, MnCl2, AlCl3, ZnCl2-oplossing
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH indicator – zuursterkte
4.63. Bosbessensap met citroenzuur en natriumcarbonaat

- Info: Hoe kun je een pH-kleurengradiënt maken met bosbessensap?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bosbessenextract – Citroenzuur (C6H8O7) – Natriumcarbonaat (Na2CO3)
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH indicator – zuursterkte
4.64. Buffers (1,4,7,9,13) en indicatoren en mengsels

- Info: Hoe kun je zelf een mixed indicator maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: pH buffers (pH: 1,4,7,9,13) – Broomthymolblauw (BB) – Methyloranje (MO) – Fenolftaleïne (PP) – Universele indicator
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH indicator
4.65. Natriumcarbonaat en citroenzuur en universele indicator.
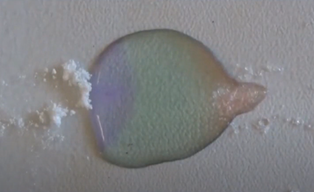
- Info: Hoe kun je een pH-gradiënt maken in een druppel? Aan de kant van het citroenzuur kleurt de pH-indicator zuur (rood van kleur), aan de kant van het natriumcarbonaat kleurt de pH-indicator basisch (blauw van kleur). Centraal is de pH ongeveer neutraal. Na verloop van tijd komen de stoffen in oplossing door diffusie naar elkaar toe en ontstaat een concentratiegradiënt en pH-gradiënt. Bij contact gaat uiteindelijk het natriumcarbonaat reageren met citroenzuur met vorming van waterstofcarbonaat wat ontleedt en koolzuurgas vrijzet.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Universele indicatoroplossing – Citroenzuur – Natriumcarbonaat
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH indicator
4.66. Rozenkleurstof met citroenzuur en natriumcarbonaat
- Info:Hoe kun je een pH-kleurengradiënt maken met rozenblaadjes? De kleurstof anthocyanidine, die in een rode roos voorkomt, behoort tot de groep der anthocyanen. Anthocyanen kunnen gebruikt wordt als zuur-base-indicator. Hun structuur en kleur zijn sterk afhankelijk van de zuurgraad van hun omgeving.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Rozenkleurstof – Citroenzuur (C6H8O7) – Natriumcarbonaat (Na2CO3)
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: pH indicator
4.67. Verdwijnende inkt

- Info: Hoe kun je een geschreven tekst doen verdwijnen op een labojas? Fenolftaleïne is een indicator, die roze wordt in aanwezigheid van een base. Ammoniak is een base. Katoen is echter zuur en zorgt ervoor dat de fenolftaleïne weer helder wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniak 0,1 mol/l – Fenolftaleïne
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator
5. Neutralisatiereacties
5.1. Blaas het meeste koolstofdioxide

- Info:Door het blazen komt er koolstofdioxide (CO2) in het kalkwater. Het kalkwater bevat Ca(OH)2. Het gas reageert met dit calciumhydroxide en vormt het CaCO3 of calciumcarbonaat. Dit is vast te stellen door de vorming van een witte troebel. Bij het blijvend blazen lost de troebel terug op vermits het toegevoerde koolstofdioxide de oplossing ook gaat verzuren.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kalkwater
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator – identificatie koolzuurgas
5.2. Misconcept over neutralisatiereacties

- Info: Is het toevoegen van suiker aan citroensap ook een neutralisatiereactie? Suiker neutraliseert zuur niet. Het maskeert de zure smaak.
- Moeilijkheid: eenvoudig
- Chemische stoffen: citroensap – universele indicator – kalkpoeder – suiker
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: pH indicator – begrip zuur
5.3. Temperatuur van een neutralisatiereactie

- Info: Wat zal er gebeuren met de temperatuur tijdens een neutralisatiereactie?
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 5 mol/l – NaOH 5mol/l
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: effect neutralisatie op temperatuur
5.4. Walmende kousen

- Info: Hoe kunnen we een walm van damp vrijzetten uit sokken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH3 oplossing half verdund – HCl oplossing half verdund
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: neutralisatie van twee gassen
5.5. Zuiver zand

- Info: Hoe kunnen we met een neutralisatiereactie zand maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: zoutzuur 2mol/l (35ml) – waterglas (Na2SiO3) 37% (20ml) – water (50ml)
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: reactie tussen zout en zuur
5.6. Citroenzuur en natriumcarbonaat.

- Info: Hoe kunnen we met een neutralisatiereactie citroenzuur aantonen? Door toevoegen van citroenzuur aan water, lost het citroenzuur op. Door de indicator gaat de kleur van de oplossing veranderen. De oplossing wordt zuurder. Door toevoegen van natriumcarbonaat gebeurt er een chemische reactie en verkleurt de oplossing weer
- Moeilijkheid: eenvoudig
- Chemische stoffen: universele indicator – citroenzuur – natriumcarbonaat – water
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: reactie tussen zout en zuur
5.7. Neutralisatiereactie van tafelazijn met kalkwater

- Info: Hoe zal kalkwater huishoudazijn neutraliseren?
- Moeilijkheid: eenvoudig
- Chemische stoffen: kalkwater – universele indicator – huishoudazijn
- Thema:neutralisatiereactie
- Tijd: 15 min
- Begrippen: reactie tussen base en zuur
5.8. Begrip neutralisatie voorstellen

- Info: Wat is de invloed op de pH-waarde wanneer we een sterke base toevoegen aan een sterk zuur? De pH is een maat voor de zuurgraad (ook wel zuurtegraad) van een waterige oplossing. De pH van een neutrale waterige oplossing ligt bij kamertemperatuur rond de 7. Zure oplossingen hebben een pH lager dan 7, en dus een hoge zuurgraad. Basische oplossingen hebben een pH hoger dan 7 en dus een lage zuurgraad.
- Moeilijkheid: eenvoudig
- Chemische stoffen: indicatorpapier1-14, stukjes van maximaal 0,5 cm – HCl-oplossing 0,1 mol/liter – NaOH-oplossing 0,1 mol/liter
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: reactie tussen base en zuur
5.9. Invloed van acetaationen op de zuurtegraad van azijnzuur
- Info: Hoe beïnvloeden acetaationen de zuurtegraad van azijnzuur? De aanwezigheid van acetaationen drukt de ionisatie van azijnzuur nog meer terug. Het is beter calciumcarbonaat te gebruiken dan een ander carbonaat omdat dit onoplosbaar is in water. Een oplosbaar carbonaat wordt verspreid in de zure oplossing waardoor de reactie te snel verloopt om nog enige waarneming te kunnen doen. Bovendien kleven de calciumcarbonaatdeeltjes aan de gasbellen wat het schuimen doet ontstaan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 ml universeelindicator – 75 g calciumcarbonaat – 180 ml 2 mol/l azijnzuur – 27 g natriumacetaat – 20 ml gedestilleerd water – 100 ml 2 mol/l zoutzuur
- Thema:neutralisatiereactie
- Tijd: 35 min
- Begrippen: bufferwerking
6. Titraties
6.1. Bepaling van gehalte azijnzuur in tafelazijn in een nunclonschaaltje

- Info: Hoeveel azijnzuur zit er in tafelazijn? Titratie in een nunclonplaatje
- Moeilijkheid: gemiddeld
- Chemische stoffen: 5 ml tafelazijn – 5 ml 0,10 mol/l NaOH – Fenolftaleïne 1%
- Thema:neutralisatiereactie – biochemie
- Tijd:30 min
- Begrippen: titratie
6.2. Bepaling van het ammoniakgehalte in vensterreiniger door titratie

- Info: Hoeveel is het ammoniakgehalte in vensterreiniger?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Ammoniakoplossing 9,6-9,9% als ontvlekker – HCl-oplossing 0,1mol/l
- Thema:neutralisatiereactie – biochemie
- Tijd:30 min
- Begrippen: titratie
6.3. Bepaling van het gehalte citroenzuur in een bloedrode sinaasappel

- Info: Hoeveel citroenzuur zit er in een bloedrode sinaasappel? De indicator die zich van naturen in bloedrode sinaasappels zit is anthocyaan. In zuur milieu kleurt deze rood; in basisch milieu kleurt deze blauw/groen.
De kleuromslag gebeurt bij de neutralisatie van de derde zuurfunctie met een pKz van 6,4. - Moeilijkheid: eenvoudig
- Chemische stoffen: NaOH 0,1 mol/l, – bloedrode sinaasappelsap,
- Thema: neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie
6.4. Hoeveel koolstofdioxide bevat uitgeademde lucht?

- Info: Hoeveel CO2 bevindt er zich in uitgeademde lucht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fenolftaleïne – Ca(OH)2 verzadigd – HCl-oplossing 0,05M
- Thema: neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie – terugtitratie

- Info: Hoe kunnen we gehalte vitamine C bepalen? Vitamine C tabletten bestaan meestal uit ascorbinezuur (C6H8O6) en een bindmiddel zetmeel. Het ascorbinezuur is een éénwaardig zuur. De pKz waarde bedraagt 4.17.
- Moeilijkheid: gemiddeld
- Chemische stoffen: vitamine C tabletten – NaOH 0.1 mol/l – fft
- Thema:neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie
6.6. Het azijnzuurgehalte bepalen door titratie?

- Info: Hoeveel is het azijnzuurgehalte van tafelazijn?
- Moeilijkheid: gemiddeld
- Chemische stoffen: tafelazijn – Fenolftaleïne – Water – NaOH 0,10 mol/l
- Thema:neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie
6.7. Hoe kun je een hoeveelheid koolstofdioxide doseren?
- Info: Hoeveel CO2 bevindt er zich in uitgeademde lucht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fenolftaleïne – Ca(OH)2 verzadigd – HCl-oplossing 0,05M
- Thema: neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie – terugtitratie
6.8. Microschaaltitratie van vitamine C in fruitsap

- Info: Hoe kunnen we gehalte vitamine C bepalen? Jodaat vormt met jodide in een zure oplossing jood.Ascorbinezuur is in oplossing makkelijk te oxideren tot dehydro-ascorbinezuur. Als oxidator kan een joodoplossing gebruikt worden:
- Moeilijkheid: gemiddeld
- Chemische stoffen: vitamine C tabletten – zwavelzuur 2 mol/l – KI oplossing 2 mol/l – KIO3 oplossing 0.03 mol/l – zetmeeloplossing
- Thema: redoxreactie – biochemie
- Tijd: 40 min
- Begrippen: titratie
6.9. Microschaaltitratie

- Info: Hoe kunnen we de concentratie van tafelazijn doseren? De pH van de oplossing gaat ook steeds veranderen. De pH is op het begin aan de lage kan door het zuur azijn. Naar mate er meer natriumhydroxide wordt toegevoegd word de oplossing meer base en slaat het dan om als natriumhydroxide in overmaat aanwezig is gaat pas de kleur omslaan bij thymolftaleïne. We hebben dan al een pH die rond de 10 zit.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Thymolftaleïne – Huishoudazijn – Natriumhydroxide (NaOH) 1mol/l
- Thema: neutralisatiereactie – biochemie
- Tijd: 40 min
- Begrippen: titratie
6.10. Neutralisatiereactie door temperatuurmeting

- Info: Hoe kunnen we via temperatuursmeting de concentratie van een HCl-oplossing bepalen?
- Moeilijkheid: gemiddeld
- Chemische stoffen: HCl 2,0 mol/l – NaOH 2 mol/l
- Thema: neutralisatiereactie
- Tijd: 40 min
- Begrippen: titratie – meten van temperatuur tijdens de neutralisatie
6.11. Neutralisatiereactie

- Info: Hoeveel ml NaOH 0,1M moeten we toevoegen om 5 ml HCl 0,1mol/l te neutraliseren?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Universeel indicatorpapier – HCl-oplossing 0,1M
- Thema: neutralisatiereactie
- Tijd: 40 min
- Begrippen: titratie – meten van temperatuur tijdens de neutralisatie
6.12. Puzzeltitratie

- Info: Het is mogelijk om aan de hand van de verkleuring van fenolftaleïne in een zuur of basisch milieu te achterhalen welke oplossing in welke fles zit. Deze proef steunt op de zelfde basis als het uitvoeren van een eenvoudige zuur-base titratie, namelijk de kleuromslag van de indicator in een zuur of basisch milieu.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,5 mol/ l HCl met fft – 1 mol/l HCl met fft – 1 mol/l NaOH – 0,5 mol/l NaOH – 0,1 mol/l NaOH
- Thema: neutralisatiereacties
- Tijd: 35 min
- Begrippen: indicator– identificatiereactie – titratie
6.13. Titratie van bicarbonaat in leidingwater

- Info: Hoeveel bicarbonaat zit er in leidingwater?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Methyleenblauw – Neutraalrood – Kraanwater – 0,1 mol/l HCl
- Thema: neutralisatiereacties
- Tijd: 35 min
- Begrippen: titratie
6.14. Titratie van fosforzuur in cola

- Info: Hoeveel fosforzuur zit er in cola? Via de reactie met natriumhydroxide en de indicatorwordt 1 zuurfunctie geneutraliseerd.
- Moeilijkheid: eenvoudig
- Chemische stoffen: tft oplossing (thymolftaleïne 0,05% in ethanol) – Natriumhydroxide 0,1 mol/l – Neutraalrood (0,1% in water) – Methyleenblauw (0,1% in water) – Cola
- Thema: biochemie – neutralisatiereactie
- Tijd: 15 min
- Begrippen: titratie
6.15. Zuur-base titratie in nuclonschaaltje
- Info: Hoeveel druppels moet je toevoegen op een kleurverandering te krijgen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fenolftaleïne – 0,1 mol/l NaOH – 0,1 mol/l HCl
- Thema: neutralisatiereactie
- Tijd: 25 min
- Begrippen: titratie
6.16. Zuurgehalte van melkproducten

- Info: Hoeveel zuur bevat melk? Je bepaalt de concentratie door een titratie met een sterke base
- Moeilijkheid: eenvoudig
- Chemische stoffen: Melk – NaOH 0,1 mol/l – 2% fft; – 5% kobaltdichlorideoplossing
- Thema: biochemie – neutralisatiereacties
- Tijd: 20 min
- Begrippen: titratie
6.17. Titratie van zwak zuur met sterke base

- Info: Wat is de concentratie van tafelazijn door titratie met een geijkte NaOH-opl?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Tafelazijn – NaOH-oplossing (0,1 mol/L)
- Thema: biochemie – neutralisatiereacties
- Tijd: 40 min
- Begrippen: titratie
7. Uitdagingen
7.1.Maak de mooiste schilderij met indicatoren

- Info: Op welke manier kunnen we met indicatoren en melk een kunstwerkje maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Melk (halfvolle en volle) – pH-indicatoren – Bakpoeder (NaHCO3) – Natriumwaterstofsulfaat (NaHSO4) – Zoutzuuroplossing 0,1 mol/l (HCl) – Natriumhydroxideoplossing 0,1 mol/l (NaOH)
- Thema: biochemie – neutralisatiereacties
- Tijd: 30 min
- Begrippen: pH-indicatoren






