Bufferoplossingen
1.Onderzoeksvraag
Hoe reageert een buffer na toevoeging van een zuur of een base in vergelijking met andere stoffen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- buffers
b.Materiaal + stoffen
- 5 petrischalen
- Demiwater
- Kraanwater
- Mineraalwater
- Azijnzuur
- Natriumacetaat
- Zoutzuur 0,1 mol/l
- NaOH 0,1 mol/l
- Universeelindicator
- Natriumwaterstofcarbonaat
Bereiding oplossingen
0,1 M HCl:
- 0,1 M = 0,1 mol /l
- Molecuulmassa van zoutzuur is 36,5 g/mol
- 0,1 . 36,5 = 3,65 gram HCl per liter bevat je oplossing.
- Mits geconcentreerd zoutzuur 37% is: 3,65 . (100/37) = 9,9 gram.
Dit is de hoeveelheid die je dient af te wegen.
- Omdat de dichtheid 1,19 g/ cm3 is, weten we dat je ook gewoon 8,3 ml kan afmeten en toevoegen aan 1l water.
0,1M NaOH
- 0,1 M = 0,1 mol /l
- Molecuulmassa van natriumhydroxide is 40 g/mol
- M = n. M = 0,1 . 40 = 4 gram NaOH per liter
0,1M NaHCO3
- 0,1 M = 0,1 mol /l
- Molecuulmassa van natriumwaterstofcarbonaat is 84 g/mol
- m = n. M = 0,1 . 84 = 8,4 g/l
Opstelling (foto)
3.Uitvoeren
a.Werkwijze
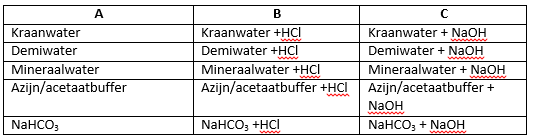
- Bereid een oplossing van NaHCO3 0,1 mol/l en een oplossing van HAc en NaAC O,1 mol/l
- Vul telkens drie vakken van petrischalen met gelijke hoeveelheden kraanwater, demiwater, mineraalwater, azijn/acetaatbuffer en natriumwaterstofcarbonaat.
- Kleur de oplossingen met universeelindicator.
- Merk met a,b,c
- Houd vakken a telkens als referentie.
Voeg aan de vakken b eerst 1 druppel, dan 0,5 ml en vervolgens 2,5 ml zoutzuur toe. - Noteer de pH-veranderingen en vergelijk de oplossingen.
- Voeg aan de vakken c eerst 1 druppel, dan 0,5 ml en vervolgens 2,5 ml NaOH toe en noteer.
b.Waarneming (+ foto’s)
Demiwater (pH: 6,0, geelgroen), kraanwater (pH 7; groen) en mineraalwater (4,5 oranjerood) verkleuren allen reeds na 1 druppel zuur naar rood en loog naar violet. Alleen mineraalwater met loog doet er wat langer over om basisch te worden.
Azijnzuur/acetaatbuffer (pH 4) blijft rood met zuur, maar met loog na 1 druppel rood, na 0,5 ml roodoranje en na 2,5 ml oranje gekleurd. De buffer werkt dus goed en zorgt ervoor dat de pH niet snel omslaat.
Waterstofcarbonaat (pH 7,5 blauwgroen) wordt geelgroen met zuur en violet met loog.


Opmerking:
De pH van koolzuurhoudend mineraalwater verloopt door het verdampen van CO2. Op een warm oppervlak is de rode oplossing na 10 minuten al oranjegeel, na 15 minuten is de oplossing geelgroen en na 20 minuten groen.
4.Reflecteren
Een buffer of een zuurteregelaar is in de chemie een waterige oplossing van twee stoffen die zich in een bepaald evenwicht bevinden en een bepaalde pH aannemen. Bij verdunning, toevoegen van een zuur of een base zal deze pH nagenoeg constant blijven. De verstoring van het evenwicht en de zuurtegraad wordt dus ‘gebufferd’.
Bufferoplossingen bestaan steeds uit een zuur/basekoppel; ofwel een zuur en het zout van zijn geconjugeerde base, ofwel een base en het zout van zijn geconjugeerd zuur. Beide zijn steeds zwakke zuren of basen, ze zullen dus onvolledig reageren.
De werking van een bufferoplossing steunt op het principe van Le Châtelier-Van ’t Hoff, nl. een verstoring van de evenwichtsreactie zal steeds worden tegengewerkt, door een tijdelijke verschuiving in de reactie.
We nemen het bufferpaar CH3COONa/CH3COOH.
Het natriumacetaat(zout) dissocieert volledig in water
CH3COONa –> CH3COO– + Na+
Wordt een zuur toegevoegd, dan zal het proton reageren met de geconjugeerde base in het buffer:
CH3COO– + H3O+ –> CH3COOH + H2O
Het omgekeerde gebeurt als een base wordt toegevoegd, de OH- reageert met het zwakke zuur:
CH3COOH + OH– –> CH3COO– + H2O
5. Aanvullingen
Er zijn ook indicatoren die meerdere kleuren krijgen over een breed bereik van pH-waarden. Vaak wordt dit gerealiseerd door gebruik te maken van een mengsel van indicatoren. Door de kleur te vergelijken met voorbeelden in een tabelletje kan de pH geschat worden. Zulke indicatoren worden universeelindicatoren genoemd. Meng-indicator methylrood-broomcresolgroen is hier een eenvoudig voorbeeld van.






