Begrip neutralisatie
Onderzoeksvraag
Wat is de invloed op de pH-waarde wanneer we een sterke base toevoegen aan een sterk zuur?
- Voorbereiding
Materiaal + stoffen
- beker 100 ml
- meetspuit 5 ml en 10 ml
- indicatorpapier1-14, stukjes van maximaal 0,5 cm
- witte achtergrond
- roerstaafje
- HCl-oplossing 0,1 mol/liter
- NaOH-oplossing 0,1 mol/liter
Opstelling (foto)

- Uitvoeren
Werkwijze
- – Breng met de meetspuit van 5 milliliter exact 5 ml HCl-oplossing in de beker.

- Raak met het roerstaafje dat bevochtigd werd met de HCl-oplossing een stukje indicatorpapier aan en lees de pH-waarde af.
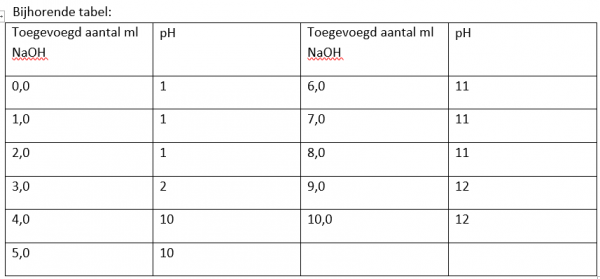
- Voeg stapsgewijs (zie tabel onderaan) in totaal 10 ml NaOH-oplossing toe met de meetspuit van 10 milliliter.
- Homogeniseer al roerend na elke stap. Lees telkens de pH-waarde af op een nieuw stukje indictorpapier.
- Noteer de pH-waarde in onderstaande tabel. Verzamel het afval en reinig het gebruikt materiaal.
Waarneming (+ foto’s)
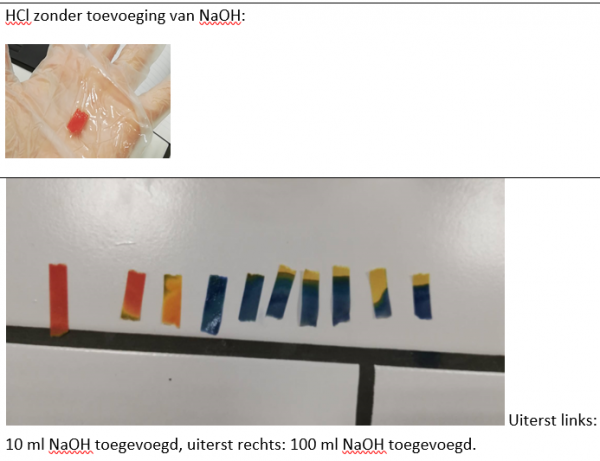
- Reflecteren
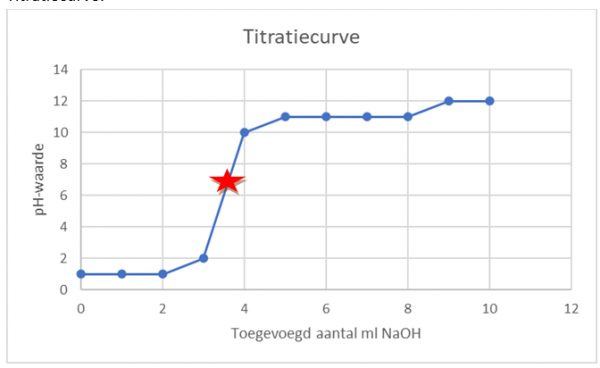
Het sterretje geeft aan waar dat de pH neutraal is.
Op de grafiek zien we dat de oplossing overgaat van een zuur naar een basen na 4 keer NaOH toe te voegen.
Onderstel dat je vertrekt van 5 ml NaOH-oplossing en stapsgewijs 10 ml HCl-oplossing toevoegt.
Teken op het mm-papier hieronder het verloop van de titratiecurve zoals jij die in dat geval voorspelt.
Optredende reacties
HCl + NaOH –> NaCl +H2O
De pH is een maat voor de zuurgraad (ook wel zuurtegraad) van een waterige oplossing. De pH van een neutrale waterige oplossing ligt bij kamertemperatuur rond de 7. Zure oplossingen hebben een pH lager dan 7, en dus een hoge zuurgraad. Basische oplossingen hebben een pH hoger dan 7 en dus een lage zuurgraad.






