Bereiden van bufferoplossingen tussen pH 6 en 9
1.Onderzoeksvraag
Hoe kan je een buffer van een zwak zuur en geconjugeerde base maken?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- buffers
b.Materiaal + stoffen
- Maatkolven van 500 ml (2x)
- Buretten (2x)
- Erlenmeyers (2x)
- Balans
- Universele indicator
- pH-meter
- Statief en klem (2x)
- 𝑁𝑎𝐻2𝑃𝑂4 ∙ 2𝐻2𝑂
- 𝑁𝑎2𝐻𝑃𝑂4 ∙ 2𝐻2𝑂
Bereiding oplossingen

3.Uitvoeren
a.Werkwijze
- Maak de buretopstelling klaar en breng in de eerste buret de natriumdiwaterstoffosfaatoplossing en in de andere de dinatriumwaterstoffosfaatoplossing
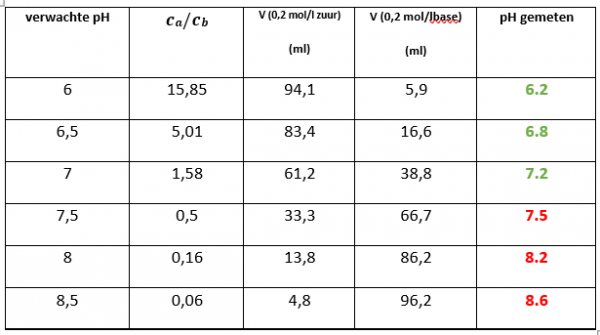
- Voor de buffer pH 6, breng je via buret 1 een volume van 94,1 ml in een maatkolf van 100 ml. Via buret 2 breng je een volume van 5,9 ml in het maatkofje.
- Maak de andere buffers door de verhoudingen te volgen uit de tabel hieronder.
- Meet daarna de pH-waarde aan de hand van een universeel indicatorpapier en plaats het resultaat in de onderstaande
- Vergelijk vervolgens het gemeten resultaat met de verwachte
- Herhaal dit voor al de andere volumes in de tabel. Merk op dat we steeds een bufferoplossing maken van ongeveer 100
- Nadat je van alle bufferoplossingen de pH berekend heb, controleer je dit voor de zekerheid nog eens met een pH-meter.
b.Waarneming (+ foto’s)

De pH verschilt wel degelijk naarmate we de bufferoplossingen veranderen. Het onderstaande kader geeft dit duidelijk weer.
4.Reflecteren
Optredende reacties: /
(Er treden geen specifieke reacties op.)
Theoretische achtergrond
Een chemische buffer is een waterige oplossing van twee stoffen die zich in een bepaald evenwicht bevinden en een bepaalde pH aannemen. De pH-waarde verandert nagenoeg niet bij een verdunning of toevoegen van zuur/base. De verstoring van het evenwicht wordt dus “gebufferd”.
Een typisch kenmerk aan een bufferoplossing is dat het steeds bestaat uit een zuur- basekoppel. Enerzijds kan dit een zuur zijn in combinatie met het zout van de geconjugeerde base. Anderzijds zijn er ook buffers van een base met het geconjugeerd zuur ervan. In dit practicum zijn we aan de slag gegaan met de bufferoplossing van een zwak zuur en zijn geconjugeerde base.
Bij de theorie rond buffers komt het begrip “buffercapaciteit” ook geregeld aan bod. De buffercapaciteit wordt gedefinieerd als de hoeveelheid sterk zuur/base die men aan 1 L buffer moet toevoegen om de pH van het buffermengsel met één eenheid te veranderen. Deze waard schetst bijgevolg een beeld van hoe “goed” een buffer al dan niet werkt. Anders gezegd: hoe hoger de buffercapaciteit, des te beter de buffer de pH-waarde stabiel kan houden bij toevoeging van zuur of base. Om de pH van een buffermengsel zelf te berekenen, kan je gebruik maken van de volgende vergelijking van Henderson-Hasselbach.
In het dagelijks leven worden buffers gebruikt in de biochemie en klinische chemie. Een bekend voorbeeld is de buffer van koolzuur en carbonaatzout in het bloed. Deze buffer zorgt voor een pH tussen 7,35 en 7,45. Een andere buffer in het bloed is hemoglobine. Dit zal je in de lessen biologie vast en zeker nog bespreken.
5. Aanvullingen
- Literatuur: wikipedia.be
- Film: https://youtu.be/U2RdYBjWeF0







