Hoofdstuk 5 – Experimenten
1. Energetische aspecten bij een chemische reactie
1.1. Activeringsenergie
1.1.1.Brandende suiker

- Info: Hoe kun je met modellen chemische stoffen ruimtelijk voorstellen? Het verbranden van een suikerklontje is een chemische reactie. Wanneer je het suikerklontje met as inwrijft, brandt het wel. Dit komt doordat de as meehelpt bij het verbranden van de suiker.
- Moeilijkheid: eenvoudig
- Chemische stoffen: paar suikerklontjes – beetje sigaretteas
- Thema: chemische reacties
- Tijd: 10 min
- Begrippen: activeringsenergie – katalysator
1.1.2. Verbranding van staalwol door toevoeging van elektrische energie

- Info: Kunnen we staalwol verbranden met een batterij?
- Moeilijkheid: eenvoudig
- Chemische stoffen:aluminiumfolie – staalwol
- Thema: chemische reacties – redoxreactie
- Tijd: 10 min
- Begrippen: activeringsenergie – verbrandingsreactie – roest
1.2. Algemeen
1.2.1. Classificatie van reacties op basis van energie-omzettingen
- Info: Kunnen we energie vormen en energie nodig hebben voor een chemische reactie? Wanneer we de stoffen samenbrengen, begint een chemische reactie.Welke energieomzetting vindt plaats tijdens de chemische reactie?
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 watervrij (deel kopersulfaat verhitten om gehydrateerd water te verwijderen) – NaHCO3 – Citroenzuur – CuSO4 1 mol/l – Zn-poeder – NH4NO3
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: endo- en exo-energetische reacties
1.2.2. Energieomzettingen in verschillende vormen

- Info: Kunnen we verschillende vormen van energie in mekaar omzetten? Kunnen we chemische energie omzetten in elektrische energie?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 koolstofstaven – 3 elektriciteitssnoertjes – 2mol/l zinkjodideoplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: endo- -energetische reacties – elektrolyse
1.2.3. Endo- en exo-energetische reacties met eenzelfde stof

- Info: Kunnen we met eenzelfde stof zowel een exo- als een endo-energetische reactie uitvoeren? Wanneer we natriumsulfide trihydraat en magnesiumnitraat hexahydraat samenvoegen, treedt er een chemische reactie op, waarbij de temperatuur daalt. Wanneer we natriumsulfide trihydraat en kopernitraat trihydraat samenvoegen, treedt er een chemische reactie op, waarbij de temperatuur stijgt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumsulfide trihydraat (Na2S . 3 H2O) – Magnesiumnitraat hexahydraat (Mg(NO3)2 . 6 H2O) – Kopernitraat trihydraat (Cu(NO3)2 . 3 H2O
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: endo- en exo-energetische reacties
1.3. Endo-energetische reacties
1.3.1. Elektrolyse
1.3.1.1. Baardelektrolyse

- Info: Bij elektrolyse van lood(II)nitraat ontstaat een afzetting van lood op een koperelektrode
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cu-draad – Pb(NO3)2-opl 0.1 mol/l
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.2. Chemisch schrijven door elektrische energie

- Info: Kunnen we schrijven zonder inkt? Door de elektriciteit wordt de jodide in KI omgezet in I2, dit is een bruine vaste stof die we dus zien verschijnen op het filtreerpapier.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KI oplossing 10g/100 ml – zetmeeloplossing 0,5g/100 ml
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.3. Elektrisch kleuren

- Info: Hoe tonen we de elektrolyse van KI aan? Aan de pluspool trekt de batterij elektronen aan want die zijn negatief geladen. Die elektronen komen van jodiumionen, die daardoor omgezet worden in jodiumatomen. Ze kleuren stijfsel blauw. Ascorbinezuur is een sterke reductor en dringt daarom weer elektronen op aan het jodium. Daarmee verdwijnt de blauwe kleur weer.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kaliumjodide (KI): ½ gram – Ascorbinezuur (C6H8O6): 0,1 gram – Stijfsel-oplossing (0,2%): 5 mL
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.4. Elektrochemische corrosie

- Info: Hoe beïnvloedt een koperdraad het roesten van een nagel/spijker? We zien dat de gelatine rond de spijker/nagel groen is gaan kleuren. Rond het koper verschijnt de paarse kleur van het fft. Er ontstaat eveneens de kleur van berlijnsblauw
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine – Fenolftaleïne oplossing in ethanol – Oplossing K4Fe(CN)6: 0, 1 mol/l – Ijzeren nagel
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse -corrosie
1.3.1.5. Elektrochemische metaalbewerking

- Info: Hoe een gat maken met een potlood in een scheermesje? Als we de stroomkring aanzetten zien we dat de HCl onmiddellijk begint te bruisen. We voegen nog een paar keer HCl toe en zien dat in het scheermesje een deuk is gevormd op de plaats waar deze in contact stond met de grafietpunt van de potlood.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zoutzuur – potlood
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.6. Elektroforese in een petrischaaltje

- Info: Door de complexering van het koper(II)ion met ammoniak K = 7,1 10-14 is de concentratie te laag om met het chromaation een neerslag te vormen. Bij het ompolen zullen de kleuren door diffusie niet meer geheel mengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: agar-agar – Kaliumnitraat – 0.1M kopersulfaat – 0.1M kaliumchromaat – Geconcentreerd ammoniak
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse – elektroforese
1.3.1.7. Elektroforese
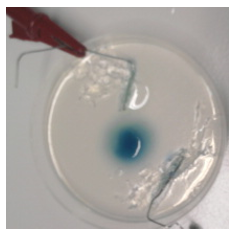
- Info: Door de complexering van het koper(II)ion met ammoniak K = 7,1 10-14 is de concentratie te laag om met het chromaation een neerslag te vormen. Bij het ompolen zullen de kleuren door diffusie niet meer geheel mengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: agar-agar – Kaliumnitraat – 0.1M kopersulfaat – 0.1M kaliumchromaat – Geconcentreerd ammoniak
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse – elektroforese
1.3.1.8. Elektrolyse met een aardappel

- Info: Hoe kunnen we zowel de aardappel gebruiken om een batterij als een elektrolyse cel te maken?
- Moeilijkheid: gemiddeld
- Chemische stoffen: magnesiumstaaf – aardappel – afwasmiddeloplossing (1/4de verdund) – indicatorpapier – FFT-oplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse – galvanische cel
1.3.1.9. Elektrolyse in een magneetveld

- Info: Hoe kunnen we het ionentransport tijdens een reactie zichtbaar maken?
- Moeilijkheid: gemiddeld
- Chemische stoffen: 1M Natriumsulfaatoplossing – fenolftaleïneoplossing – 0.1M natronloog – 0.1M HCl
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse – magneetveld
1.3.1.10. Elektrolyse van een kaliumjodide-oplossing

- Info: Hoe kunnen we de elektrolyse van KI aantonen? Bij deze elektrolyse reactie wordt jodide geoxideerd aan de anode terwijl water gereduceerd wordt aan de kathode. Aan de kathode worden waterstofbelletjes en hydroxide ionen gevormd hetgeen de oplossing basisch maakt waardoor de fenolftaleine rose kleurt (kleurloos in zuur milieu).
- Moeilijkheid: gemiddeld
- Chemische stoffen: Kaliumjodide oplossing 1 mol/l – Zetmeeloplossing 1% – Fenolftaleine oplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.11. Elektrolyse van water met een gemaakt toestel

- Info: Hoe kun je met een eigen toestel water ontleden?
- Moeilijkheid: gemiddeld
- Chemische stoffen:zwavelzuuroplossing 1.3M
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.12. Elektrolyse van waterstofchloride

- Info: Hoe kun je met een eigen opstelling zoutzuur ontleden? Zoutzuur ontleedt in waterstofgas en chloorgas
- Moeilijkheid: eenvoudig
- Chemische stoffen: druppelflesje gevuld met HCl – oplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.13. Elektrolyse van loodacetaat / groeien

- Info: Wat gebeurt er als we stroom zetten op een zilvernitraat oplossing? Vanuit de kathode groeit een zilverboom met verschillende takken. De groei wordt gereld door de hoeveelheid spanning. Voor de zilverboom de anode bereikt moet de elektrolyse gestopt worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen:1 koperen draad – zilvernitraat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse – fractalen
1.3.1.14. Het autootje op zon-energie

- Info: Het waterstofgas station produceert zelf kleine hoeveelheden waterstof waarmee de waterstoftank in de H-Racer gevuld wordt. Waterstofproductie vindt plaats door middel van electrolyse. Met zuurstofgas gebeurt knalproef met vorming van energie
- Moeilijkheid: eenvoudig
- Chemische stoffen: H-Racer – gedestilleerd water
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: endo-energetische reacties – elektrolyse – synthese – analyse
1.3.1.15. Kleurige ontleding
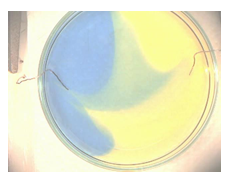
- Info: Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen? Ontleding van water
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ged. water 20 mL – Natriumsulfaat 2 gram – Broomthymolblauwoplossing 0,1%:1 mL
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.16. Micro-elektrolyse met indicatorpapier

- Info: Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen? Het toegevoegde zuur en de base die aan de kathode ontstaat neutraliseren elkaar.De toegevoegde base en het zuur dat aan de anode ontstaat neutraliseren elkaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2SO4-opl verzadigd – NaOH 1M – HCl 1M
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.17. Schrijven en uitvegen van geheime boodschappen met elektrische stroom

- Info: Hoe kunnen we bij de ontleding van water zuur en basisch milieu met indicatoren aantonen? Schrijf een boodschap met de nagel. Indien dit niet lukt pas de spanning aan. Er ontstaat een donkerblauwe boodschap. Na een tijd wordt omgepoold en wordt terug met de nagel over de boodschap gewreven. De boodschap verdwijnt.
- Moeilijkheid: gemiddeld
- Chemische stoffen:NaCl – tff of fft oplossing
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.1.18. Tomatensap met broom

- Info: Door additie met broom verkleint de lengte van het geconjugeerd systeem waardoor de geabsorbeerde golflengte verkort. Deze gaat uiteindelijk naar kleurloos.
- Moeilijkheid: gemiddeld
- Chemische stoffen:tomatensap – broomwater (verzadigd)
- Thema: chemische reacties – energetische aspecten – organische stoffen
- Tijd: 25 min
- Begrippen: endo-energetische reacties – additiereactie
1.3.1.19. Zuren en basen op wandel

- Info: Wat gebeurt er als zuren en basen onder invloed van stroom worden gezet? De ionen bewegen onder invloed van de stroom
- Moeilijkheid: gemiddeld
- Chemische stoffen: HCl 1 mol/l en NaOH 1 mol/l – Geconcentreerde KNO3 oplossing
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: endo-energetische reacties – elektrolyse
1.3.2. Fotolyse
1.3.2.1. Bromering van pentaan

- Info: Halogeenalkanen ontstaan bij de reactie tussen het halogeen en het alkaan. Tijdens de reactie moet het mengsel bestraald worden met zichtbaar (Br2) of U.V.-licht (Cl2). De reactie verloop zeer traag. Er ontstaat bovendien een mengsel van verschillende halogeenalkanen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Al-folie – water met fft met voldoende NaOH om een paarse kleur te bekomen – dibroom – 5% AgNO3
- Thema: chemische reacties – energetische aspecten – organische stoffen
- Tijd: 20 min
- Begrippen: endo-energetische reacties – fotolyse – additie
1.3.2.2. Chemische foto

- Info: Is er behalve stofomzetting een andere vorm van omzetting bij chemische reactie? Via verschillende oplossingen wordt op fotopapier een foto gevormd
- Moeilijkheid: moeilijk
- Chemische stoffen:fixeervloeistof – ontwikkelvloeistof
- Thema: chemische reacties – energetische aspecten –
- Tijd:80 min
- Begrippen: endo-energetische reacties – fotolyse – complexreacties
1.3.2.3. Fotografie op een oude wijze

- Info: Kunnen we een negatief van een figuur ‘afdrukken’ op filtreerpapier ? Complexreactie met ijzerhexacyanoferraat
- Moeilijkheid:gemiddeld
- Chemische stoffen: 5 cl oplossing Fe(NO3)3 – 0,5 mol/liter – 8 cl oplossing K2C2O4 – 0,75 mol/liter – 0,5 cl oplossing K3Fe(CN)6 – 0,25 mol/liter
- Thema: chemische reacties – energetische aspecten
- Tijd:40 min
- Begrippen: endo-energetische reacties – fotolyse – complexreacties
1.3.2.4. Fotografisch proces nabootsen

- Info: Kan je het fotografisch proces nabootsen? De gedeeltes van de proefbuis die blootgesteld werden aan het licht worden zwart van een zilvernitraatpasta
- Moeilijkheid: gemiddeld
- Chemische stoffen: Calciumcarbonaat – 5% zilvernitraatoplossing – Kaliumbromide (1g in weinig water opgelost)
- Thema: chemische reacties – energetische aspecten
- Tijd:20 min
- Begrippen: endo-energetische reacties – fotolyse – neerslagreactie
1.3.2.5. Fotolyse van zilverchloride

- Info: Onder invloed van licht (fotolyse) ontleedt de zilverchloride neerslag. Magnesium verbranden geeft extra licht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zilvernitraatoplossing 0.01M – natriumchloride-oplossing 0.01M – magnesiumlint
- Thema: chemische reacties – energetische aspecten
- Tijd 1:0 min
- Begrippen: endo-energetische reacties – fotolyse – neerslagreactie
1.3.2.6. Geheimschrift fotochemisch zichtbaar maken

- Info: Gele ijzer(III)oxalaat wordt blauw en door UV-licht gereduceerd tot koolstofdoxide en ijzer(II)oxalaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ijzer(III)nitraat.9H2O – oxaalzuur – kaliumhexacyanoferraat(III)
- Thema: chemische reacties – energetische aspecten
- Tijd 15 min
- Begrippen: endo-energetische reacties – fotolyse
1.3.2.7. Maak van een fotografische print

- Info: Is licht nodig om een fotografische print te bekomen?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Ijzertrinitraat.9H2O – Oxaalzuur – K3Fe(CN)6
- Thema: chemische reacties – energetische aspecten
- Tijd 20 min
- Begrippen: endo-energetische reacties – fotolyse – complexreactie
1.3.2.8. Omkeerbare reactie onder invloed van licht

- Info:Kunnen we een stof laten ontkleuren door er licht op te schijnen ? Thionine is een organische verbinding die in twee vormen kan voorkomen: een kleurloze gereduceerde vorm, en een paarse, geoxideerde vorm. Het kan gebruikt worden als een redoxindicator. Wanneer een reductor, zoals Fe2+-ionen, toegevoegd wordt aan een zure thionine-oplossing, dan wordt deze omgezet in de kleurloze gereduceerde vorm, terwijl Fe2+ geoxideerd wordt naar Fe3+.
- Moeilijkheid: moeilijk
- Chemische stoffen: FeSO4.7H2O, 2,0 g – H2SO4-oplossing, 1 mol.l-1 – thionine-oplossing 0,001 mol.l-1
- Thema: chemische reacties – energetische aspecten
- Tijd 30 min
- Begrippen: endo-energetische reacties – fotolyse – omkeerbare reactie
1.3.2.9. Reactie door belichting van zilverchloride

- Info:Wat gebeurt met zilverchloride als het belicht wordt? Het licht heeft voor een chemische reactie gezorgd. Hierbij is zilver gevormd, dit is de grijze kleur die zichtbaar is.
- Moeilijkheid: eenvoudig
- Chemische stoffen:5 ml zilverchloride oplossing 1% – 1 muntstuk – Magnesiumlint
- Thema: chemische reacties – energetische aspecten
- Tijd 20 min
- Begrippen: endo-energetische reacties – fotolyse
1.3.2.10. Thermochemie

- Info:Wat gebeurt er met het uitzicht van ZnO als we het verhitten? De geelkleuring ontstaat door de vorming van het niet stoichiometrisch zinkoxide
- Moeilijkheid: eenvoudig
- Chemische stoffen:zinkoxide
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – fotolyse- thermochemie
1.3.2.11. Thermochemie2

- Info: Hoe kunnen we fotochemische reacties van Tris(oxalate)iron (III) verkrijgen? Het tris(oxalato)ferrate(III)-ion wordt gemaakt door oxaalzuur en ijzer(III)nitraat samen te voegen. Het tris(oxalato)ferrate(III)-ion is gevoelig aan licht. Als het licht observeert ondergaat het een fotoreductie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fe(C2O4)33-
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – fotolyse- thermochemie
1.3.2.12. Citroenblauwdruk
- Info: Hoe kunnen we een blauwdruk maken met citroensap? Door ammoniumijzer(III)citraat te gebruiken (kan gemaakt worden met citroenzuur) als reductor, kan je Fe3+ reduceren naar Fe2+. De Fe3+ ionen zijn afkomstig van het gedissocieerde kaliumhexacynoferraat. Samen met Fe2+ kan het mengsel (groen) onder invloed van UV-licht een oplosbare vorm van Pruisisch blauw gemaakt worden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzer ammoniumcitraat, kaliumhexacyanoferraat
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – fotolyse
1.3.2.13. Organische zonnecel

- Info: Hoe kunnen we een zonnecel maken met organische stoffen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Grafiet/ potlood – Bessen – Huisazijn – Titaniumdioxide
- Thema: chemische reacties – energetische aspecten
- Tijd: 30 min
- Begrippen: endo-energetische reacties – fotolyse – zonnecel
1.3.3. Spontane endo-energetische reacties
1.3.3.1. Endotherme reactie met vorming van ammoniak

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl – Ba(OH)2.8H20 – rood lakmoespapiertje
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.2. Endotherme reactie met zure hosties

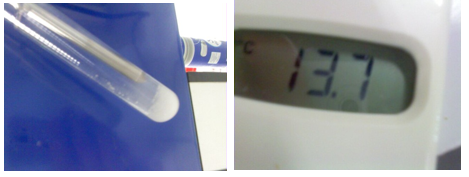
- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen met een zure hostie? Meten van temperatuur bij toevoegen aan inhoud van een zure hostie.
- Moeilijkheid: eenvoudig
- Chemische stoffen:bakpoeder – wijnsteenzuur
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.3. Endotherme reactie met zwavel

- Info: Welke soort energetische reactie vindt plaats tussen ijzertrinitraat nonahydraat en natriumthiosulfaat pentahydraat? De drijfkracht van de reactie is het vrijzetten van water uit beide zouten en de vorming van SO2. Tijdens het proces valt thiosulfaat uiteen in SO2 en S.De entropie neemt door de gasvorming toe waardoor het endotherme proces spontaan verloopt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Fe(NO3)3.9H2O – Na2S2O3.5H2O
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.4. Optimaliseren van proef voor bereiken van de laagste temperatuur

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en citroenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd.
- Chemische stoffen: bakpoeder, – citroenzuur,
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.5. Reactie tussen bakpoeder en citroenzuur

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en citroenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd. Deze chemische reactie is een endo-energetische reactie.In het proefje is de vorming van het koolzuurgas de oorzaak van de voorstuwing
- Chemische stoffen: bakpoeder, – citroenzuur,
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.6. Spontane endotherme reactie

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en citroenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd. Deze chemische reactie is een endo-energetische reactie.In het proefje is de vorming van het koolzuurgas de oorzaak van de voorstuwing
- Chemische stoffen: bakpoeder – vast citroenzuur watervrij
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.7. Temperatuurmeting bij de reactie met zure hosties

- Info: Hoe optimaliseer je een endotherme reactie? Zoek de optimale verhouding van bakpoeder en wijnsteenzuur en meet de temperatuur als aan het mengsel water wordt toegevoegd. Deze chemische reactie is een endo-energetische reactie.In het proefje is de vorming van het koolzuurgas de oorzaak van de voorstuwing
- Chemische stoffen: Zure hosties – Wijnsteenzuur – Natriumwaterstofcarbonaat (NaHCO3)
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.8. Reactie tussen schoolkrijt en waterstofchloride

- Info: Welke soort energetische reactie vindt plaats tussen schoolkrijt en waterstofchloride? Tijdens de reactie neemt de temperatuur af.Deze chemische reactie is een endo-energetische reactie.
- Chemische stoffen: 2 cm schoolkrijt – waterstofchloride-oplossing (2 mol/l)
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.9. Beker vriest vast door vaste stoffen

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl – Ba(OH)2.8H20 – rood lakmoespapiertje
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.10. Ijs laten vriezen zonder koude bron

- Info: Hoe verkrijgen we een vaste stof van een vloeistof zonder koude bron? Toevoegen van het geschikte groeikristal aan een oververzadigde oplossing laat kristallisatie plaatsvinden. Niet elk type kristal is geschikt als groeikristal. Voor een verzadigde natriumacetaat oplossing voldoet een zoutkristal niet maar een natriumacetaatkristal wel als groeikern.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumacetaat.3H2O – NaCl
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie – oploswarmte
1.3.3.11.Ijs maken door vaste stoffen te mengen

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl – Ba(OH)2.8H20 – rood lakmoespapiertje
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3.3.12. Zure hosties

- Info: Hoe kunnen we een endotherme reactie spontaan laten verlopen met een zure hostie? Meten van temperatuur bij toevoegen aan inhoud van een zure hostie.
- Moeilijkheid: eenvoudig
- Chemische stoffen:bakpoeder – wijnsteenzuur
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – spontane reactie
1.3. 4. Thermolyse
1.3.4.1. Geheime boodschappen met citroensap

- Info: Kan je een geheime boodschap maken met thee? De thee gaat een reactie vormen met het zuur waardoor er een donkere kleur gevormd wordt. Deze kleur zorgt ervoor dat je tekst terug zichtbaar is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Heel sterke zwarte thee – Citroen
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – thermolyse
1.3.4.2. Cold en hot pack

- Info: Hoe maak je een cold en hotpack? Je zoekt zouten die respectievelijk warmte onttrekken of geven aan de omgeving bij het oplossen in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10 g NH4NO3 – 10 g CaCl2 – 10 g MgSO4
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – exo-energetische reactie – oploswarmte
1.3.4.3. Ontleding van suiker

- Info: Wat gebeurt er als je warmte toevoegd aan kristalsuiker? Na warmtetoevoer ontleedt suiker in koolstof en water
- Moeilijkheid: eenvoudig
- Chemische stoffen:kristalsuiker
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – thermolyse van suiker
1.3.4.4. Productie van twee gassen uit ammoniumchloride

- Info: Welke gassen ontstaan er als we ammoniumchloride verhitten? Een deel van het ammoniumchloride ontleedt. De gevormde ammoniak, lichter dan lucht, stijgt in de reageerbuis omhoog en kleurt het indicatorpapier blauw. De ammoniak verdwijnt uit de buis. Na enige tijd v erzamelt zich steeds meer HCl in de buis.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ammoniumchloride
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – thermolyse
1.3.4.5. Thermolyse en verbranding van suiker

- Info: Hoe kunnen we suiker verbranden in plaats van te ontleden via thermolyse? Door de mengverhouding van het suikerklontje met het as kan het suikerklontje gaan branden tijdens dit verbrandingsproces zal de suiker afnemen als brandbare stof en de sigarettenas/CuO dienen als de katalysator en houdt het vuurtje brandend.
- Moeilijkheid: gemiddeld
- Chemische stoffen: koperoxide – suiker
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – thermolyse – verbrandingsreactie
1.3.4.6. Thermolyse voor het onttrekken van kristalwater

- Info: Gehydrateerd kopersulfaat wordt wit en het krijgt een poedervorm na het verwarmen.Tijdens het verwarmen ontstaat condens. Het verkregen wit poeder is watervrij kopersulfaat. Het groene, gehydrateerd nikkeldichloride wordt geel en het krijgt een poedervorm na het verwarmen.Tijdens het verwarmen ontstaat condens. Het verkregen gele poeder is watervrij nikkeldichloride.
- Moeilijkheid: eenvoudig
- Chemische stoffen: blauw kopersulfaat (CuSO4.5H2O) – groen nikkeldichloride (NiCl2.6H2O)
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – thermolyse – kristalwater
1.3.4.7. Welk gas ontstaat door thermolyse van bakpoeder?

- Info: Welk gas ontstaat er door thermolyse van bakpoeder? Aantonen dat koolstofdioxide ontstaat
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder (NaHCO3) – kalkwater
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – thermolyse – ontledingsreactie – identificatie koolstofdioxide
1.3.4.8. Zwavelzuur en water endotherm of exotherm in water en ijs?

- Info: Bij toevoeging van water aan zwavelzuur is de hoeveelheid warmte die vrijkomt door het oplossingproces groot genoeg om het mengsel te doen spatten. De grote hoeveelheden warmte ontstaan doordat het molecuul zwavelzuur ontbindt in een proton, dat zich aan een watermolecule hecht en één éénwaardig negatief waterstofsulfaation vormt. Indien ijs beschikbaar is kan voor het verdunnen van geconcentreerd zwavelzuur het zuur aan ijs worden toegevoegd. In dat geval is de smeltwarmte van het ijs ruim voldoende om de oploswarmte van het zuur te compenseren: de oplossing koelt af.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200ml 9M H2SO4 (100ml geconcentreerd toevoegen aan 100g ijs) – 100g ijs – 100ml ijskoud water
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – exo-energetische warmte – oploswarmte
1.3.4.9. Onzichtbare inkt met aardappel

- Info: Door middel van het zetmeel in een aardappel boven een warmtebron te houden zodat de koolstof in het zetmeel omgezet kan worden tot roet wordt de tekst zichtbaar.
Waar er aardappelsap was, verschijnt na het opwarmen een lichtbruine kleur. - Moeilijkheid: eenvoudig
- Chemische stoffen:1 aardappel
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – thermolyse
1.4. Exo-energetische reacties
1.4.1. Vorming van elektrische energie
1.4.1.1. Aardappelbatterij

- Info: Hoe kunnen we met aardappelen elektrische energie vormen? In de aardappel-batterij wordt chemische energie omgezet naar elektrische energie door een spontane overdracht van elektronen.
In dit geval reageert het zink van de nagel met het koper van de koperdraad. - Moeilijkheid: eenvoudig
- Chemische stoffen: 2 koperen strips – 2 zinken strips – 2 (stukken) aardappelen
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
1.4.1.2. Blik geeft stroom

- Info: Hoe kan een blikje energie geven? Door een galvanische cel te bouwen waarbij er een reactie optreedt met het aluminium van dit blikje.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2mol/l NaCl – 2mol/l KNO3 oplossing – blikje bier
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
1.4.1.3. De herbruikbare batterij
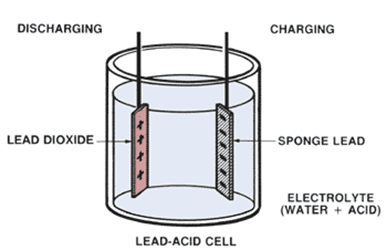
- Info: Hoe kan een herbruikbare batterij maken? Het oppervlak van de loodstrips reageren echter met zwavelzuur ter vorming van loodsulfaat. Met een opgelegde spanning ontstaat elektrolyse van het zwavelzuur. Zuurstof wordt afgegeven aan de anode en waterstofgas aan de kathode. Op hetzelfde moment gebeurt een oxydatie van lood naar Pb4+.Twee verschillende elektroden vormen een geleidingsproces met een spanningsverschil van ongeveer 2V. Indien de cel gebruikt wordt als bron keren de reacties om.
- Moeilijkheid: gemiddeld
- Chemische stoffen: loodfolie 0,2mm 250g – zwavelzuur 0.5 mol/l – batterij 4,5 V
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel -elektrolyse
1.4.1.4. Fruitsapklok

- Info: Door de chemische reacties die optreden in de fruitsap ontstaat elektrische energie. Dit is een voorbeeld van een exo-energetische reactie met vorming van elektrische energie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: fruitsap – 20 tot 30 cm magnesiumlint, aan één uiteinde opgerold rond b.v. een ijslollystokje; – 20 tot 30 cm koperdraad, aan één uiteinde opgerold;
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
1.4.1.5. Colabatterij

- Info: Hoe kunnen we een batterij maken met cola die sterk genoeg is voor een LED-lampje te laten branden? Door een galvanische cel te maken en cola dient als zoutbrug.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cola – 3 Koperelektrode – 3 Zinkelektrode of magnesiumelektrode
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – galvanische cel
1.4.2. Vorming van licht
1.4.2.1. Bloed opsporen met luminol
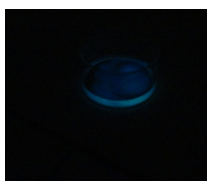
- Info: Vrijzetting van licht door de reactie met luminol en katalysator ijzer(+III)-ionen
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 g luminol – 1 g natriumcarbonaat – 7 g natriumperboraat – Bloed of nepbloed (FeCl3) – 3% waterstofperoxide oplossing
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – fluorescentie
1.4.2.2. Breken van een lightstick

- Info: Hoe kunnen we licht bekomen zonder elektrische stroom? Bij het breken van de lightstick begint een chemische reactie. Door de chemische reactie licht de stick op. Chemische energie wordt omgezet in lichtenergie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een Lightstick
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – fluorescentie
1.4.2.3. Chemoluminescente klokreactie

- Info:Het mechanisme van de klokreactie steunt op de oxydatie van de thiolfunctie in cysteïne in een basisch milieu en dit in de aanwezigheid van koperionen. Waterstofperoxide is een bijproduct in deze oxidatie. Koperionen vormen een complex met het cysteïne en zo lang cysteïne aanwezig is, zijn er onvoldoende koperionen aanwezig om de oxydatie tussen waterstofperoxide en luminol te starten.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,08 g cysteïne – 1500 ml water – 5 g KOH – 0,1 g luminol – 0,25 g CuSO4.5H2O – 10 ml verse 3% H2O2
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming -luminescentie – klokreactie
1.4.2.4. Chemoluminescentie van luminol met Glorix
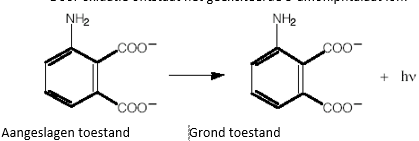
- Info:Door het toevoegen van de luminol een een loogoplossing deprotoneren we de secundaire amine groepen (NH) waardoor zich het dianion vormt. Door het toevoegen van chloorbleekloog oxideren we dit dianion hetgeen resulteert in de vorming van het zich in een geëxciteerde toestand bevindende 3-aminophtalate molecuul. Als dit molecuul terugvalt naar zijn grondtoestand zend het een foton uit. Dit is de chemiluminescentie
- Moeilijkheid: gemiddeld
- Chemische stoffen: luminol – Glorix (bevat NaClO) – natriumhydroxide (gootsteenontstopper)
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming -luminescentie – klokreactie
1.4.2.5. Fluorescerende pudding

- Info: Door natriumdithioniet wordt het riboflavine door protonenafgifte naar een kleurloze verbinding gereduceerd. Het ditioniet wordt geoxideerd. Deze reactie verloopt ook omgekeerd zodat door opname van lucht de reactie omgekeerd verloopt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: puddingpoeder van vanillesmaak – verzadigde natriumdithionietoplossing
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming -fluorescentie
1.4.2.6. Fluorescerende slierten

- Info: Hoe kunnen we een kleurloze vloeistof laten oplichten? Fluoresceïne is een stof met een luminescerende werking. Dit wil zeggen dat als atomen overgaan van een hogere naar een lagere energietoestand, er soms licht uitgestraald.
- Moeilijkheid: eenvoudig
- Chemische stoffen: fluoresceïne – NaOH 10%
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming -fluorescentie
1.4.2.7. Geheime boodschappen met ajuin
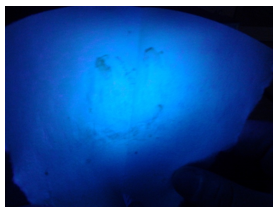
- Info: Met de versneden ajuin wordt op een groot blad filtreerpapier een figuur getekend. Daarna laat men het blad drogen. Eventueel droogblazen met een haardroger. Het blad wordt in een klem aan een statief bevestigd en onder een UV-lamp gelegd.De figuur komt tevoorschijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: ajuin
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming -fluorescentie
1.4.2.8. Gloeiende mentosfontein

- Info: Tonic ziet er kleurloos en helder uit onder normaal licht maar is helder gekleurd onder ultra violet licht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mentos – flesje tonic met kinine
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming -fluorescentie
1.4.2.9. Het regent vuur

- Info: Oxalaten zijn soms thermisch instabiel: de zouten kunnen onder verhitting ontleden in het metaal horende bij het kation onder afgifte van 2 moleculen kooldioxide. Het op deze wijze ontleden van fijn verdeeld ijzeroxalaat is een manier om zogenaamd pyrofoor ijzer te maken. Het ijzer onder poedervorm brandt spontaan door de wrijvingskracht met lucht.
- Moeilijkheid:gemiddeld
- Chemische stoffen:ijzeroxalaat
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming
1.4.2.10. Licht in het donker

- Info: Ammoniumcarbonaat en kopersulfaat vormen een complex dat als katalysator dient bij de vorming van een superoxide radicaalion (O2*–) uit waterstofperoxide.
Het radicaal oxideert luminol, waabij het 3-aminoftalaation, stikstof en water worden gevormd en luminol in aangeslagen toestand komt. Bij terugvallen van de aangeslagen toestand in de grondtoestand komt de reactie-energie deels in de vorm van blauwachtig licht vrij. - Moeilijkheid: gemiddeld
- Chemische stoffen: 4 g natriumcarbonaat – 0.2 g luminol – 24 g natriumwaterstofcarbonaat – 0.5 g ammoniumcarbonaat – 0.4 g blauw kopersulfaat – 5 ml waterstofperoxide 30%
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.11. Lichtgevende tonic

- Info: Geeft tonic licht onder een UV-lamp en hoe komt dit? Tonic bevat kinine, een zeer bittere stof. Kinine fluoresceert. Wanneer het met UV-licht wordt beschenen, zal het zelf blauw licht beginnen uitschijnen.
- Moeilijkheid: eenvoudig
- Chemische stoffen:schweppes tonic
- Thema: chemische reacties – energetische aspecten
- Tijd: 5 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.12. Lichtgevend waspoeder

- Info: Geeft waspoeder licht onder een UV-lamp? In waspoeder zit een optische witmaker. Dit is vaak sulfanylzuur, een organische verbinding met als brutoformule C6H7NO3S.
Dit is een fluorescerende chemische stof en wordt gebruikt om materialen witter te maken. Ze kunnen onzichtbare UV-straling absorberen en vervolgens als zichtbaar licht uitstralen. - Moeilijkheid: eenvoudig
- Chemische stoffen: verschillende soorten waspoeder
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie – fluorescentie
1.4.2.13. Methaanvuurbal

- Info: Hoe maken we bellenblazen chemisch spectaculair? Nadat we de lucifer bij de bubbels houden, zien we een enorme vuurbal ontstaan. Het opmerkelijke is dat de handen van de proefpersoon niet verwond zijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: methaangas – lucifers
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – verbrandingsreactie
1.4.2.14. Onweer onder water

- Info: Zodra de Kaliumpermanganaat in aanraking komt met de onderste laag zwavelzuur wordt onder andere het groene Mangaanheptoxide gevormd.Dit Mangaanheptoxide gaat op het grensvlak tussen de Ethanol en het Zwavelzuur ook een reactie aan (redoxreactie).
- Moeilijkheid: gemiddeld
- Chemische stoffen:Geconcentreerd zwavelzuur – Ethanol 96% – Vast kaliumpermanganaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – verbrandingsreactie
1.4.2.15. Oplichtend ei
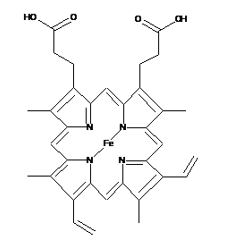
- Info: In de schaal zit ooporphyrin (Protoporphyrine IX). Hierin zit zoals in hemoglobine het haem. In tegenstelling tot hemoglobine bevindt zich centraal het Fe3+. Hierdoor is deze in staat rood op te lichten bij 366nm.
- Moeilijkheid: gemiddeld
- Chemische stoffen: gedroogde bruine hoendereierenschalen – zoutzuur 10% – ethylacetaat
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.16. Oplichtende buis
- Info: Hoe maken we een oplichtende figuur? Uit waterstofperoxide wordt een superoxide radicaalion (O2–) gevormd.Het radicaal oxideert luminol, waarbij het 3-aminoftalaat-ion, stikstof en water worden gevormd en luminol in aangeslagen toestand komt. Bij terugvallen van de aangeslagen toestand in de grondtoestand komt de reactie-energie deels in de vorm van blauwachtig licht vrij.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Luminol – Natriumhydroxide – kaliumhexacyanoferaat(III) – waterstofperoxide (30%) – gedestilleerd water
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.17. Sterretjes voor oud en nieuw

- Info: De voor sterretjes kenmerkende vonken ontstaan door de snelle verbranding van ijzer- en aluminiumpoeder. Bariumnitraat zorgt daarbij voor de benodigde zuurstof. Dextrine doet hierbij dienst als bindmiddel én brandstof.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Bariumnitraat: Ba(NO3)2 – Aluminiumpoeder: Al – IJzerpoeder: Fe – Dextrine: (C6H10O5)n – Spiritus: C2H5OH (85%) – Zoutzuur: HCl
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: exo-energetische reacties – lichtvorming -verbrandingsreactie
1.4.2.18. Vonken uit suiker

- Info: Wat gebeurt er als we met een hamer op een suikerklontje slaan? Het verschijnsel dat plaatsvindt noemt men triboluminescentie.Op het moment dat je het suikerklontje fijnknijpt, raakt de elektrische lading in asymmetrische suikerkristallen ongelijk verdeeld. Des te meer suiker je breekt, des te meer de positieve en negatieve deeltjes gescheiden worden. Als het ladingsverschil tussen de brokken suiker groot genoeg wordt, springen negatief geladen elektronen over naar de suiker met de positieve lading. In het voorbijgaan ‘duwen’ die elektronen de elektronen van stikstofatomen uit de lucht naar een hogere energiestaat. Zodra op hun beurt die elektronen terugvallen naar hun normale energiestaat, geven ze blauwig licht af.
- Moeilijkheid: eenvoudig
- Chemische stoffen: suikerklontje
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – triboluminescentie
1.4.2.19. Vuurspuwende vulkaan

- Info: Kaliumpermanganaat is een sterke oxidator die in staat is om glycerine in een sterk exotherme reactie onder vuurverschijnselen te oxideren tot CO2 en water. Kaliumpermanganaat wordt hierbij zelf gereduceerd, het betreft hier dus een redoxreactie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Kaliumpermanganaat – Glycerol
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
1.4.2.20. Chlorofyl in thee

- Info: Hoe kunnen we licht maken met thee? Chlorofyl lost op in ethanol. Door UV-licht wordt het energie opgewekt en deze energie wordt uitgestraald als zichtbaar licht. In zwarte thee wordt het chlorofyl door fermentatieprocessen losgemaakt, daarna is ook hier een fluorescerende werking zichtbaar.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zwarte thee – Groene thee – Ethanol
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.21. Lichtgevende inkt

- Info: Kunnen we lichtgevende inkt maken? Je voegt een chemische stof toe aan bestaande inkt, het resultaat zal niet altijd van de eerste keer werken. Inktrecepturen, vooral voor printers, zijn immers complex, zodat de resulterende inkt minder vlot kan afdrukken zoals deze normaal zou doen.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Inkt om de cartridge te vullen – Lege inktcartridge
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.22. Verbranding van suiker

- Info: Wat is de invloed van de as op het verbrandingsproces van suiker?
- Moeilijkheid:gemiddeld
- Chemische stoffen: Een suikerklontje – Brique – Assen (faraoslang)
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – katalysator – activeringsenergie
1.4.2.23. Exo-energetische reactie met zwavel en zink

- Info: Wat gebeurt er als we zink met zwavel laten reageren? In een goed geroerd mengsel van poedervormig zink en zwavel hebben beide stoffen veel aanraakpunten. Precies daarom is het mogelijk dat de reactie zo snel gaat en een scherpe knal volgt.
- Moeilijkheid:gemiddeld
- Chemische stoffen: Zinkpoeder – Zavelpoeder – Busenbrander
- Thema: chemische reacties – energetische aspecten – reactie metaal en niet-metaal
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming
1.4.2.24. Chemoluminescentie met luminol
- Info: Hoe kunnen we een oplossing laten oplichten?
- Moeilijkheid:gemiddeld
- Chemische stoffen: Luminol – NaOH – Bleekwater
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.25. Bengaals vuur

- Info: Wat gebeurt er wanneer een mengsel van zinkpoeder, ammoniumnitraat en ammoniumchloride in contact komt met water? Een mengsel van zinkpoeder, ammoniumnitraat en ammoniumchloride wordt vaak “Negatief X” genoemd. Het toevoegen van slechts een kleine druppel water veroorzaakt een redoxreactie, die wordt versneld door de aanwezigheid van chloride-ionen. Als sterk reductiemiddel reageert zink explosief met nitraationen om zinkoxide, stikstofgas en water te produceren.
- Moeilijkheid:gemiddeld
- Chemische stoffen: 2 gram ammoniumnitraat – 2 gram zinkpoeder – 25 gram ammoniumchloride
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
1.4.2.26. Noorderlicht

- Info: Hoe kunnen we met behulp van luminescentie het noorderlicht nabootsen? In een basisch medium wordt luminol gemakkelijk geoxideerd door waterstofperoxide. Kaliumferrocyanide is de katalysator voor de oxidatie van luminol door het peroxide. Er vormt zich een onstabiel deeltje, dat afbreekt met de afgifte van licht.
- Moeilijkheid:gemiddeld
- Chemische stoffen: 30 ml natriumhydroxide oplossing (1 mol/l) – 5 ml waterstofperoxide oplossing(30%) – 15 mg luminol – 20 mg kaliumhexacyanoferraat (III) – Gedestilleerd water
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 30 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie
1.4.2.27. Oplichtende Markeerstiften

- Info: Hoe kunnen we tekst laten oplichten met een GSM? Fluostiften met een gele of oranjekleur geven licht in UV-licht, de roze kleur geeft heel weinig licht in Uv-licht, de blauwe en groene kleur lichten niet op in UV-licht en zijn niet meer zichtbaar.
- Moeilijkheid:gemiddeld
- Chemische stoffen: Een blauwe en paarse stift – Plakband
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie – fluorescentie
1.4.2.28. Gekwantiseerde fosforescentie

- Info: Hoe kun je verschillende kleuren fluorescentie bekomen? De oplossing fluoresceert met deze filters.
- Moeilijkheid:gemiddeld
- Chemische stoffen: een vel van elk rood, blauw en groen cellofaan, in kartonnen frames plakband – zaklantaarn – 10 g natriumfluoresceïne opgelost en verdund tot 100 ml
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie – fluorescentie – fosforescentie
1.4.2.29. Fotochemisch bleken van methyleenblauw

- Info: Hoe kunnen we de blauwe kleur van methyleenblauw verwijderen met licht? De oplossing wordt bijna kleurloos (vergelijk met het tweede bekerglas). De kleurloze oplossing wordt weer blauw nadat deze een minuut of twee uit het licht is gehaald. Het proces kan meerdere keren worden herhaald.
- Moeilijkheid:gemiddeld
- Chemische stoffen: 1.0 g ijzer(II)sulfaat – 50 ml 0.1 mol/l zwavelzuur – druppelflesje met 1% methyleenblauw
- Thema: chemische reacties – energetische aspecten – redoxreactie – reactiesnelheid
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – luminescentie – oscillerende reactie
1.4.3. Vorming met mechanische energie
1.4.3.1. Exotherme reactie met gist

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van gist.Het gist bevat namelijk het catalase enzyme. Deze ontbinding is exotherm
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 pakketje of koffielepel gedroogde gist – 5% H202
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – katalysator
1.4.3.2. Explosie van een ei

- Info: Breng wat waterstofgas in een uitgeblazen ei door het op een proefbuis met HCl 3M en Zn poeder te zetten. Steek het op afstand aan met een lont.
- Moeilijkheid: eenvoudig
- Chemische stoffen: uitgeblazen ei – waterstofgas
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – knalgas
1.4.3.3. Explosief Zilver

- Info: Door acetyleengas te laten reageren met Tollensreagens, krijgen we zilveracetylide. Dit een zeer instabiele neerslag die gevormd, door er een vlam aan te houden gaat de explosie plaatsvinden.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Calciumcarbide – Tollensreagens:
- Thema: chemische reacties – energetische aspecten – organische stoffen
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – ethyn
1.4.4. Vorming van warmte
1.4.4.1. Bengaals vuur

- Info: Hoe kun je suiker hevig laten branden? Chloraten zijn zwakke oxidantia. Dit stijgt bij toevoeging van zwavelzuur. Het gevormde waterstofchloraat oxideert suiker waarbij een sterke exotherme reactie ontstaat met vorming van koolzuurgas en water.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KClO3 – Suiker – Ba(NO3)2 of Sr(NO3)2 of Cu(NO3)2 – H2SO4 gec
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: exo-energetische reacties – warmte- buskruit
1.4.4.2. Brandende suiker

- Info: Hoe kun je met modellen chemische stoffen ruimtelijk voorstellen? Het verbranden van een suikerklontje is een chemische reactie. Wanneer je het suikerklontje met as inwrijft, brandt het wel. Dit komt doordat de as meehelpt bij het verbranden van de suiker.
- Moeilijkheid: eenvoudig
- Chemische stoffen: paar suikerklontjes – beetje sigaretteas
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
1.4.4.3. De faraoslang

- Info: Hoe word je slangenbezweerder? Tijdens het verhitten treedt er een analyse van suiker op. Er ontstaat koolstof. We voegen hier bakpoeder aan toe zodat de slang zal groeien. Tot slot voegen we ethanol toe zodat de temperatuur zal stijgen en de analyse van suiker optreedt. Er zijn verschillende factoren die de grootte van de slang beïnvloeden, bijvoorbeeld de verdelingsgraad van het bakpoeder
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Bakpoeder – Ethanol
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
1.4.4.4.Dynamietzeep

- Info: Verbind een spuit met waterstofgas via een darm aan een spuit met zuurstofgas. Druk het waterstofgas bij het zuurstofgas.Meng wat in het sop om wat bellen te bekomen.Spuit de inhoud onder het zeepoppervlak. Steek een aantal zeepbellen met een brandende lucifer aan.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 30 ml waterstofgas – 30ml zuurstofgas – 10ml 3% zeepoplossing
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: activeringsenergie – knalgas – warmte – exo-energetische reactie
1.4.4.5. Eitje bakken met calciumoxide

- Info: Calcium oxide reageert exothermisch met water en vormt Calciumhydroxide
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ei – Calciumoxide
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: Oploswarmte – warmte – exo-energetische reactie
1.4.4.6. Exotherme reactie met azijn en staalwol

- Info: De azijn verwijdert een beschermlaagje op het staal wat belet dat het ijzer in het staal roest. Het roesten is een trage reactie tussen ijzer en zuurstof. Bij dit roesten komt warmte-energie vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: tafelazijn – staalwol
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: Warmte – exo-energetische reactie
1.4.4.7. Geheime boodschap met ammoniumdichromaat

- Info:In een reageerbuis worden enkele kristallen ammoniumdichromaat opgelost in wat water. Raak daarna met een hete koperdraad een gele plek op het papier aan tot dit gaat smeulen. Til het papier op met behulp van een tang. Na afloop blijft een groene stof, chroom(III)oxide over.
- Moeilijkheid: eenvoudig
- Chemische stoffen:ammoniumdichromaat
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: Warmte – exo-energetische reactie
1.4.4.8. Geheimschrift met zwavelzuur

- Info:IOnder invloed van het geconcentreerd zwavelzuur ontstaat een verkoling van het papier
- Moeilijkheid: eenvoudig
- Chemische stoffen: Geconcentreerd zwavelzuur;
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: Warmte – exo-energetische reactie – corrosie
1.4.4.9. Het regent vuur

- Info: Oxalaten zijn soms thermisch instabiel: de zouten kunnen onder verhitting ontleden in het metaal horende bij het kation onder afgifte van 2 moleculen kooldioxide. Het op deze wijze ontleden van fijn verdeeld ijzeroxalaat is een manier om zogenaamd pyrofoor ijzer te maken. Het ijzer onder poedervorm brandt spontaan door de wrijvingskracht met lucht.
- Moeilijkheid:gemiddeld
- Chemische stoffen:ijzeroxalaat
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming
1.4.4.10.. Cold en hot pack

- Info: Hoe maak je een cold en hotpack? Je zoekt zouten die respectievelijk warmte onttrekken of geven aan de omgeving bij het oplossen in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10 g NH4NO3 – 10 g CaCl2 – 10 g MgSO4
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – exo-energetische reactie – oploswarmte
1.4.4.11. Methaanvuurbal

- Info: Hoe maken we bellenblazen chemisch spectaculair? Nadat we de lucifer bij de bubbels houden, zien we een enorme vuurbal ontstaan. Het opmerkelijke is dat de handen van de proefpersoon niet verwond zijn.
- Moeilijkheid: eenvoudig
- Chemische stoffen: methaangas – lucifers
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – verbrandingsreactie
1.4.4.12. Raket met lucifers

- Info: Hoe kunnen we met aluminiumfolie en een kaars, lucifers laten wegschieten als een raket? Door verhitting gaat de kaliumchloraat en de paraffine ontleden. Er wordt veel koolstof en zuurstofgas gevormd. Als deze in contact komen met de vlam van de kaars wordt er enorme hoeveelheid koolstofdioxide gevormd. Deze grote gasontwikkeling is de stuwkracht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Lucifers – Aluminiumfolie – Kaars
- Thema: enkelvoudige stoffen – chemische reactie
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – exo-energetische reactie
1.4.4.13. Reactie tussen magnesium en waterstofchloride

- Info: Welke soort energetische reactie vindt plaats tussen magnesium en waterstofchloride?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Magnesiumlint – Waterstofchloride
- Thema: enkelvoudige stoffen – chemische reactie
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – exo-energetische reactie – warmte
1.4.4.14. Reactie tussen staalwol en tafelazijn

- Info: Welke soort energetische reactie vindt plaats tussen staalwol en tafelazijn?
- Moeilijkheid: eenvoudig
- Chemische stoffen:Staalwol – Tafelazijn
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – exo-energetische reactie – warmte
1.4.4.15. Sterretjes voor oud en nieuw

- Info: De voor sterretjes kenmerkende vonken ontstaan door de snelle verbranding van ijzer- en aluminiumpoeder. Bariumnitraat zorgt daarbij voor de benodigde zuurstof. Dextrine doet hierbij dienst als bindmiddel én brandstof.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Bariumnitraat: Ba(NO3)2 – Aluminiumpoeder: Al – IJzerpoeder: Fe – Dextrine: (C6H10O5)n – Spiritus: C2H5OH (85%) – Zoutzuur: HCl
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 25 min
- Begrippen: exo-energetische reacties – lichtvorming -verbrandingsreactie
1.4.4.16. Thermolyse en verbranding van suiker

- Info: Hoe kunnen we suiker verbranden in plaats van te ontleden via thermolyse? Door de mengverhouding van het suikerklontje met het as kan het suikerklontje gaan branden tijdens dit verbrandingsproces zal de suiker afnemen als brandbare stof en de sigarettenas/CuO dienen als de katalysator en houdt het vuurtje brandend.
- Moeilijkheid: gemiddeld
- Chemische stoffen: koperoxide – suiker
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 20 min
- Begrippen: endo-energetische reacties – exo-energetische reactie – thermolyse – verbrandingsreactie
1.4.4.17. Vuurspuwende vulkaan

- Info: Kaliumpermanganaat is een sterke oxidator die in staat is om glycerine in een sterk exotherme reactie onder vuurverschijnselen te oxideren tot CO2 en water. Kaliumpermanganaat wordt hierbij zelf gereduceerd, het betreft hier dus een redoxreactie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Kaliumpermanganaat – Glycerol
- Thema: chemische reacties – energetische aspecten – redoxreactie
- Tijd: 10 min
- Begrippen: exo-energetische reacties – lichtvorming – oxidans
1.4.4.18. Zuurstof bevordert verbranding

- Info: Breng het zuurstofgas in een grote proefbuis via een slang. – Steek de kaars aan en breng het in de proefbuis. De kaars brandt heviger.
- Moeilijkheid: eenvoudig
- Chemische stoffen: zuurstofgas – kalkwater
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – chemische reactie
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – verbrandingsreactie – exo-energetische reactie
1.4.4.19. Zwavelzuur in water endotherm of exotherm

- Info: Bij toevoeging van water aan zwavelzuur is de hoeveelheid warmte die vrijkomt door het oplossingproces groot genoeg om het mengsel te doen spatten. De grote hoeveelheden warmte ontstaan doordat het molecuul zwavelzuur ontbindt in een proton, dat zich aan een watermolecule hecht en één éénwaardig negatief waterstofsulfaation vormt. Indien ijs beschikbaar is kan voor het verdunnen van geconcentreerd zwavelzuur het zuur aan ijs worden toegevoegd. In dat geval is de smeltwarmte van het ijs ruim voldoende om de oploswarmte van het zuur te compenseren: de oplossing koelt af.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200ml 9M H2SO4 (100ml geconcentreerd toevoegen aan 100g ijs) – 100g ijs – 100ml ijskoud water
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – exo-energetische warmte – oploswarmte
1.4.4.20. Brandbare citrusvruchten

- Info: In welke citrusvruchten is de schil brandbaar? De schil bevatten terpenen ( limoneen), dit zijn vluchtige verbindingen. Terpenen bestaan vooral uit koolstof en waterstof. Terpenoïden, ook geurstoffen, bevatten ook zuurstof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: diverse verse citrusvruchten
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – exo-energetische warmte – verbrandingsreactie
1.4.4.21. De brandbaarheid van chocolade

- Info: Hoe kan je een theelichtje maken van chocolade? Door chocolade als brandstof te nemen, kan je een theelichtje met chocolade maken. Hiervoor gebruikt je de lont van een echt theelichtje
- Moeilijkheid: eenvoudig
- Chemische stoffen: Een groot stuk chocolade
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – exo-energetische warmte – verbrandingsreactie
1.4.5. Thermometer met stoffen
1.4.5.1. Kobaltchloride thermometer

- Info: Hoe functioneert Kobaltchloride als thermometer? De kobaltchloride kan gebruikt worden om extreme koude of extreme warmte aan te duiden. Door kleurverandering. Bij koude temperatuur kleurt de oplossing rood en in een warme omgeving, kleurt deze blauw.
- Moeilijkheid: gemiddeld
- Chemische stoffen: CoCl2.6H2O 1 mol /l – isopropanol
- Thema: chemische reacties – energetische aspecten – evenwichtsreactie
- Tijd: 10 min
- Begrippen: invloed temperatuur op evenwicht
1.4.5.2. Zwavelzuur in water endotherm of exotherm

- Info: Bij toevoeging van water aan zwavelzuur is de hoeveelheid warmte die vrijkomt door het oplossingproces groot genoeg om het mengsel te doen spatten. De grote hoeveelheden warmte ontstaan doordat het molecuul zwavelzuur ontbindt in een proton, dat zich aan een watermolecule hecht en één éénwaardig negatief waterstofsulfaation vormt. Indien ijs beschikbaar is kan voor het verdunnen van geconcentreerd zwavelzuur het zuur aan ijs worden toegevoegd. In dat geval is de smeltwarmte van het ijs ruim voldoende om de oploswarmte van het zuur te compenseren: de oplossing koelt af.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200ml 9M H2SO4 (100ml geconcentreerd toevoegen aan 100g ijs) – 100g ijs – 100ml ijskoud water
- Thema: chemische reacties – energetische aspecten
- Tijd: 20 min
- Begrippen: endo-energetische reacties – exo-energetische warmte – oploswarmte
2. Stofomzettingen
2.1. Algemeen
2.1.1. Eigenschappen van elementen uit groep IIa

- Info: Voer verschillende ionenuitwisselingsreacties uit waarbij er neerslagen ontstaan met metaalionen in zouten afkomstig van groep IIa.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mg(NO3)2 0,5 mol/l – Ca(NO3)2 0,5 mol/l – Sr(NO3)2 0,5 mol/l – Ba(NO3)2 0,5 mol/l – NaOH 1 mol/l – KF 0,5 mol/l – NaCl 0,5 mol/l – KBr 0,2 mol/l – KI 0,2 mol/l – Na2CO3 0,5 mol/l – Na2SO4 0,5 mol/l
- Thema: chemische reacties
- Tijd:30 min
- Begrippen: stofveranderingen – neerslagreacties
2.1.2. Observeren van chemische reacties
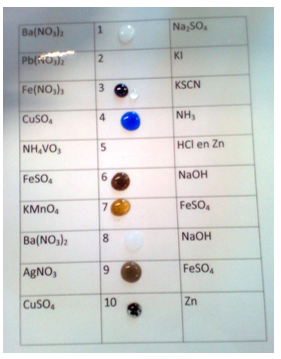
- Info: Voer verschillende ionenuitwisselingsreacties uit waarbij er neerslagen, complexen, kleurveranderingen ontstaan
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ba(NO3)2 0,2 mol/l – (NH4)2SO4 0,5 mol/l – NH3 3 mol/l – Na2SO4 0,5 mol/l – Pb(CH3COO)2 0,5 mol/l – HCl 1 mol/l – NaOH 1 mol/l – KMnO4 0,01 mol/l – AgNO3 0,1 mol/l – CuSO4 0,2 mol/l – FeSO4 0,2 mol/l – Fe(N03)3 0,2 mol/l -KSCN 0,2 mol/l – Zn korrels
- Thema: chemische reacties
- Tijd:30 min
- Begrippen: stofveranderingen – neerslagreacties – complexreacties – kleurverandering
2.1.3. Reactie van inkt en javel

- Info: Kan je een chemische reactie met het blote oog vaststellen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Verdunde javel (3 keer verdund) – Inkt
- Thema: chemische reacties
- Tijd:10 min
- Begrippen: stofveranderingen – kleurverandering
2.1.4. Reacties met halogeniden

- Info: Kan je een chemische reactie met het blote oog vaststellen? Reacties met halogenen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: AgNO3 0,1 mol/l – LiBr 1 mol/l – Ca(NO3)2 0,5 mol/l – NaF 0,5 mol/l – NaCl 0,2 mol/l – KBr 0,2 mol/l – KI 0,2 mol/l
- Thema: chemische reacties
- Tijd:10 min
- Begrippen: stofveranderingen – kleurverandering – neerslagreacties – redoxreacties
2.1.5. Welke veranderingen kunnen er optreden bij chemische reactie?

- Info: Welke veranderingen kunnen er optreden bij een chemische reactie? De verschillende stofveranderingen
- Moeilijkheid: eenvoudig
- Chemische stoffen: blauwe vulpeninkt, javel, azijn en bakpoeder – AgNO3 en NaCl
- Thema: chemische reacties
- Tijd:10 min
- Begrippen: stofveranderingen – kleurverandering – neerslag – gasontwikkeling
2.1.6. Reageerbuisproeven

- Info: Hoe kun je verschillende anionen uit oplossingen neerslaan en aantonen? Neerslag van ijzer(II)carbonaat en carbonaten aantonen
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5% Ijzer(II)sulfaat oplossing – 5% natriumcarbonaat oplossing – calciumcarbonaat – tafelazijn
- Thema: chemische reacties
- Tijd:10 min
- Begrippen: stofveranderingen – kleurverandering – neerslag
2.1.7. Vlamprotectie

- Info: Hoe kunnen we met een stof het branden beperken? Hou een lucifer voor een deel in een mengsel van 1 deel natriumsilicaat en 3 delen water. Laat de lucifer drogen en steek hem aan. Wanneer de vlam het behandelde deel bereikt, gaat hij uit.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NH4Cl 1 mol/l – Verzadigde aluinoplossing – Verzadigd Natriumsilicaatoplossing
- Thema: chemische reacties – redoxrreacties
- Tijd:10 min
- Begrippen: stofveranderingen – verbrandingsreactie
2.1.8. Fysische eigenschappen van stoffen

- Info: Op basis van welke fysische eigenschappen kan je de volgende stoffen onderscheiden?
- Moeilijkheid: eenvoudig
- Chemische stoffen:Zonnebloemolie – Suiker – Melk – Kopersulfaat – Lood – Aluminium
- Thema: chemische reacties – fysische eigenschappen – stofeigenschappen
- Tijd:10 min
- Begrippen: stofveranderingen – oplosbaarheid
2.2. Kleurreeksen
2.2.1. Alcoholoxidatie

- Info: Wat gebeurt er met de paars gekleurde propan-1-ol, propan-2-ol en t-butanol bij de oxidatie? Propan-1-ol wordt geoxideerd door permanganaat tot propanal en tot propionzuur. Propan-2-ol oxideert tot aceton. Het permanganaat gaat naar het groene MnO42- en tot MnO2. Tertiair butanol ondergaat geen oxidatie.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KMnO4 (0,006 mol/l) & NaOH (1mol/l) – Propan-1-ol & propan-2-ol & t-butanol
- Thema: chemische reacties – organische stoffen – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – oxidatie – onderscheid alcoholen
2.2.2.Buitenaards water
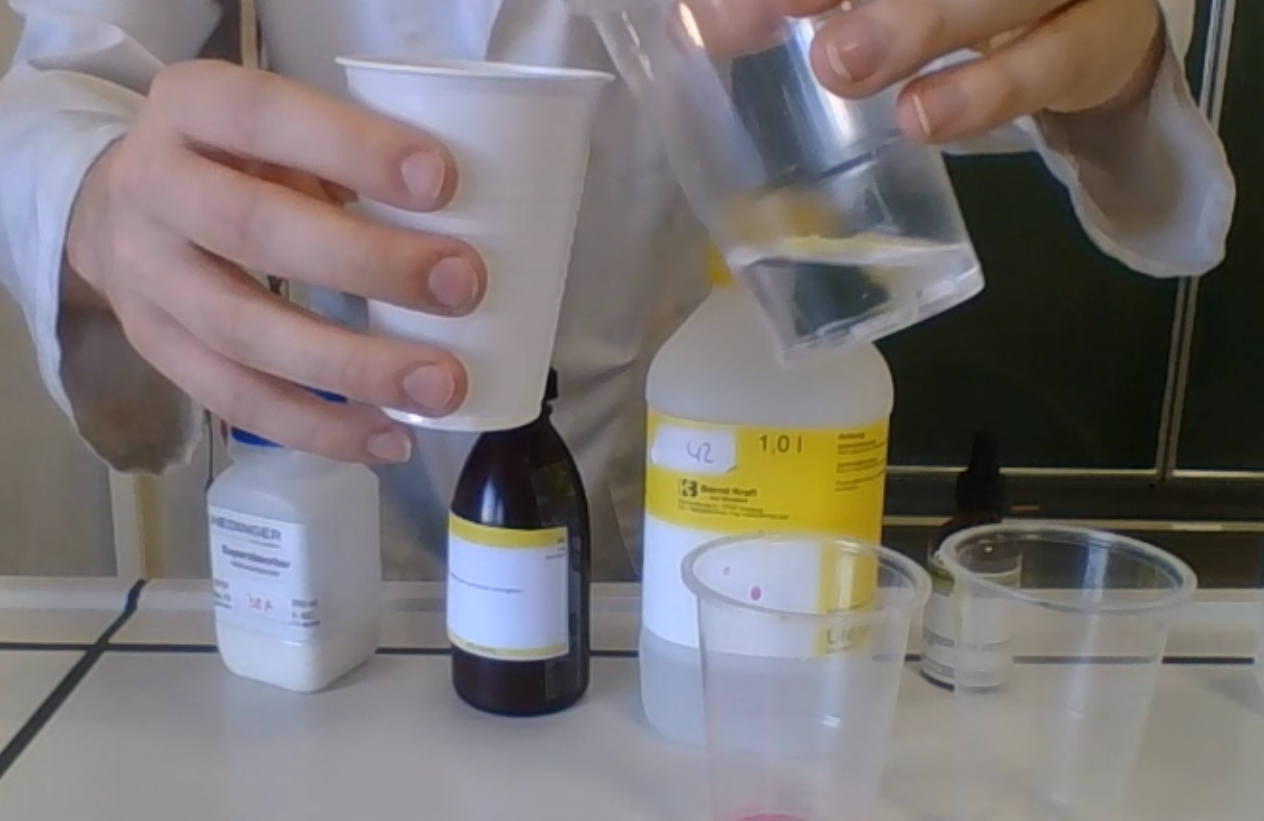
- Info: Op welke manier kunnen we water van kleur te veranderen en zelfs te laten verdwijnen? De kleurverandering van de vloeistof is gewoon de indicator die z’n werk doet. In contact komend met de natriumhydroxide kleurt de indicator paars. Wanneer de HCl de base neutraliseert wordt de indicator weer kleurloos. Het polyacrylaat neemt de vloeistof op
- Moeilijkheid: gemiddeld
- Chemische stoffen: NaOH 1mol/l – HCl 2 mol/l – Fenolftaleïne – Superabsorber (natriumpolyacrylaat)
- Thema: chemische reacties – kunststoffen
- Tijd:30 min
- Begrippen: stofveranderingen – absorbeerbaarheid – gel
2.2.3. Een chemische vlag

- Info: Kleurveranderingen met kaliumpermanganaat: paars, groen, geel, bruin
- Moeilijkheid: gemiddeld
- Chemische stoffen: OplossingA: 500 ml NaOH 6M – OplossingB: 20 ml H2O2 0.1% – Azijnzuur – KMnO4
- Thema: chemische reacties – redoxreacties
- Tijd:30 min
- Begrippen: stofveranderingen – verschillende oxidatiegetallen
2.2.4. Gouden glitters

- Info: Hoe kunnen we een gouden sneeuwlandschap maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 20 ml gedestilleerd water (H2O); – 30 mg loodnitraat (Pb(NO3)2); – 30 mg kaliumjodide (KI)
- Thema: chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: stofveranderingen – neerslagen
2.2.5. Gouden cent

- Info: Brons, zilver en goud met muntjes en zinkpoeder
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zink korrels (Zn) – Koperen 1ct muntstukjes – Natronloog (NaOH)
- Thema: chemische reacties – legering – complexreactie
- Tijd:20 min
- Begrippen: stofveranderingen – complexreacties
2.2.6. De groene, blauwe kolf

- Info:In het experiment wordt de geoxideerde vorm van methyleenblauw MB+ door ascorbinezuur gereduceerd naar MBH2+ en vervolgens door luchtzuurstof weer geoxideerd tot MB+. De zuurstof wordt door het schudden in de oplossing gebracht. Bij staan reduceert het ascorbinezuur MB+ terug naar zijn kleurloze vorm. Cu2+ ionen katalyseren deze laatste reactie
- Moeilijkheid: gemiddeld
- Chemische stoffen: zuiver vitamine C in poedervorm – oplossing van methyleenblauw in ethanol (0.1 g in 100ml ethanol 70%) – kopersulfaatoplossing 1,6 massa%
- Thema: chemische reacties – complexreactie – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – complexreacties – oscillerende reactie
2.2.7. Kettingreactie met voedingsmiddelen

- Info:Een kettingreactie is een keten van reacties waarbij een stof onstaat in de eerste reactie reageert in de volgende reactie. Tijdens deze kettingreactie vinden vijf verschillende reacties plaats met voedingsmiddelen
- Moeilijkheid: gemiddeld
- Chemische stoffen: Rodekoolsap (voor het maken van rodekoolsap kook je de groente 10 minuten in een beetje water) – Maïzena (zetmeel van maïs) – Water – Ammonia (VOORZICHTIG! Irriteert ogen en neus) – Schoonmaakazijn – Zuiveringszout (verkrijgbaar bij de drogist) – Betadine (jodium) – Vitamine C-bruistablet
- Thema: chemische reacties – complexreactie – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – kleurreacties
2.2.8. Kleuren in evolutie

- Info:Hoe laten we een stof meermaals van kleur veranderen? Terwijl fenol reageert met NaN02 en geconcentreerd H2S04, verschaft het een diep groene of blauwe kleur die bij verdunnen met water in rood verandert. terwijl de gegenereerde alkaline samen met de oorspronkelijke groene of blauwe NaOH-kleur wordt hersteld.
- Moeilijkheid: gemiddeld
- Chemische stoffen: geconcentreerd zwavelzuur – natriumnitriet – fenol
- Thema: chemische reacties – complexreactie – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – kleurreacties
2.2.9. Kleurenorgel

- Info:Reacties waarbij de kleuren van mangaanverbindingen ontstaan bij veranderen van oxidatiegetal
- Moeilijkheid: gemiddeld
- Chemische stoffen: Mangaan(II)sulfaat (verzadigde oplossing) – Kaliumpermanganaat: 0.1 g in 100ml water – Natriumsulfiet: 2 g in 100 ml water – Natriumhydroxide 6M – Zwavelzuur
- Thema: chemische reacties – complexreactie – redoxreactie
- Tijd:20 min
- Begrippen: stofveranderingen – kleurreacties – verschillende oxidatiegetallen
2.2.10. Koper Odyssee

- Info: Hoe kunnen we de wet van behoud van atomen aantonen met koper?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Koperdraad – HNO3 –oplossing 6 mol/l – Ijs – NaOH-oplossing 6 mol/l – HCl-oplossing 2 mol/l – Water – Aluminiumfolie
- Thema: enkelvoudige stoffen – chemische reacties
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – wet van behoud van atomen
2.2.11. Lood(II)jodide sneeuwwerk

- Info: Hoe kunnen we een gouden sneeuwlandschap maken?
- Moeilijkheid: eenvoudig
- Chemische stoffen:Oplossing van kaliumjodide (KI); – Oplossing van loodnitraat, Pb(NO3)2.
- Thema: chemische reacties – neerslagreacties
- Tijd:20 min
- Begrippen: stofveranderingen – neerslagen
2.2.12. Maak de langste kleurenketting

- Info: Maak het kleurrijkste mengsel, hoeveel kleuren kan je waarnemen? (Je mag geen indicatoren gebruiken en het is de bedoeling om steeds verder te gaan met het reactieproduct van vorige reactie.) Elf kleuren op een rij
- Moeilijkheid: moeilijk
- Chemische stoffen:HCl 0.1 mol/l en 1 mol/l – NaOH 0.105 mol/l met een fenofthaleïne indicatpr – FeCl3 0.01 mol/l in 0.01 mol/l HCl – KSCN 0.03 mol/l – AgNO3 0.01 mol/l – KI 0.1 mol/l – chloroform 100 ml – zetmeel 1% – 0.5 mol/l NaF – 0.01 mol/l AgNO3 – 0.05 mol/l NaCN
- Thema: chemische reacties – neerslagreacties – compexreacties – redoxreacties
- Tijd:40 min
- Begrippen: stofveranderingen – neerslagen
2.2.13. Maak een kleurrijk muntenkunstwerk

- Info: Brons, zilver en goud met muntjes en zinkpoeder
- Moeilijkheid: gemiddeld
- Chemische stoffen:zinkkorrels (Zn) – NaOH – azijnzuur (huishoudazijn) – koperen muntstukjes
- Thema: chemische reacties – compexreacties – redoxreacties
- Tijd:30 min
- Begrippen: stofveranderingen – neerslagen
2.2.14. Maak met eenzelfde oplossing de meeste dranken

- Info: Maak een oplossing van 500ml 1M H2SO4 met 0.5 g watervrije ijzertrichloride. De oplossing is praktisch kleurloos. Neem nu verschillende glazen voor porto, sherry, wijn, melk, water, champagne, cola, curacao
- Moeilijkheid: gemiddeld
- Chemische stoffen: 500 ml 1 mol/l H2SO4 met 0,5g watervrije ijzertrichloride – ammoniomthiocyanaat – ijzetrichloride – loodnitraat – NaHCO3 – K4Fe(CN)6 3H2O
- Thema: chemische reacties – compexreacties – redoxreacties
- Tijd:30 min
- Begrippen: stofveranderingen – neerslagen
2.2.15. Maken van een verkeerslicht

- Info: Water en alcohol worden in verhouding 1:1 gemengd. Met roeren wordt zo lang kaliumcarbonaat toegevoegd tot een verzadigde oplossing ontstaat. Er vormt hierbij een alcoholische fase af van de verzadigde oplossing. Een spatelpunt kopersulfaat vormt de waterige fase blauw. Enkele korrels kaliumdichromaat zorgt voor een groen mengkleur.De alcoholische fase wordt met een spatelpunt methylrood gekleurd. De petroleumether met sudanIII zorgt voor de derde kleur.
- Moeilijkheid: gemiddeld
- Chemische stoffen: kaliumcarbonaat – kopersulfaatpentahydraat – kaliumdichromaat – methylrood – sudanIII
- Thema: chemische reacties – compexreacties – redoxreacties
- Tijd:30 min
- Begrippen: stofveranderingen – neerslagen
2.2.16. Onderzoek van de vlamspectra van elementen

- Info:Dompel de platinastaaf onder in de geconcentreerde HCl-oplossing (wees voorzichtig) en wrijf het bevochtigd gedeelte in NaCl op het horlogeglas. Breng het staafje met het zout in de bunsenvlam en bekijk de vlamkleur.
- Moeilijkheid: gemiddeld
- Chemische stoffen: NaCl – CaCl2 – InCl3 – RbCl – CuCl2 – HCl gec
- Thema: chemische reacties – bouw van atomen
- Tijd:20 min
- Begrippen: stofveranderingen – vlamproeven
2.2.17. Ontkleurde regenboog

- Info:Hoe kunnen we een regenboog namaken met indicatoren en hoe kunnen we de kleuren wegkrijgen?
- Moeilijkheid: gemiddeld
- Chemische stoffen: oplossing NaOH 0.01 M – oplossing van NaOH 3 – oplossing van HCl 0.01 M – oplossing van HCl 3 M – indicatoren
- Thema: chemische reacties – neutralisatiereacties – pH
- Tijd:20 min
- Begrippen: stofveranderingen – indicatoren
2.2.18. Reductie van kaliumpermanganaat door gummibeertjes

- Info:In twee petrischalen giet men telkens, achtereenvolgens, 10 ml van de KMnO4-oplossing, 10 ml van de NaOH-oplossing, 10 ml gedestilleerd water; voorzichtig mengen;in een van beide schalen plaatst men een snoepje.
- Moeilijkheid: gemiddeld
- Chemische stoffen: KMnO4-oplossing (0,01 mol/l) – NaOH-oplossing (3 mol/l) – een gummibeer of glucosetabletje
- Thema: chemische reacties – redoxreacties
- Tijd:25 min
- Begrippen: stofveranderingen – kleuren van mangaan met verschillende oxidatiegetallen
2.2.19. Rood wit blauw

- Info:Breng in de eerste fles enkele ml van een fenolftaleïne oplossing, in de tweede enkele tientallen ml van een loodnitraatoplossing en in de derde fles enkele tientallen ml van een kopersulfaatoplossing. Voeg tijdens de demonstratie aan alle drie de flessen verdunde ammonia toe.
- Moeilijkheid: gemiddeld
- Chemische stoffen: fenolftaleïne (een oplossing van 1 g in 1 L ethanol 90%); – een oplossing van 20 g loodnitraat per L water; – een oplossing van 20 g kopersulfaat per L water; – verdunde ammonia (bijvoorbeeld 0,1 M).
- Thema: chemische reacties – redoxreacties – neerslagreactie
- Tijd:25 min
- Begrippen: stofveranderingen – kleurveranderingen
2.2.20.Zes kleuren in één oplossing

- Info:Kleurreacties door na elkaar toevoegen van nieuwe oplossingen tot zes verschillende kleuren
- Moeilijkheid: gemiddeld
- Chemische stoffen: f10% natriumcarbonaatoplossing – 1% fenolfthaleïneoplossing in ethanol – 40% ijzer(III)chlorideoplossing in 3% zwavelzuur – 30% ammoniumthiocyanaatoplossing – 5% kaliumhexacyanoferraat(II) oplossing – 20% natriumfluoride oplossing – gedem. Water
- Thema: chemische reacties – redoxreacties – neerslagreactie – complexreactie
- Tijd:35 min
- Begrippen: stofveranderingen – kleurveranderingen
2.2.21. Zwart wit geeft kleurloos

- Info:Hoe kan bij het samenvoegen van een witte en een zwarte oplossing, een kleurloze oplossing worden gevormd? Verschillende redoxreactie treden op met telkens een kleurverandering
- Moeilijkheid: gemiddeld
- Chemische stoffen: 10 ml joodtinctuur – 90 ml azijn – ascorbinezuur opgelost in 30 ml water – zetmeeloplossing – 15 ml hypochloriet in 45 ml water (=javel) – 150 ml water – een halve theelepel magnesiumsulfaat – huishoudammoniak 1 mol/l
- Thema: chemische reacties – redoxreacties – complexreactie
- Tijd:35 min
- Begrippen: stofveranderingen – kleurveranderingen
2.2.22. Rood-gouden boodschappen

- Info:Hoe kan je een geheime boodschap schrijven die verdwijnt? De zuurbase indicator in het roodgeel papier is op basis van Curcumine
- Moeilijkheid: gemiddeld
- Chemische stoffen: Goud-rood papier – NH3-oplossing (5%)
- Thema: chemische reacties – redoxreacties – neutralisatiereactie – indicator
- Tijd:35 min
- Begrippen: stofveranderingen – kleurveranderingen
2.2.23. Magisch water

- Info: Hoe kan je van een waterachtige vloeistof verschillende soorten drankjes maken? Elke reactie heeft een ander soort uitzicht. Hierdoor lijkt het alsof je van één vloeistof verschillende drankjes kan maken, maar eigenlijk is het telkens dus een andere reactie die optreedt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Ammoniumthiocyanaat – Looddinitraat – Natriumwaterstofcarbonaat – Kaliumhexacyanoferraat(II) – oplossing zwavelzuur en ijzertrichloride
- Thema: chemische reacties – redoxreacties – neutralisatiereactie – indicator – complexreactie
- Tijd:35 min
- Begrippen: stofveranderingen – kleurveranderingen
2.2.24. Magische inkt
- Info: Hoe kun je zelf magische inkt maken? De zouten vormen kleurcomplexen met de ijzerchloride-oplossing, die verschillende kleuren hebben.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 5 g ijzer(III)chloride.6H2O – 0.5 g kaliumhexacyanoferraat(II) – 1 g kaliumthiocyanaat – 2 g natriumcarbonaat – 0.1 g tannine – 1 g salicylzuur – 10 ml ethanol – 200 ml water
- Thema: chemische reacties – redoxreacties – complexreactie
- Tijd:35 min
- Begrippen: stofveranderingen – kleurveranderingen
2.3. Onderscheid fysische en chemische reactie
2.3.1. Fysische en chemische verschijnselen

- Info: Een chemische en fysische reactie met een lucifer
- Moeilijkheid: eenvoudig
- Chemische stoffen: Lucifer
- Thema: chemische reacties – fysische reactie
- Tijd:5 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch
2.3.2. Licht schenken
- Info: Hoe kunnen we licht schenken met behulp van een zaklamp en aluminiumfolie? Het licht van de zaklamp schijnt in de straal water. Een deel van het licht gaat er doorheen. En een ander deel blijft in de straal, omdat het telkens tegen de buitenkant van het water botst. Uiteindelijk komen het water en het licht allebei tegen de wastafel. Daarom zie je een lichte vlek waar het water de wastafel raakt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Aluminiumfolie
- Thema: chemische reacties – fysische reactie
- Tijd:5 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch
2.3.3. Fysische en chemische reacties

- Info: Wat is het verschil tussen een chemisch en een fysisch proces? Voorbeelden van een aantal chemische en fysische reacties
- Moeilijkheid: eenvoudig
- Chemische stoffen: 25 ml halfvolle melk – 10 ml azijn – Verbrandingskroes – Suikerklontje
- Thema: chemische reacties – fysische reactie
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch
2.3.4. Reactie tussen bakpoeder en azijnzuur en tussen zuurstofwater en mangaandioxide

- Info: Welke stofverandering vindt zowel plaats bij de reactie tussen bakpoeder en tafelazijn als bij de reactie tussen zuurstofwater en mangaan(IV)oxide?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bakpoeder – Mangaan(IV)oxide – Tafelazijn – Waterstofperoxide of zuurstofwater 30% H2O2
- Thema: chemische reacties – fysische reactie
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – eigenschappen gassen
2.4. Soorten chemische reacties
2.4.1. Construeer het strafste blusapparaat

- Info: Hoe kun je koolzuurgas maken om vuur te blussen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – gasvorming
2.4.2. De faraoslang

- Info: Hoe word je slangenbezweerder? Tijdens het verhitten treedt er een analyse van suiker op. Er ontstaat koolstof. We voegen hier bakpoeder aan toe zodat de slang zal groeien. Tot slot voegen we ethanol toe zodat de temperatuur zal stijgen en de analyse van suiker optreedt. Er zijn verschillende factoren die de grootte van de slang beïnvloeden, bijvoorbeeld de verdelingsgraad van het bakpoeder
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Bakpoeder – Ethanol
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
2.4.3. Kunstbloed

- Info: Hoe kun je kunstbloed maken? Vormen van ijzerthiocyanaat-oplossing geeft de bloedkleur.
- Moeilijkheid: eenvoudig
- Chemische stoffen:KSCN – FeCl3
- Thema: chemische reacties -complexreactie
- Tijd:10 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – kleurverandering
2.4.4. Lanceer de strafste bakpoederraket

- Info: Hoe kan je een raket het hoogst omhoog laten schieten door gebruik te maken van slechts 1 bruistablet?
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – gasvorming
2.4.5. Maak je eigen brandblustoestel

- Info:Ontsteek drie theelichtjes.Breng 1 koffielepel bakpoeder in de plastiek fles .Voeg 40 ml tafelazijn toe. Giet het gevormde gas (zonder vloeistof) uit over de brandende theelichtjes
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd:25 min
- Begrippen: stofveranderingen – onderscheid fysisch en chemisch – gasvorming
2.4.6. Maak de meest kronkelende faraoslang

- Info: Hoe kan je de hoogste faraoslang maken met maximaal 20 gram vaste stof. (benodigdheden: bloemsuiker, ethanol en natriumbicarbonaat op een bedje van zand)
- Moeilijkheid: eenvoudig
- Chemische stoffen: Suiker – Bakpoeder – Ethanol
- Thema: chemische reacties – energetische aspecten
- Tijd: 25 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
2.4.7. Maak je eigen stuiterbal

- Info: Doe 20 ml waterglas in het plastic bekertje. Voeg 10 ml ethanol toe.Meng het mengsel m.b.v. de spatel en maak een gelijkmatige cirkelvormige beweging.. Als het mengsel vast wordt , kneed tot een bal.
- Moeilijkheid: eenvoudig
- Chemische stoffen:waterglas (natriumsilicaat) – ethanol (95%) (alcohol)
- Thema: chemische reacties
- Tijd: 25 min
- Begrippen: – katalysator – stofvorming
2.5. Uitdagingen
2.5.1. Hoe bekomen we de grootste zwarte slang uit suiker door middel van dehydratatie?

- Info: Hoe bekomen we de grootste zwarte slang uit suiker door middel van dehydratatie? De suiker wordt eerst bruin en later zwart.Het begint te borrelen en te roken.Er wordt eveneens een hoop hitte geproduceerd (exotherme reactie).Er vind echter nog een reactie plaats: oxidatie.
- Moeilijkheid: gemiddeld
- Chemische stoffen:Kristalsuiker (C12H22O11) – Geconcentreerd zwavelzuur (H2SO4)
- Thema: enkelvoudige stoffen – reactie met geconcentreerd zuur – chemische reacties
- Tijd: 10 min
- Begrippen: enkelvoudige stoffen – corrosie
2.5.2. Hoe bekomen we de hoogst mogelijke stuiterende stuiterbal

- Info: Doe 20 ml waterglas in het plastic bekertje. Voeg 10 ml ethanol toe.Meng het mengsel m.b.v. de spatel en maak een gelijkmatige cirkelvormige beweging.. Als het mengsel vast wordt , kneed tot een bal.
- Moeilijkheid: eenvoudig
- Chemische stoffen:waterglas (natriumsilicaat) – ethanol (95%) (alcohol)
- Thema: chemische reacties
- Tijd: 25 min
- Begrippen: – katalysator – stofvorming
2.5.3. Maak de koudste coldpack
-

- Info: Hoe maak je een cold en hotpack? Je zoekt zouten die respectievelijk warmte onttrekken of geven aan de omgeving bij het oplossen in water.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10 g NH4NO3 – 10 g CaCl2 – 10 g MgSO4
- Thema: chemische reacties – energetische aspecten
- Tijd: 10 min
- Begrippen: endo-energetische reacties – exo-energetische reactie – oploswarmte
2.5.4. Maak je eigen coldpack

- Info: Kan er een energieverandering optreden bij een chemische reactie? We wikkelen de ijsblokjes in een handdoek en verbrijzelen ze met een hamer.Daarna deppen we de ijsstukjes droog met keukenpapier en doen ze in een plastic zak.We voegen het keukenzout toe aan het ijs.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 110g keukenzout – 200g ijs
- Thema: chemische reacties – energetische aspecten
- Tijd: 15 min
- Begrippen: oploswarmte
3. Wetten bij chemische reacties
3.1. Wet van behoud van atomen
3.1.1. Koperreacties

- Info: Hoe kunnen we spelen met de reacties van koper om de wet van behoud van atomen aan te tonen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Cu(NO3)2 0,1 mol/l – NaOH 1 mol/l – NH3 3 mol/l – HCl 1 mol/l – Na2S 1 mol/l – Na2CO3 0,2 mol/l – KI 1 mol/l – Na2S2O3 0,5 mol/l – H2SO4 0,1 mol/l – H2O2 3%
- Thema: chemische reacties – wet van behoud van atomen
- Tijd: 35 min
- Begrippen: omzetting atomen
3.1.2. De reactiereeks van koper

- Info: Wat gebeurt met de atoomsoorten bij een chemische reactie? Doe een spatelpunt koperpoeder in de proefbuis. Verhit het poeder boven de bunsenbrander tot het volledig van kleur is veranderd. Voeg voorzichtig aan het reactieproduct 5 ml diwaterstofsulfaatoplossing toe met behulp van de maatcilinder. Verwarm met de bunsenbrander het mengsel traag tot de vaste stof verdwenen is.Laat de proefbuis afkoelen. Houd de geschuurde ijzeren nagel gedurende 1 minuut in de proefbuis.
- Moeilijkheid: eenvoudig
- Chemische stoffen: koperpoeder – diwaterstofsulfaatoplossing – ijzeren nagel
- Thema: chemische reacties – wet van behoud van atomen
- Tijd: 25 min
- Begrippen: omzetting atomen
3.1.3. Koper Odyssee

- Info: Hoe kunnen we de wet van behoud van atomen aantonen met koper?
- Moeilijkheid: gemiddeld
- Chemische stoffen: Koperdraad – HNO3 –oplossing 6 mol/l – Ijs – NaOH-oplossing 6 mol/l – HCl-oplossing 2 mol/l – Water – Aluminiumfolie
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van atomen
3.1.4. Omkeerbare omzetting van kopermetaal tot koperoxide en terug
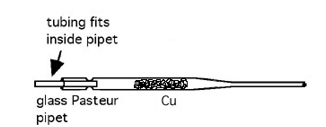
- Info: Verwarm de Cu-pipet gedurende 30s en blaas traag 60ml lucht door de pipet terwijl de pipet in de vlam blijft. De koper wordt zwart. Verbind de spuit met waterstofgas aan de pipet. Verhit de CuO-pipet en spuit traag waterstofgas in de pipet. Er ontstaan druppels water aan de wand van de pipet.
- Moeilijkheid: gemiddeld
- Chemische stoffen: wat koperpoeder of kleine stukjes – waterstofgas 50ml
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van atomen – omkeerbare reactie
3.1.5. Wet van behoud van atoomsoorten

- Info: Aan welke wetten voldoen chemische reacties? Door de koper poeder samen te voegen met de salpeterzuur treedt er een chemische reactie op. Dit is op te merken door de roodbruine gas die vrijkomt en de kleurverandering.Wanneer de nagel in deze oplossing wordt aangebracht treedt er weer een chemische reactie op en zien we aan de oppervlakte van de spijker dezelfde kleur als koper.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Afgeschuurde ijzeren nagel – Koperpoeder – Waterstofnitraat (65%)
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van atomen – omkeerbare reactie
3.2. Wet van behoud van massa
3.2.1. De reactie van kopersulfaat en natriumhydroxide

- Info: Is er een verband tussen de massa van de reagentia en de massa van de reactieproducten?
- Moeilijkheid: gemiddeld
- Chemische stoffen:kopersulfaatoplossing (CuSO4 0,1mol ll ) – natriumhydroxide-oplossing(NaOH 0,1 mol) l
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van massa
3.2.2. Massabalans met waterstofchloride en magnesium

- Info: Is er een verband tussen de massa van de reagentia en de massa van de reactieproducten?
- Moeilijkheid: gemiddeld
- Chemische stoffen: magnesiumlint – HCl oplossing 1 mol/l
- Thema: chemische reacties
- Tijd: 15 min
- Begrippen: wet van behoud van massa
3.2.3. Massaverandering bij een chemische reactie
- Info: Is er een verband tussen de massa van de reagentia en de massa van de reactieproducten? Bij het samenvoegen van de Na2CO3/ Ca(NO3)2 is er geen verschil voor en na de reactie. Er is wel verschil na reactie tussen het Mg lint of CaCO3 en HCl.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Na2CO3 0,5 mol/l – Ca(NO3)2 0,5 mol/l – HCl 1 mol/l – Mg lint – CaCO3 steen
- Thema: chemische reacties
- Tijd: 25 min
- Begrippen: wet van behoud van massa
3.2.4. Sealed-bag experiment met hydroxiden

- Info: Hoe verloopt het gewicht bij het uitvoeren van een reactie in een sealed bag? We stellen vast dat vast dat de massa ongeveer constant blijft. Dit kunnen we verklaren door de wet van behoud van massa
- Moeilijkheid: gemiddeld
- Chemische stoffen:15ml 2mol/l NaOH – 5g droogijs
- Thema: chemische reacties
- Tijd: 25 min
- Begrippen: wet van behoud van massa
3.2.5. Wet van behoud van massa aantonen

- Info: Is er een verband tussen de massa van de reagentia en de massa van de reactieproducten? Reactie met bakpoeder en tafelazijn
- Moeilijkheid: gemiddeld
- Chemische stoffen:1bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van massa
3.2.6. Papier maken

- Info: IHoe kunnen we zelf papier maken? We maken een mengsel van papier en water. Hierdoor wordt het papier zacht en kan je het in kleine deeltjes verdeeld. Wanneer we het papier laten drogen, krijgen we een gerecycleerd velletje papier.
- Moeilijkheid: gemiddeld
- Chemische stoffen: oud papier – Water
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van massa
3.2.7. Paperclips voor de wet van behoud van massa

- Info: Op welke manier kunnen we paperclips gebruiken voor het aanleren van de wet van behoud van massa?
- Moeilijkheid: eenvoudig
- Chemische stoffen:Paperclips in verschillende kleuren
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van massa
3.2.8. Verandering van massa staalwol bij verbranding

- Info: Wat gebeurt er als je staalwol verbrandt? De staalwol begint te gloeien. Het wordt donkergrijs. De balkbalans zakt aan de brandende kant naar beneden.
- Moeilijkheid: eenvoudig
- Chemische stoffen:2 plukjes staalwol
- Thema: chemische reacties
- Tijd: 20 min
- Begrippen: wet van behoud van massa
3.2.9. Massaverandering bij chemische reacties
- Info: Is er een verband tussen de massa van de reagentia en de massa van de reactieproducten? Bij de eerste reactie met vorming van calciumcarbonaat is gewicht hetzelfde. De stoffen reageren met elkaar, maar er gaat geen stof weg.Bij de tweede reactie is het gewicht na de reactie lager. Omdat er bij de reactie koolstofdioxide geproduceerd wordt en dit vangen we niet op.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2CO3-opl 1 mol/l – Ca(NO3)2 oplossing 1 mol/l – stukje marmer – HCl oplossing 2 mol/l
- Thema: chemische reacties
- Tijd: 10 min
- Begrippen: wet van behoud van massa
3.3. Wet van de constante massaverhouding
3.3.1. Juiste verhouding tussen bakpoeder en tafelazijn

- Info: Is er een verhouding tussen enerzijds de reagentia en anderzijds de reactieproducten? Wanneer 2 of meer reagentia met elkaar reageren, gebeurt dat steeds in een vaste massaverhouding. In een andere stofverhouding zal minstens een van de reagentia overblijven. Deze stof is in overmaat aanwezig. Het reagens dat het minst aanwezig is, is het limiterende reagens.Dit is de wet van Proust of de wet van de constante massaverhoudingen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: bakpoeder – tafelazijn
- Thema: chemische reacties
- Tijd: 10 min
- Begrippen: wet van constante massaverhouding
3.3.2. Stoichiometrische verhouding bepalen via neerslagvormingsreactie
- Info:Op basis van de hoeveelheid neerslag wordt gekeken welke de stoechiometrische verhouding is tussen Ca2+ en verschillende anionen telkens van een zelfde concentratie.De tegengestelde ionen worden in verschillende concentraties ten op zicht van elkaar gebracht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1 mol/l CaCl2 (1,47 g CaCl2.2H2O in 100ml oplossing) – 0,1 mol/l Naoxalaat (1,34 g Na2C2O4 in 100ml oplossing) – 0,1 mol/l Na3PO4 (3,8 g Na3PO4.12H2O in 100 ml oplossing) – 0,1 mol/l Na-oleaat (3,04 g Na-oleaat in 100 ml oplossing)
- Thema: chemische reacties
- Tijd: 30 min
- Begrippen: wet van constante massaverhouding
3.3.3. Volumeverhouding van gassen bij elektrolyse van water

- Info:Is er een welbepaalde verhouding in volume gassen bij de elektrolyse van water?
- Moeilijkheid: eenvoudig
- Chemische stoffen: toestel van Hoffmann
- Thema: chemische reacties
- Tijd: 30 min
- Begrippen: wet van constante massaverhouding






