Hoofdstuk 4 – Film oefenvideo’s
Chemische bindingen
-
Ionen
Ionverbinding of atoomverbinding?
Ionverbindingen
- Schrijf de verbindingen tussen calcium en nitraat
- Schrijf de verbinding tussen ammonium en zwavel
- Schrijf de verbinding tussen strontium en chloor
- Schrijf de verbinding tussen koper(I) en carbonaat
Atoomverbindingen
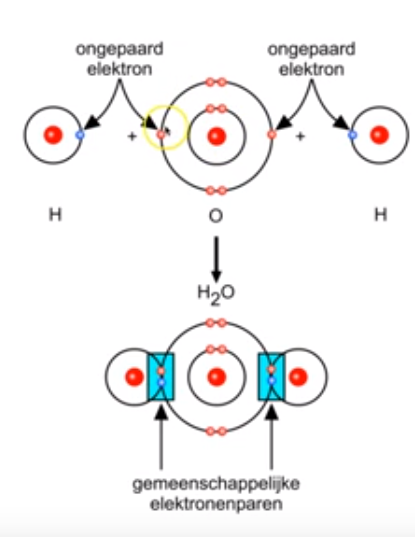
Bespreek de vorming van de (normale) atoombindingen in water
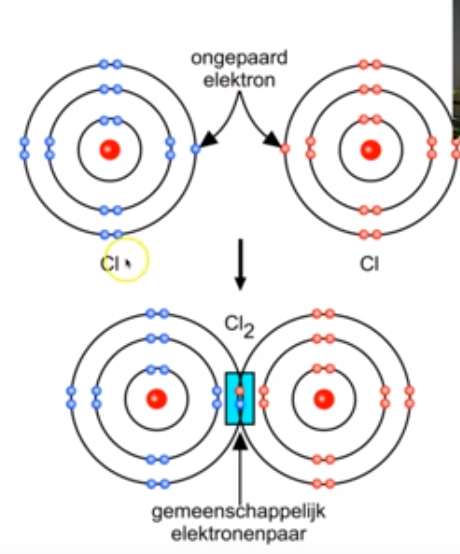
Bespreek de normale atoombinding van Cl2
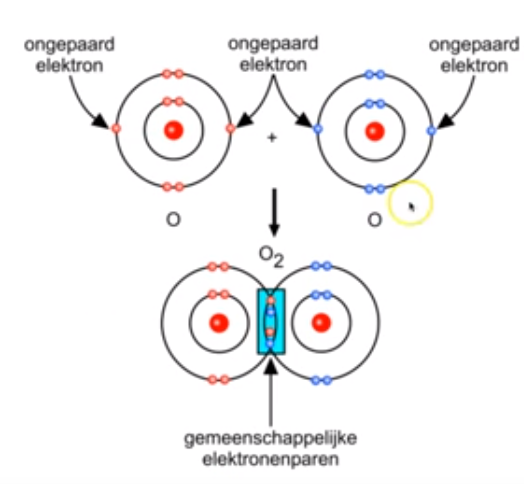
Bespreek de normale atoombindingen in O2
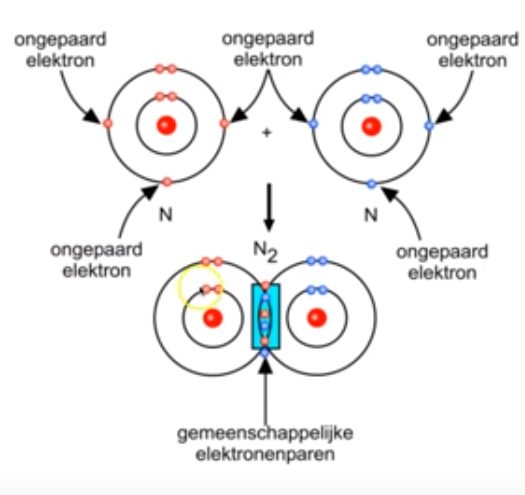
Bespreek de normale atoombindingen in N2
Stel de atoombinding van CH4 .
Bespreek de donor-acceptor atoombinding in HClO2
Lewisstructuur
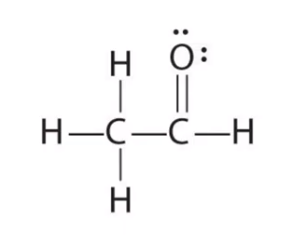
- Teken de Lewisstructuur van methanal: CH2O
- Teken de Lewisstructuur van het thiocyanaation: SCN–
- Teken de Lewisstructuur van het azide-ion: N3–
- Geef de Lewisstructuur van het carbonaation en geef de mesomere grensstructuren van dit ion.
- Geef de Lewisstructuur en de 4 mesomere grensstructuren van cyanogeen-azide: CN4. De volgorde van de atomen in de structuur is NCNN .
- Een Si44- -ion heeft de vorm van een tetraëder. Op elk hoekpunt van de tetraëder is een Si-deeltje aanwezig. Geef de Lewisstructuur van een ion Si44-. Geef de formele ladingen aan.
- Stel de Lewisstructuur op met gegeven skelet:

Geef de Lewisstructuur van het volgend polyatomisch ion met skelet:

Geef de Lewisstructuren van NF3, CS2, CN–
Hybridisatie
Sigma en pi bindingen
Sterisch getal
Geef het sterisch getal van de volgende structuurformules
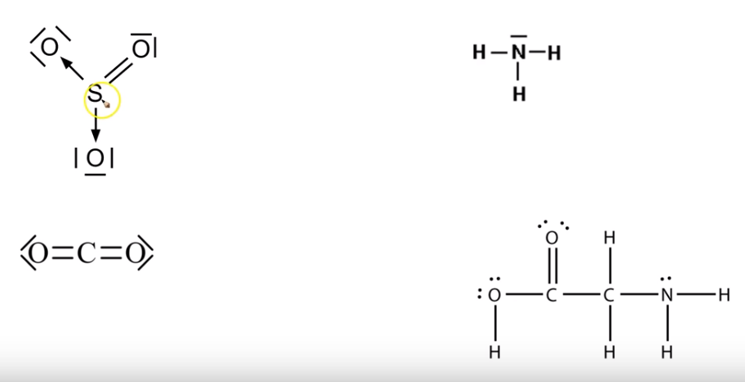
Bepaal de sterisch getallen van CH4, HCHO, NH3, H2O
VSEPR model
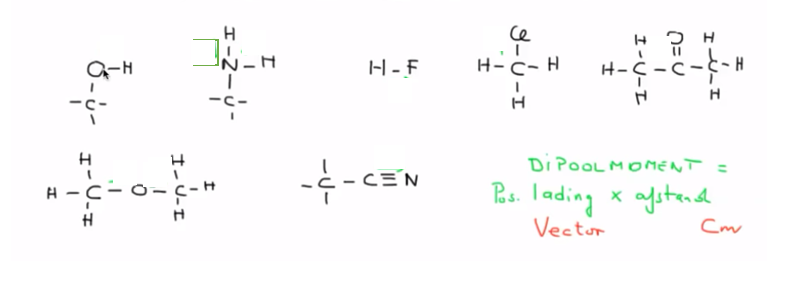
Polariteit
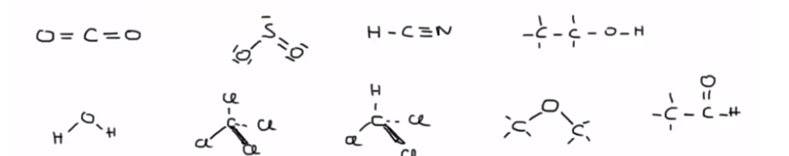
Formele lading
Fysische eigenschappen verbindingen
- Welke binding levert de grootste bijdrage aan de hoogte van het kookpunt?Als de dipool/dipoolbinding de grootste bijdrage zou leveren (dus de dipool-dipoolbinding zou sterker zijn dan de VanderWaalsbinding), zou het kookpunt bij SiCl4 lager moeten zijn dan het kookpunt van SiHCl3 want SiCl4 heeft geen dipool-dipoolbinding.






