Hoofdstuk 12 – Film oefenvideo’s
Redoxreacties
-
Oxydatiegetal
- Geef de oxidatiegetallen van de atomen in HCN
- Geef de oxidatiegetallen van de atomen in H2SO4
- Geef de oxidatiegetallen van de atomen in HPO42-
- Geef de oxidatiegetallen van de atomen in propaan-1-ol
- Geef de oxidatiegetallen van de atomen in propanal
- Geef de oxidatiegetallen van de atomen in propaanzuur
Oxidator of reductor
- S –> S2-
- Ca –> Ca2+
- K+ –> K
- F– –> F
Redoxreacties opstellen
- Stel de redoxreactie op: Ik voeg kobalt toe aan een nikkelchloride oplossing.
- Stel de redoxreactie op: Joodvlekken (I2) verwijderen met een natriumsulfietoplossing.
- Schrijf de redoxreactie: kaliumpermanganaatoplossing aangezuurd met vast koper
- Stel de redoxreactie op van de reactie tussen een goud(III)nitraatoplossing en een kaliumbromide-oplossing.
- Geef de eventuele redoxreactie aan met chloorgas en een natriumbromide oplossing
- Geef de eventuele redoxreactie aan van een stukje nikkel in een oplossing van kobaltchloride
- Geef de eventuele redoxreactie aan van een ijzer(III) chloride oplossing en een kaliumjodide-oplossing
- Geef de eventuele redoxreactie aan van een waterstofperoxide-oplossing bij een aangezuurde natriumjodide oplossing
Voorspel of de redoxreactie opgaat
- Voorspel of de reactie Cu + H2O opgaat
- Voorspel of de reactie KMnO4 + NaBr opgaat
- Voorspel of de reactie HCl + Fe opgaat
- Geef aan of de redoxreactie optreedt tussen aluminium en zoutzuur
- Geef aan of de redoxreactie optreedt tussen water en aluminiumfluoride
- Geef aan of er een redoxreactie optreedt tussen zink (s) en water
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd: Ijzer(III)acetaat-oplossing en Ni
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd: Chloor en een zwaveldioxide-oplossing
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd.Een oplossing van KBr en I2
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd:Tin(IV)bromide-oplossing en een overmaat aluminium
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd. Een waterstofperoxide-oplossing en een aangezuurde kaliumjodide-oplossing
Halfreacties opstellen
- Stel de halfreacties op van de reactie van aluminium met dichloor.
- Geef de halfreactie van de omzetting van het dichromaation Cr2O72- tot Cr3+ in een zuur milieu
- Het permanganaation MnO4– wordt omgezet in neutraal milieu in mangaan(IV)oxide, MnO2. Geef de halfreactie.
Richting redoxreactie
Cl2 + Mn2+ <–> Cl– + MnO4– in zuur milieu
Werking batterij
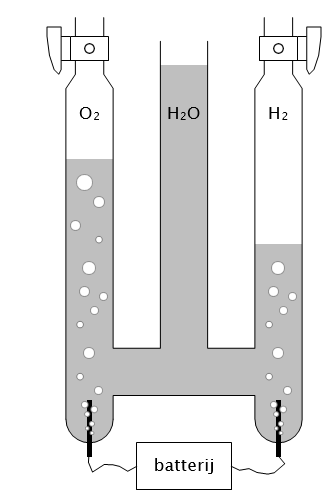
Elektrolyse
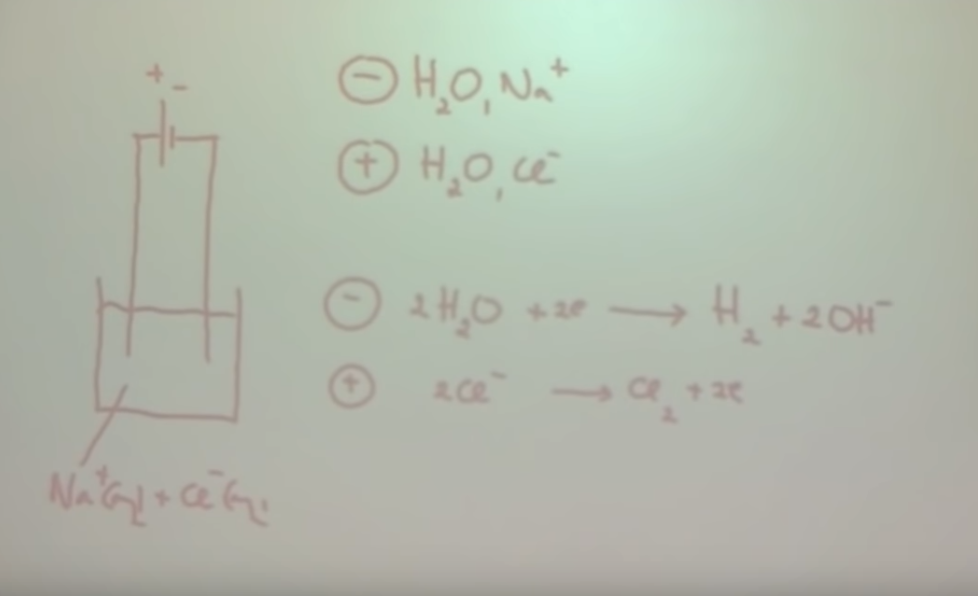
2. Geef aan de hand van de figuur de werking van elektrolyse aan
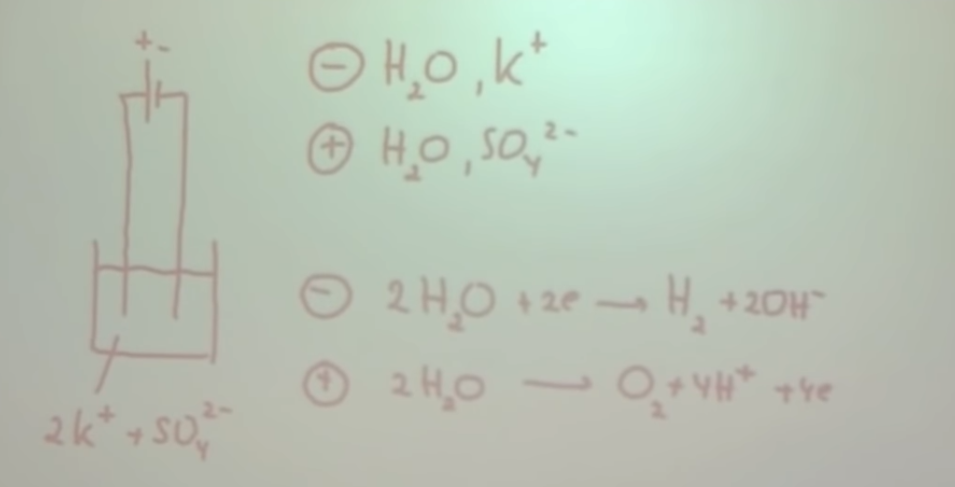
-
Elektrochemische cel
- Geef de reactievergelijking indien de reactie plaatsvindt wanneer de volgende stoffen aan elkaar worden toegevoegd: een koper(II)sulfaatoplossing en een zinken staaf. Deeltjes aanwezig, sterkste oxidator, sterkste reductor.
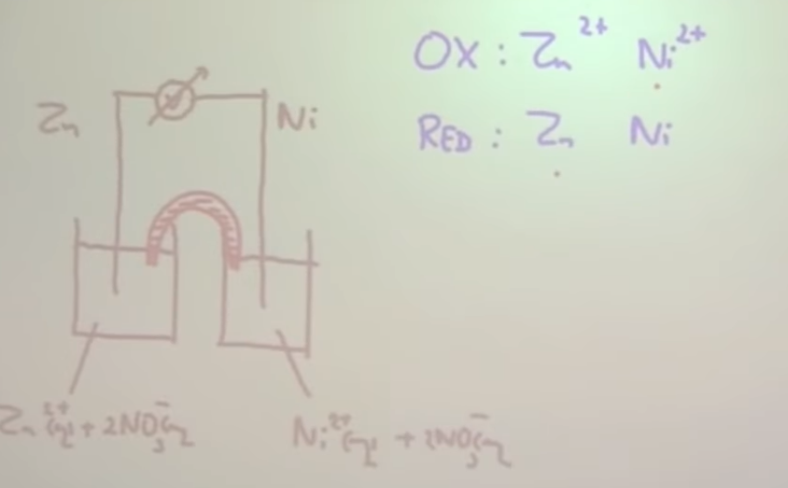
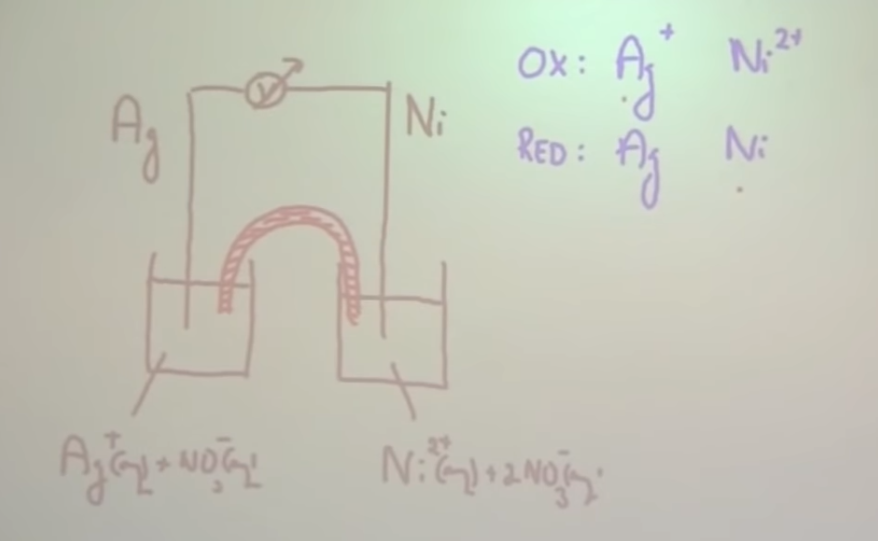
- Teken de elektrochemische cel van een koperen staaf in een kopersulfaat-oplossing en een zinken staaf in een zinknitraatoplossing
- Teken de elektrochemische cel van een koperen staaf in een kopersulfaat-oplossing en een zinken staaf in een zinknitraatoplossing. Welke staaf is de + pool en welke de – pool? Geef in de tekening aan hoe de elektronen lopen en licht de werking van de zoutbrug toe.
- Teken de elektrochemische cel van een koperen staaf in een kopersulfaat-oplossing en een zinken staaf in een zinknitraatoplossing. Welke staaf is de + pool en welke de – pool? Geef in de tekening aan hoe de elektronen lopen en licht de werking van de zoutbrug toe. Na werking van de cel is de zinken staaf met 45,3 mg in massa afgenomen. Bereken de massatoename van de koperen staaf
Titraties
1.Bleekwater is een oplossing van natriumhypochloriet, NaClO, en NaCl in water. Het hypochlorietion, ClO– is verantwoordelijk voor de blekende werking.Maaike en Denise bepaalden [ClO–] van bleekwater. Ze verdunden het bleekwater 10 keer waarna ze 10,00 ml van het verdunde bleekwater pipetteerden in een erlenmeyer. Hieraan voegden ze 50 ml water toe, 40 ml 1 mol/l zwavelzuur en 2 g vast kaliumjodide. De volgende reacties traden op:
ClO– + Cl– + 2 H+ –> H2O + Cl2
I2 + 2 S2O32- –> S4O62- + 2 I–
Bereken [ClO–] van het onverdunde bleekwater.
De volgende reactie treedt op:
H2O2 + 2H+ + 2I– –> 2 H2O + I2
2 S2O32- + I2 –> S4O62- + 2 I–
Daarna werd 0,025 mmol kaliumjodaat (KIO3) in oplossing toegevoegd. Dit was een overmaat.
Er trad een reactie op onder vorming van onder andere dijood: 4 IO3– + 5 N2H5+ –> 2 I2 + 5 N2 + 12 H2O + H+
Na volledige omzetting van de N2H5+ werd een overmaat kaliumjodide in oplossing toegevoegd. De overgebleven jodaat werd daardoor omgezet in dijood: IO3– + 5 I– + 6 H+ –> 3I2 + 3 H2O
Tenslotte werd de ontstane oplossing getitreerd met een natriumthiosulfaatoplossing volgens I2 + 2 S2O32- –> 2 I– + S4O62-
Bereken de molariteit van het hydrazine in het ketelwater.
Permanganometrie
Bepaal de concentratie oxalaat in oplossing.
2 MnO4– + 16 H+ + 5 C2O42- –> 2 Mn2+ + 8 H2O + 10 CO2
Jodometrie
Bepaling van de concentratie H2O2 in oplossing