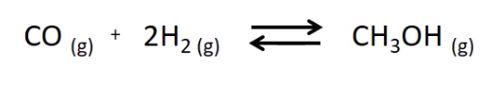Hoofdstuk 15 – Film oefenvideo’s
Chemisch evenwicht
Evenwichten
2. In een vat van 10,0 l bevindt zich 3,0 mol H2 , 4,5 mol I2 en 0,50 mol HI. Als er evenwicht is, geldt: H2(g) + I2(g) <–> 2 HI (g) met K= 46 . Bereken met de gegevens of er sprake is van een evenwicht
4. Noteer de evenwichtsconstante van de reactie: A + B <–> 2 C
7. In een reactievat met een volume van V=2,0 dm³ wordt 10 ml SO2 en 7 mol O2 gemengd. Men brengt het geheel op een temperatuur van T=1000 K en het volgende evenwicht stelt zich in: 2 SO2(g) + O2 (g) <–> 2 SO3 (g).
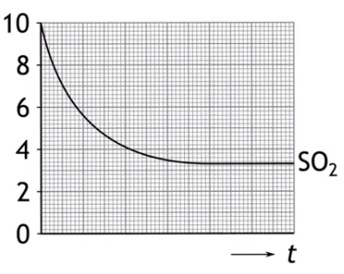
- Bereken de hoeveelheden van de drie stoffen bij evenwicht
- Teken nauwkeurig de lijnen van O2 en SO3 in de grafiek
- Bereken de evenwichtsconstante
8. Ammoniak kan worden gevormd uit stikstofgas en waterstofgas. Het gaat hierbij om een evenwichtsreactie: N2 + 3 H2 <–> 2 NH3 K= 0,20 . Men brengt in een vat van 3,0 dm³ de volgende stoffen bij een temperatuur van 500 K:
Laat met een berekening zien dat er geen sprake is van een evenwichtssituatie. Leg uit hoe de hoeveelheden veranderen als het evenwicht zich instelt. Nadat het evenwicht zich heeft ingesteld, heeft er 0,37 mol stikstofgas gereageerd. Laat zien dat er nu wel sprake is van een evenwichtssituatie.
9. In een buis bevindt zich een mengsel van NO2 en N2O4. Er heeft zich een evenwicht ingesteld: N2O4(g) <–> 2 NO2 (g)
- In de evenwichtstoestand bevat de buis evenveel mol N2O4 als NO2
- In een evenwichtstoestand vinden er geen reacties meer plaats in de buis.
10. Gegeven is het volgende gasevenwicht: N2O4(g) <-> 2 NO2(g) . Bij een bepaalde temperatuur is de waarde van de evenwichtsconstante 4,5. In 4 buizen bevinden zich bij deze temperatuur mengsels van NO2 en N2O4. Je bepaalt in elke buis de molariteiten van beide gassen.

11. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g). In het evenwichtsmengsel zit 0,40 mol O2. Hoeveel mol NO2 heeft gereageerd?
12. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g) .In het evenwichtsmengsel zit 0,40 mol O2. Bereken hoeveel mol N2O4 is ontstaan?
13. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld.: N2O4 (g) ß> 2 NO2 (g) .In het evenwichtsmengsel zit 0,40 mol O2. Hoeveel mol NO2 heeft gereageerd? Hoeveel mol N2O4 is aanwezig in het evenwichtsmengsel?
14. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g). In het evenwichtsmengsel zit 0,40 mol O2. Bereken de waarde van de evenwichtsconstante bij de heersende temperatuur.
15. In een reactievat van 1,0 l brengt men 0,75 mol N2O4(g) en 0,50 mol NO2(g). Na enige tijd heeft zich het volgende evenwicht ingesteld. N2O4 (g) <–> 2 NO2 (g) .In het evenwichtsmengsel zit 0,40 mol O2. Hoeveel mol NO2 heeft gereageerd? Hoe groot is het rendement van de reactie in procenten?
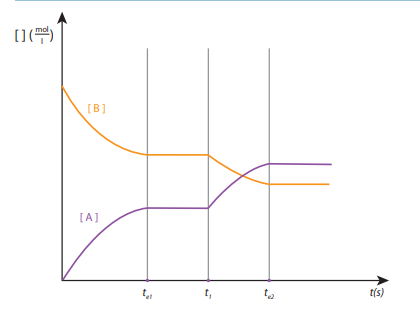
16. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g). De waarden zijn op 4 verschillende tijdstippen weergegeven.
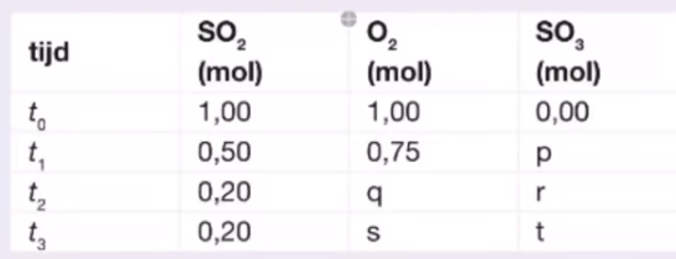
Wanneer is er evenwicht? Bereken wat er achtereenvolgens in de tabel moet worden ingevuld op de aangegeven plaatsen.
17. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g)

De waarden zijn op 4 verschillende tijdstippen weergegeven. Leg uit bij welk tijdstip het evenwicht heeft ingesteld.
18. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g)

De waarden zijn op 4 verschillende tijdstippen weergegeven. Geef de evenwichtsvoorwaarde voor het evenwicht
19. In een afgesloten vat met een volume van 50 l wordt bij T°C zwaveldioxide en zuurstofgas gebracht. Het volgende gasevenwicht stelt zich in: 2 SO2(g) + O2(g) <–> 2 SO3(g)

De waarden zijn op 4 verschillende tijdstippen weergegeven. Bereken de evenwichtsconstante voor dit evenwicht bij T°C.
a 2 SO2 (g) + O2 (g) ⇋ 2 SO3 (g)
b CH4 (g) + 2 H2S(g) ⇋ CS2 (g) + 4 H2 (g)
22. Hoe beïnvloedt indamping de ligging van volgende evenwichtsreactie? Motiveer je antwoord.
Fe3+ (opl) + SCN−(opl) ⇋ FeSCN2+ (opl)
CO (g) + 2 H2 (g) ⇋ CH3OH (g) (ΔU < 0)
INVLOED EVENWICHTSVERSCHUIVING
24. Smog is een type van luchtvervuiling die boven grootsteden waarneembaar is als een bruine mist. Het woord smog is een samentrekking van de woorden smoke en fog, en betekent letterlijk rokerige mist.Eén van de stoffen die verantwoordelijk is voor de bruine kleur van smog is NO2 die afkomstig is van uitlaatgassen. Wanneer je NO2 in een gashouder brengt, ontstaat volgende evenwichtsreactie:
Verklaar telkens op welke manier het evenwicht beïnvloed wordt
25. In een gesloten reactievat ontstaat een evenwicht tussen CO, O2 en CO2:
2 CO(y) + O2 (y)⇋ 2 CO2 (y) (ΔU < 0)
Vul in of de concentratie CO stijgt, daalt of gelijk blijft.
- a Een temperatuursstijging.
- b Toevoegen van een platina katalysator.
- c Een drukstijging.
- d Toevoegen van zuurstofgas.
CO (g) + 2 H2 (g)⇋ CH3OH (g)(ΔU < 0)
Vul in of de concentratie methanol stijgt, daalt of gelijk blijft bij volgende gebeurtenissen:
- a Temperatuurstijging
- b Volumevermindering
- c Toevoegen van koolstofoxide
- d Verwijderen van de katalysator
27.Verklaar wat er gebeurt als je uitgaande van een evenwichtsmengsel
2 SO2 (g) + O2 (g)⇋ 2 SO3 (g) (ΔU < 0)
- a SO3 wegneemt.
- b O2 toevoegt.
- c het reactiemengsel afkoelt.
- d een positieve katalysator toevoegt.
- e de druk van het reactiemengsel doet stijgen.
28.Volgende evenwichtsreactie is gegeven:
2 H2O (g) + 2 Cl2 (g)⇋ 4 HCl (g) + O2 (g) (ΔU < 0)
- a Schrijf de formule voor de evenwichtsconstante.
- b Som alle factoren op die de opbrengst aan O2 verhogen.
29. Bij een onderzoek naar de gasdruk in gasmengsels breng je 20,85 g PCl5, 13,75 g PCl3 en 7,10 g Cl2 in een gashouder van 2,00 l. Bij evenwicht meet je een dichloorconcentratie van 3,2 · 10−2 mol/l . Bereken de evenwichtsconstante en leid er de ligging van het evenwicht uit af. PCl5 ⇋ PCl3 + Cl2
N2 + O2⇋ 2 NO K = 1,7 · 10–3 bij 2300 K
- Wat is de formule voor de evenwichtsconstante van deze reactie?
- Bereken de evenwichtsconstante
- Bereken de omzettingsgraad van deze reactie bij evenwicht
33. Men mengt de gassen A n en B in een vat van 2,00 liter. De volgende reactie gaat door:
- Hoe groot is de concentratie van D bij deze temperatuur?
- Hoeveel mol A was er oorspronkelijk aanwezig?
- Wat is het rendement en de omzettingsgraad van deze reactie?
De beginhoeveelheid wordt verdubbeld, de rest niet.
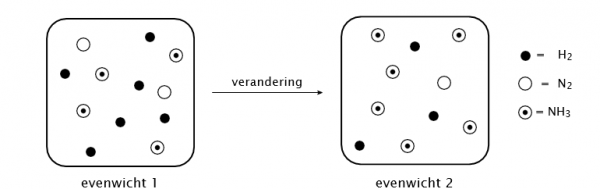
3 H2 (g) + N2 (g) <–> 2 NH3 (g)
Welke verandering werd er aan evenwicht 1 aangebracht om vervolgens evenwichtstoestand 2 te bekomen?
a.1,8 10-3 b. 55 c. 77 10 d. 31 102
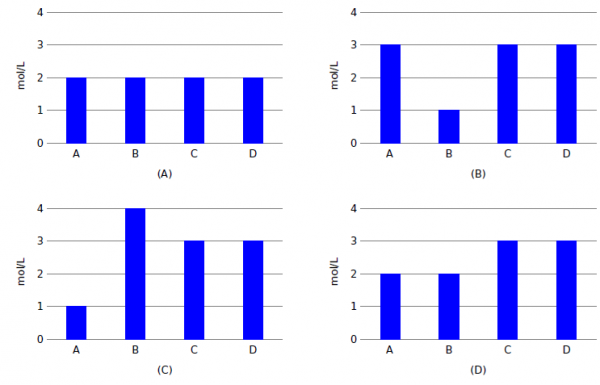
40. Onderstaande grafieken geven de evenwichtsconcentraties weer van vier verschillende reacties. De reacties zijn
allemaal van het type:
2A(aq) + 2B(aq) <–> C(aq) + D (aq)
Welke grafiek hoort bij de reactie met de grootste evenwichtsconstante?
Evenwicht invloed van factoren
1. Men beschouwt het volgende evenwicht.: 2 A (g) + 4 B(g) <–> 3 C(g) + 4 D(s). De reactie naar rechts is exotherm.
- Geef de evenwichtsvoorwaarde
- Leg uit aan de hand van de Qc en K hoe het evenwicht verschuift als extra A wordt toegevoegd aan het evenwicht
- Leg uit aan de hand van de Qc en K hoe het evenwicht verschuift als extra C wordt toegevoegd aan het evenwicht
- Leg uit aan de hand van de Qc en K hoe het evenwicht verschuift als de druk wordt verkleind door het reactievat groter te maken
- Leg uit hoe het evenwicht verschuift als de temperatuur wordt verhoogd.
2. In een vat van 1,00 l bevindt zich 2,0 mol NO2 en 3,0 mol N2O4. Er is een evenwicht. Dit evenwicht wordt verstoord door 0,50 mol extra NO2 toe te voegen. Bereken [NO2] en [N2O4] van het nieuwe evenwicht.: 2 NO2 <–> N2O4
- Bereken K en de omzettingsgraad
- Bereken de nieuwe evenwichtsconcentraties en de nieuwe omzettingsgraad die zullen ontstaan als je vervolgens 0,3 mol HI wegneemt
- We halveren de druk. Wat zijn de evenwichtsconcentraties?
- Bij een andere temperatuur is K=3,05. Is de temperatuur gestegen of gedaald? Leg uit.
4. Naar welke kant verschuift het evenwicht bij deze reactie als de druk verhoogt?