Hoofdstuk 14 – Experimenten
1. Chemisch evenwicht
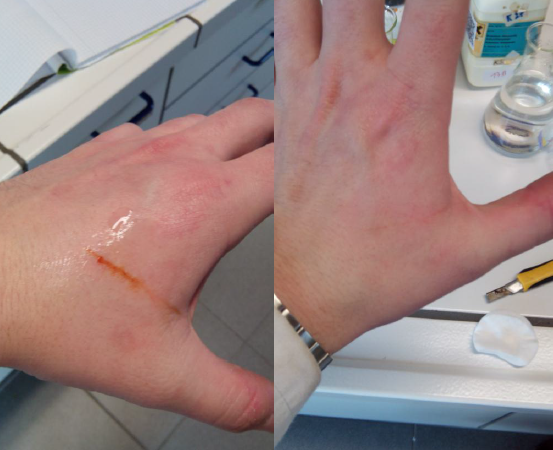
- Info:Hoe kunnen we een echte snijwonde simuleren in het labo en deze ook weer doen verdwijnen? Ijzerthiocyanaat is een stof met een rode kleur die veel wegheeft van de kleur van bloed. Het natriumfosfaat slaat het ijzer(III) neer en zorgt dat de reactie naar links beweegt. Deze stof reageert weg bij toevoeging van natriumfosfaat.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KSCN (3g op 100 ml) – FeCl3 (1 g op 100 ml) – Na3PO4.12H2O (10 g op 100ml)
- Thema: chemische reacties – chemisch evenwicht
- Tijd: 15 min
- Begrippen: principe van evenwicht – complexreactie
1.2. Kobaltchloride thermometer

- Info: Hoe functioneert Kobaltchloride als thermometer? De kobaltchloride kan gebruikt worden om extreme koude of extreme warmte aan te duiden. Door kleurverandering. Bij koude temperatuur kleurt de oplossing rood en in een warme omgeving, kleurt deze blauw.
- Moeilijkheid: gemiddeld
- Chemische stoffen: CoCl2.6H2O 1 mol /l – isopropanol
- Thema: chemische reacties – energetische aspecten – chemisch evenwicht
- Tijd: 10 min
- Begrippen: invloed temperatuur op evenwicht
1.3. Het evenwicht aantonen met een kobaltdichloride oplossing
- Info: Toevoeging van water verandert de blauwe alcoholische oplossing van CoCl2 van blauw naar paars. Toevoeging van KCl aan de ethanol CoCl2 oplossing veroorzaakt ook een verandering van blauw naar paars.
- Moeilijkheid: gemiddeld
- Chemische stoffen: CoCl2 waterige oplossing 0,1 mol/l – CoCl2 ethanoloplossing 0,1 mol/l – Geconc HCl – Gec H2SO4 – KCl 0,1 mol/l – KCl poeder
- Thema: chemische reacties – energetische aspecten – chemisch evenwicht
- Tijd: 10 min
- Begrippen: invloed temperatuur op evenwicht
1.4. Ijzerevenwicht
- Info: Hoe kan het evenwicht tussen ijzer(III)-ionen en thiocyanaat beïnvloed worden?
- Moeilijkheid: gemiddeld
- Chemische stoffen: FeCl3 0.2 g/100 ml – KSCN 0.2 g/100 ml – K4Fe(CN)6 1g/100 ml – tanninezuur 0.2 g/100 ml – salicylzuur 0.2 g/100 ml – EDTA 2g/100 ml
- Thema: chemische reacties – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed concentratie op evenwicht
1.5. Koolstofdioxide/koolzuur evenwicht
- Info: Hoe kan het evenwicht tussen koolzuurgas opgelost en in gas beïnvloed worden? CO2 in evenwicht met H2CO3
- Moeilijkheid: gemiddeld
- Chemische stoffen: ijswater – 40ml CO2
- Thema: chemische reacties – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed druk op evenwicht
1.6. Magische kleurenwissel in een spuit

- Info:De broomthymolblauwoplossing wordt bereid door O,1 g broomthymolblauw te brengen in 8 ml van een licht basische oplossing van NaOH (O,2M). Leng aan tot 50 ml. Verdun nu verder dit staal totdat een doorzichtige blauwe oplossing wordt bekomen.Breng niet te veel staal in de meetspuiten. Je hebt voldoende ruimte nodig om de gevormde CO2 in de vrije ruimte te laten bewegen.Het duur een tijdje eer de overgang van groen naar geel terug verschijnt. Schud tussen door.
- Moeilijkheid: gemiddeld
- Chemische stoffen: broomthymolblauw-indicatoroplossing – spuitwater
- Thema: Anorganische stoffen – chemisch evenwicht
- Tijd:20 min
- Begrippen: zuren – invloed druk op evenwichtsreactie

- Info: Wat is de temperatuur waarbij de oplossing van kleur verandert?
- Moeilijkheid: eenvoudig
- Chemische stoffen: CoCl2.6H2O 1 mol/l – Ethanol
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – invloed van temperatuur
1.8. Veranderende evenwichtsconcentraties

- Info: Wat is de temperatuur waarbij de oplossing van kleur verandert? Een chemisch evenwicht ontstaat wanneer in een reactievat twee tegengestelde reacties optreden waarbij de reactieproducten van de eerste reactie de beginstoffen zijn van de tweede reactie. Als beide reacties met dezelfde snelheid verlopen, is er sprake van een chemisch evenwicht.
Zo is er na de vorming van zilverchromaat op dat moment een evenwicht waarbij evenveel vast zilverchromaat in oplossing gaat als er zilver- en chromaationen uit de oplossing combineren tot het slecht oplosbare zout.
De evenwichtsconcentraties veranderen door wijziging van de omstandigheden: een andere temperatuur, andere concentraties van opgeloste stoffen of ionen. - Moeilijkheid: gemiddeld
- Chemische stoffen: 0,2M AgNO3 oplossing – 0,2M K2CrO4 oplossing – 0,2M NaCl – 1M NH3 – 2M HCl
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 30 min
- Begrippen: zouten – invloed van concentratie
1.9. Wet van Le Châtelier
- Info: Hoe kan het evenwicht tussen ijzer(III)-ionen en thiocyanaat beïnvloed worden?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,1 mol/l KSCN – 0,01 mol/l KSCN – 0,1 mol/l Fe(NO3)3 – 0,01 mol/l Fe(NO3)3.
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: zouten – invloed van concentratie
1.10. Hoe kunnen we het evenwicht koolzuur/koolstofdioxide beïnvloeden?

- Info: Hoe kunnen we het CO2/H2CO3 evenwicht in water beïnvloeden? We kunnen dit beïnvloeden door gebruik te maken van druk. Deze factor zal invloed hebben op de oplosbaarheid van CO2 in de oplossing.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Broomthymolblauwoplossing – Gedestilleerd water – Spuitwater
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed van druk
1.11. Invloed van druk op het chemisch evenwicht

- Info: Hoe kunnen we het CO2/H2CO3 evenwicht in water beïnvloeden? Door verhogen van de druk op een homogeen gasevenwicht neemt het volume af en daardoor nemen alle concentraties toe. Als het volume gehalveerd wordt bijvoorbeeld, verdubbelen alle concentraties.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Broomthymolblauwoplossing – Gedestilleerd water – Spuitwater
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed van druk
1.12. Invloed van temperatuur op het chemisch evenwicht

- Info: Op welke manier beïnvloedt temperatuur het chemisch evenwicht? De evenwichtsconstante is afhankelijk van de temperatuur; zo kan een verandering in de temperatuur van een evenwichtsoplossing ook resulteren in een verschuiving naar rechts of links, afhankelijk van het feit of de reactie exotherm of endotherm is.
- Moeilijkheid: eenvoudig
- Chemische stoffen: KSCN (3g op 100 ml) – FeCl3 (1 g op 100 ml) – Keukenzout
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed van temperatuur
1.13. Meten van een evenwichtsconstante

- Info: Hoe berekenen we de evenwichtsconstante? Via titratie
- Moeilijkheid: eenvoudig
- Chemische stoffen: 5 ml zilvernitraatoplossing 0,10 mol/l – 5 ml ijzer(II)sulfaatoplossing 0,10 mol/l – kaliumthiocyanaatoplossing 0,020 mol/l
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 40 min
- Begrippen: evenwichtsconstante
1.14. Bruisend evenwicht

- Info: Welke evenwichtreactie zit er in een bruisfles? Door te schudden met het flesje verhogen we de druk, daarna laten we het staan. Daarna komt een drukverlaging door de vergroting van de ruimte/volume met de ballon. Het evenwicht verschuift naar links, er ontstaat gas, koolstofdioxide: laat kaars snel uitdoven en is zuur afkomstig dus van H2CO3.
- Moeilijkheid: eenvoudig
- Chemische stoffen: flesje bruiswater – universele indicator
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 40 min
- Begrippen: invloed van druk op evenwicht
1.15. Zetmeeljodide complex

- Info: Welke factoren beïnvloeden het evenwicht van evenwichtsreacties? Door de oplossing op te warmen, verschuift de evenwichtsreactie naar links waardoor de oplossing de kleur krijg van het lugol, geel jodium. Door de oplossing te koelen of op kamertemperatuur te zetten, verschuift de reactie naar rechts. Hierdoor ontstaat er meer complex waardoor het de donkere blauwe kleur krijgt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zetmeeloplossing 5 g/l – Jodiumtinctuur/lugoloplossing
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 30 min
- Begrippen: invloed van temperatuur op evenwicht
1.16. Thee experiment

- Info: Welke factoren beïnvloeden het evenwicht van evenwichtsreacties? Er zit thearubigine in thee. Deze verandert van kleur naargelang we een zuur of base toevoegen aan de thee. Thee kan dus gebruikt worden als zuur-base indicator. In een zuur milieu zal de thee lichter kleuren en in een basisch milieu donkerder.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 75 ml zwarte thee: – azijn – NaOH 0,10 mol/l
- Glazen roerstaaf
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 30 min
- Begrippen: invloed van mileu op evenwicht
1.17. Het rode chemisch evenwicht

- Info: Welke factoren beïnvloeden het evenwicht van evenwichtsreacties? Wanneer het evenwicht naar rechts verschuift zal de kleur donkerder worden omdat hier de concentratie van het rode complex stijgt. Wanneer het evenwicht naar links verschuift zal de kleur lichter worden, door de concentratieverhoging van het rode complex.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,10 mol/l FeCl3-oplossing – 0,10 mol/l KSCN-oplossing – FeCl3 (vast of verzadigde oplossing) – KSCN (vast of verzadigde oplossing) – 0,10 mol/l AgNO3-oplossing – 0,10 mol/l NaOH-oplossing
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 30 min
- Begrippen: invloed van concentratie op evenwicht
1.18. Het evenwicht van water

- Info: Hoe kunnen we het CO2/H2CO3 evenwicht in water beïnvloeden? Spuitwater ontstaat door onder een hoge druk koolstofdioxide in water op te lossen. Zo ontstaat koolzuur (CO2 + H2O <–> H2CO3). Wanneer de druk verdwijnt, komt het gas terug vrij.Broomthymolblauw is een pH-indicator die rond een pH van 7,1 omslaat. De indicator kleurt geel in een zuur milieu, groen in een neutraal milieu en blauw in een basisch milieu.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Broomthymolblauwoplossing – Gedestilleerd water – Spuitwater
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed van druk op evenwicht
1.19. Ammoniumchloride verwarmen

- Info: NH4Cl <–> NH3 + HCl is een evenwichtsreactie. Een evenwichtsreactie is een reactie die niet aflopend is. Het chemische evenwicht kan beïnvloed worden door katalysator, druk/volume, temperatuur en concentratie.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ammoniumchloride
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed van temperatuur op evenwicht
1.20. pH afhankelijkheid van het evenwicht

- Info: Wat is de invloed van de pH op het chemisch evenwicht?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Kopersulfaat pentahydraat – Ammoniak – Zwavelzuur
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: invloed van milieu op evenwicht
1.21. Modelvoorstelling dynamisch evenwicht

- Info: Hoe kan je een dynamische evenwichtstoestand voorstellen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: water – lugol
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: evenwichtsconstante
2. Oscillerende reacties
2.1. Alternatieve Belousov reactie

- Info: Mangaan(II) katalyseert de reactie. De mangaanionen vervullen de elektronentransfer in de reactie. De bromide-ionen die nodig zijn voor de oscillerende werking worden bekomen door een reeks van reacties.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 750 ml gedestilleerd water – 75 ml geconcentreerd zwavelzuur – 9 g malonzuur – 8 g KBrO3 – 1.8 g MnSO4.H2O
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 40 min
- Begrippen: oscillerende reactie
2.2. Oscillerende reactie van Briggs

- Info: De Briggs-Rauscher oscillerende reactie volgens klassiek recept
- Moeilijkheid: gemiddeld
- Chemische stoffen: zetmeeloplossing 1% – vast malonzuur – H2O2 30% – aminosulfonzuur vast – mangaansulfaat vast – Natriumjodaat vast
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 40 min
- Begrippen: oscillerende reactie

- Info: Methyleenblauw is een aromatische verbinding die opgelost in water blauw kleurt. Het is een redoxindicator die een duidelijke kleurverandering ondergaat op een specifieke potentiaal.Glucose wordt in een alkalische oplossing langzaam geoxideerd door zuurstof met vorming van gluconzuur. In aanwezigheid van natriumhydroxide is gluconzuur omgezet naar natriumgluconaat.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 10 g glucose – 12 g vast NaOH – 0.1 massa% methyleenblauwoplossing in ethanol
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: oscillerende reactie
2.4. De kloppende druppel

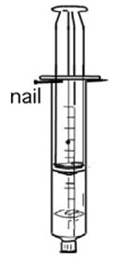
- Info: Breng de kwik op een petrischaaltje. Overgiet het met de zwavelzuuroplossing totdat de kwik onder staat. Breng nu een nagel zodat deze steekt in het zwavelzuur en juist contact maakt met de kwik. De kwikdruppel begint plots te trillen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 1.5 ml kwik – 6 mol/l H2SO4 – 0.1 mol/l K2Cr2O7
- Thema: anorganische stoffen – chemisch evenwicht
- Tijd: 15 min
- Begrippen: zouten – oscillerende reactie
2.5. De groen blauwe kolf

- Info:In het experiment wordt de geoxideerde vorm van methyleenblauw MB+ door ascorbinezuur gereduceerd naar MBH2+ en vervolgens door luchtzuurstof weer geoxideerd tot MB+. De zuurstof wordt door het schudden in de oplossing gebracht. Bij staan reduceert het ascorbinezuur MB+ terug naar zijn kleurloze vorm. Cu2+ ionen katalyseren deze laatste reactie
- Moeilijkheid: gemiddeld
- Chemische stoffen: zuiver vitamine C in poedervorm – oplossing van methyleenblauw in ethanol (0.1 g in 100ml ethanol 70%) – kopersulfaatoplossing 1,6 massa%
- Thema: chemische reacties – complexreactie – redoxreactie – chemisch evenwicht
- Tijd:20 min
- Begrippen: stofveranderingen – complexreacties – oscillerende reactie
2.6. Oscillatie aan koper

- Info: Wat gebeurt er met een verhitte koperdraad in de buurt van methanol? Er ontstaat een wisselwerking van gloei en vlammen en dit gedurende dertig minuten.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Methanol – Aluminiumplaat – Koperdraad
- Thema: enkelvoudige stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – oscillerende reactie
2.7. Oscillerende reactie

- Info: Landoltreactie
- Moeilijkheid: gemiddeld
- Chemische stoffen: KIO3 – geconcentreerd zwavelzuur – ethanol – Na2SO3 – zetmeel
- Thema: enkelvoudige stoffen – chemisch evenwicht
- Tijd: 20 min
- Begrippen: enkelvoudige stoffen – oscillerende reactie
2.8. Pulserend glas

- Info: Hoe kunnen we een schuimwijn maken die blijft schuimen? In het experiment blijft het vrijgekomen zuurstof in oplossing. Als de oplossing in een verzadigde toestand het zuurstofgas bezit, schuimt het plotseling en komt een grote hoeveelheid vrij. Het verzadigingspunt wordt nu niet meer bereikt. Indien een nieuwe oververzadiging wordt bereikt komt terug gas vrij.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Koper(II)chloride – Zoutzuur (2mol/l) – Waterstofperoxide (10%)
- Thema: anorganische stoffen – energetische aspecten – chemisch evenwicht
- Tijd: 20 min
- Begrippen: peroxiden – katalysator – oscillerende reactie
2.9. Variërend bruisen

- Info: Hoe kunnen we een pulserende gasoplossing maken? Het oscilleren van het bruisen bij deze reactie: evenwichten tussen oplossingen, condensatiekernen, kleine en grote belletjes en gasvormig stikstof.Doordat er nog steeds stikstof gevormd wordt, groeien de kerntjes uit tot kleine belletjes en die weer tot grotere die bruisend stikstof uit de oplossing drijven. Nu is de oplossing niet meer verzadigd; de bellen stijgen op en verdwijnen, en nieuw gevormde stikstof lost op tot de oplossing verzadigd raakt, et cetera. Als de stoffen nagenoeg zijn opgebruikt, wordt de vorming van stikstof te traag voor het oscillerend effect.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zoutzuur (2 mol/l) – Ammoniumchloride – Natriumnitriet – Gedestilleerd water
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
2.10. Herhaalde kleurveranderingen

- Info: Hoe kunnen we een oscillerende reactie uitvoeren? Mangaan(II) katalyseert de reactie. De mangaanionen vervullen de elektronentransfer in de reactie. De bromide-ionen die nodig zijn voor de oscillerende werking worden bekomen door een reeks van reacties.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Zwavelzuur (15%) (H2SO4) (132 ml) – Gedestilleerd water – Natriumbromaat (NaBrO3) (1.27 g) – Malonzuur (CH2(COOH)2) (1.6 g) – Mangaan(II)sulfaat (MnSO4) (0.33 g)
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
2.11. Blauw knipperlicht

- Info: Hoe ontstaat het blauw knipperlicht? In dit experiment komen twee reacties tegelijkertijd voor.Oxidatie van luminol, wat leidt tot luminescentie van de vulkaan, en waterstofperoxide H2O2-ontleding beïnvloed door kopersulfaat CuSO4. Ontleding van waterstofperoxide verloopt veel effectiever in de buurt van de stukjes CuSO4 die voldoende tijd hebben om lichtjes in water op te lossen. Daarom zijn er veel Cu2+ ionen, die verantwoordelijk zijn voor de afbraak van H2O2, beschikbaar rond deze stukjes in de oplossing.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Luminol (C8H7N3O2) – Ged. water (H2O) – Kopersulfaat (CuSO4·5H2O) – Waterstofperoxide 30% (H2O2) – Kaliumthiocyanaat (KCNS) – Natronloog
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
2.12. Chemisch zwaailicht

- Info: Hoe kunnen we een oscillerende reactie uitvoeren? De kleur van het mengsel verandert al snel van kleurloos via lichtbruin naar donkerbruin. Vervolgens wordt de oplossing diepblauw. Daarna begint dit proces opnieuw. De “blauwperiode” duurt echter steeds langer, op een gegeven moment verandert de kleur niet meer (en blijft de oplossing dus blauw). Het waterstofperoxide is dan verbruikt.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 0.035 mol/l zwavelzuur-oplossing – 0.05 mol/l kaliumjodaat-oplossing – 0,038 mol/l mangaansulfaat – 0,05 mol/l malonzuur – Waterstofperoxide-oplossing (12%) – Een oplossing van zetmeel in water: Concentratie: ca. 0,5 massaprocent – Een oplossing van zwavelzuur in water (5 mol/l)
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
2.13. Repeterende wekker

- Info: Hoe kunnen we een oscillerende reactie uitvoeren? De Briggs-Rauscher oscillerende reactie volgens klassiek recept
- Moeilijkheid: gemiddeld
- Chemische stoffen: zetmeeloplossing 1% – vast malonzuur – H2O2 30% – aminosulfonzuur vast – mangaansulfaat vast – Natriumjodaat vast
- Thema: anorganische stoffen – chemische reacties – redoxreactie – chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie
2.14. Zout en water oscilleren

- Info: Hoe kun je een oscillatie met water en zout bekomen? De inwaartse stroom stopt dan en de zoutoplossing stroomt weer uit de spuit. Deze cyclus herhaalt zich meerdere keren. Probeer de relatieve niveaus van de zoutoplossing en het omringende water te variëren door de spuit in het bekerglas omhoog en omlaag te brengen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 100-200 ml verzadigde natriumchloride-oplossing methyleenblauwe kleurstof
- Thema:chemisch evenwicht
- Tijd: 25 min
- Begrippen: zouten – oscillerende reactie






