Invloed van temperatuur op een chemisch evenwicht
Filmfragment
1.Onderzoeksvraag
Op welke manier beïnvloedt temperatuur het chemisch evenwicht?
2.Voorbereiding
- KSCN (3g op 100 ml)
- FeCl3 (1 g op 100 ml)
- Demi-water
- 3 proefbuizen
- Proefbuisrekje
- Bekerglas met ijs
- Bekerglas met water
- Keukenzout
- Kookplaat

3.Uitvoeren
a.Werkwijze
- Neem een kleine hoeveelheid FeCl3 -oplossing en doe dit in een proefbuis.
- Voeg hier een kleine hoeveelheid KSCN-oplossing aan toe.
- Leng het geheel aan met water.
- Verdeel het mengsel over de drie proefbuizen.
- Plaats een proefbuis in het bekerglas met ijs en voeg hier keukenzout aan toe om de temperatuur te doen dalen.
- Plaats een proefbuis in het bekerglas met water en verwarm dit met behulp van de kookplaat.
- Laat het laatste proefbuis in het proefbuisrekje staan als referentie.
- Vergelijk na enkele minuten de drie proefbuizen.
b.Waarneming (+ foto’s)

4.Reflecteren
FeCl3(aq) + 3KSCN(aq) <–> Fe(SCN)3(aq) + 3KCl(aq)
Voor de eerste reactiecombinatie:
Fe3+ + SCN– <–> FeSCN2- :
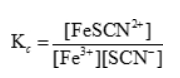
Veranderingen van concentratie(s), druk en volume hebben voor gevolg dat de ligging van het evenwicht verandert. Aan de evenwichtsconstante verandert er niets. De verandering van de temperatuur heeft echter wel een verandering van de evenwichtsconstante K voor gevolg. Voor exotherme evenwichtsreacties zal de evenwichtsconstante K dalen als de temperatuur stijgt.
Voor endotherme evenwichtsreacties zal de evenwichtsconstante K stijgen als de temperatuur stijgt.
Verhoging van de temperatuur doet de ligging van de evenwichtstoestand verschuiven in endotherme zin. Verlaging van de temperatuur doet de ligging van de evenwichtstoestand verschuiven in exotherme zin.
De evenwichtsconstante is afhankelijk van de temperatuur; zo kan een verandering in de temperatuur van een evenwichtsoplossing ook resulteren in een verschuiving naar rechts of links, afhankelijk van het feit of de reactie exotherm of endotherm is. Voor een exotherme reactie kan de door de reactie gegenereerde warmte worden weergegeven als verblijvend op de productzijde van de vergelijking, aangezien warmte wordt geproduceerd samen met de producten: aA + bB cC + dD + warmte
Als warmte aan het systeem wordt toegevoegd door de temperatuur te verhogen, verschuift het evenwicht naar links en nemen de concentraties van de reagentia toe. Voor een endotherme reactie zou de toevoeging van warmte resulteren in een verschuiving naar rechts.
aA + bB + warmte cC + dD In dit geval zouden de concentraties van de reagentia toenemen met een toename in temperatuur.
Bij het verwarmen van deze oplossing was de reactie naar links in het voordeel. Dit komt doordat de waarde van K afneemt bij het verhogen van de temperatuur.
5.Onderwerpen
- evenwichtsreacties
- invloed van temperatuur op de evenwichtsreacties
6.Bron






