Repeterende wekker
Filmfragment
1.Onderzoeksvraag
Hoe kunnen we een oscillerende reactie uitvoeren?
2.Voorbereiding
- zetmeeloplossing 1%
- vast malonzuur
- H2O2 30%
- aminosulfonzuur vast
- mangaansulfaat vast
- Natriumjodaat vast

3.Uitvoeren
a.Werkwijze
- Meet 10ml water af. Breng hierin een half spatelpunt natriumjodaat en een spatelpunt aminosulfonzuur. Los het geheel op.
- Breng in een ander bekertje 10ml H2O2 en spatelpunt malonzuur en een klein spatelpunt mangaansulfaat.
- Voeg hieraan 3 à 4 druppels zetmeeloplossing toe.
- Voeg de eerste oplossing nu bij de tweede. Bijna ogenblikkelijk gebeurt de oscillerende reactie.
b.Waarneming (+ foto’s)

4.Reflecteren
Een oscillerende reactie loopt in principe via volgende stappen
- Er is een beginreactie met effect 1;
- Er is een volgreactie met effect 2;
- De volgreactie gaat steeds sneller dankzij één van de producten van de beginreactie;
- De volgreactie gaat aan zijn succes ten onder doordat een beginproduct opraakt dat door de beginreactie gemaakt wordt;
- Een tijd lang loopt de beginreactie weer met effect 1 en
- met de productie van het voor de volgreactie benodigde beginproduct, waardoor de volgreactie weer zijn kans grijpt met effect 2; enzovoort.
De globale Briggs-Rauscher reactie
IO3 – + 2 H2O2 + CH2(CO2H)2 + H+ –> ICH(CO2H)2 + 2 O2 + 3 H2O
Deze reactie komt neer op een samenstelling van twee andere reacties (A en B)
(A) IO3 – + 2 H2O2 + H+ –> HIO + 2 O2 + 2 H2O
(B) HIO + CH2(CO2H)2 –> ICH(CO2H)2 + H2O
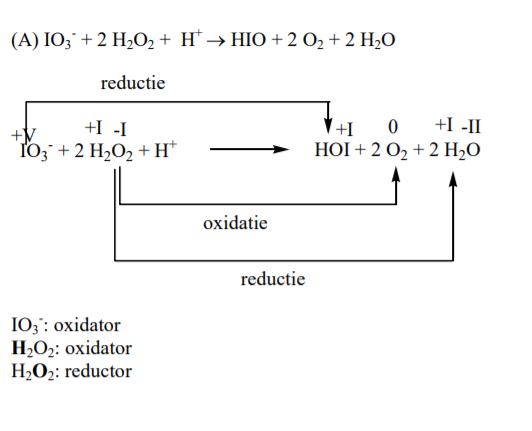
Reactie A kan plaatsvinden via twee verschillende processen (1 en 2), nl. een radicalair en een niet-radicalair proces.
Het radicalair proces (1) zal plaatsvinden wanneer de [I– ] laag is en het niet-radicalaire proces (2) zal optreden wanneer de [I– ] hoog is. (cfr. schema 1)
Reactie B bestaat uit twee deelreacties: I – + HIO + H+ –> I2 + H2O
I2 + CH2(CO2H)2 –> ICH2(CO2H)2 + H+ + I–
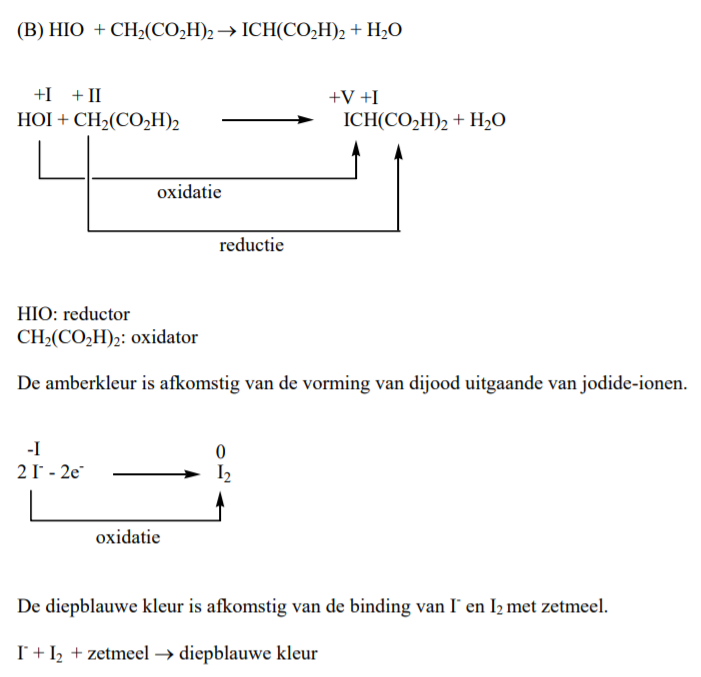
Tijdens het radicalair proces wordt HIO snel gevormd. Bovendien wordt het sneller gevormd dan het kan wegreageren. Dit maakt dat , volgens deelreactie 1 van B, veel [I– ] over blijft.
Deze I– kan geoxideerd worden tot I2 wat zorgt voor de amberkleur. De overige HIO wordt gereduceerd door H2O2 tot I– .
Deze stijgende I– concentratie zal vervolgens een punt bereiken waarop het niet-radicaal proces overneemt. Dit proces produceert nu niet zo snel HIO als in het radicalair proces waardoor de amberkleur begint te verdwijnen als I2 sneller wordt verbruikt dan gevormd.
De diepblauwe kleur is afkomstig van de binding van I– en I2 met zetmeel. Uiteindelijk zal de I- concentratie zo laag zijn zodat het radicaal proces terug overneemt en de cyclus herbegint. Een overzicht is weergegeven in schema 1.
5.Onderwerpen
- evenwichtsreacties
- oscillerende reactie
- werking van een katalysator






