pH afhankelijkheid van het evenwicht
Video: LINK
1.Onderzoeksvraag
Wat is de invloed van de pH op het chemisch evenwicht?
2.Voorbereiding
a. Materiaal + stoffen
- Bekerglas
- Pipet
- Roerstaaf
- Reageerbuisje
- Kopersulfaat pentahydraat
- Ammoniak
- Zwavelzuur
- Water
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
-
- Bereid 10 ml van een 0,01 mol/l kopersulfaatoplossing (m = 0,025g).
- Verdeel de kopersulfaatoplossing over 4
- Voeg enkele druppels ammoniakoplossing toe aan reageerbuis 2, 3 en 4 totdat de oplossing een blauwe kleur krijgt.
- Vervolgens wordt het zwavelzuur toegevoegd aan de 3e en 4e proefbuis tot de blauwe kleur verdwenen
- Wanneer de blauw kleur opnieuw verdwenen is, voeg je opnieuw ammoniak toe aan de laatste
b.Waarneming (+ foto’s)
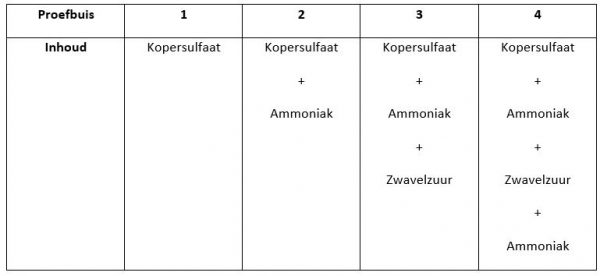
Wanneer we de kopersulfaatoplossing over de vier proefbuizen verdelen, zien we vier keer een doorzichtige oplossing

- De doorzichtige kopersulfaatoplossing in de 2e, 3e en 4e proefbuis wordt donkerblauw wanneer geconcentreerde ammoniakoplossing toegevoegd wordt.

Door zwavelzuur toe te voegen aan de 3e en de 4e proefbuis verkleurd de oplossing

De oplossing wordt opnieuw doorzichtig.
Wanneer we dan opnieuw ammoniak toevoegen aan de 4e proefbuis kleurt de oplossing opnieuw donkerblauw.

4.Reflecteren
Cu2+ + 4 NH3 <-> Cu(NH3)42+
H2SO4 + NH3 –> (NH4)2SO4






