Blauw knipperlicht
Filmfragment
1.Onderzoeksvraag
Hoe ontstaat het blauw knipperlicht?
2.Voorbereiding
- Luminol (C8H7N3O2): 0,015 gram
- Ged. water (H2O): 113 ml
- Kopersulfaat (CuSO4·5H2O): 0,010 gram
- Waterstofperoxide 30% (H2O2): 4 ml
- Kaliumthiocyanaat (KCNS): 0,44 gram
- Natronloog (1 mol/l NaOH): 3 ml
- Bekerglas 100 mL: 4
- Bekerglas of erlenmeyer 250 mL: 1
- Roerstaaf of roerder (facultatief)

3.Uitvoeren
a.Werkwijze
- Deze proef moet gedaan worden als het donker is of in een goed verduisterde ruimte.
- Doe in bekerglas 1: 10 mg kopersulfaat.
- In bekerglas 2: 440 mg kaliumthiocyanaat.
- In bekerglas 3: 15 mg luminol
- In bekerglas 4: 4 mL waterstofperoxide 30%.
- Voeg aan bekerglas 3 waarin al luminol zit, nog 3 mL 1 mol/l natronloog toe.
- Verwarm 113 mL water in de grote beker of erlenmeyer tot 70°C.
- Schenk in elk van de bekerglazen nu 28 ml van dit warme water.
- Zorg dat alles goed gemengd c.q. opgelost is.
- De grote beker (of erlenmeyer) is nu leeg. Zet deze op de roerder (als het kan ook verwarmingsplaat op 60°C), of blijf zelf in het vervolg roeren.
- Al roerend wordt de inhoud van de bekerglazen 1 t/m 3 in die volgorde in de grote gedaan
- Pak een zaklamp en doe het licht uit.
- Schenk nu ook de inhoud van bekerglas 4, het waterstofperoxide, bij het geheel.
- Het mengsel licht even stevig op, maar dooft meteen. Maar na circa een kwart minuut wordt het weer even helder blauw. Dit gaat zo minutenlang door: een blauw knipperlicht!
b.Waarneming (+ foto’s)

4.Reflecteren
Bij de luminol-oxidatiereactie werkt kopersulfaat als een katalysator. Wanneer opgelost in water, laat CuSO4 koperionen Cu2+ vrij, die dan als werkingscentra van de katalysator werken. Deze kationen kunnen één elektronvormende Cu + kationen accepteren: Cu2+ + e– → Cu+
En vice versa: Cu+ – e– → Cu2+
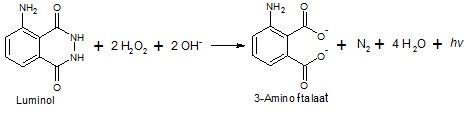
Dankzij dit vermogen katalyseren koperionen de luminoloxidatie, die luminescentie veroorzaakt. Hoe meer van deze ionen worden vrijgegeven, hoe actiever de reactie verloopt – dus de straling is bijzonder helder in de buurt van de stukjes kopersulfaat.
In dit experiment komen twee reacties tegelijkertijd voor.Oxidatie van luminol, wat leidt tot luminescentie van de vulkaan, en waterstofperoxide H2O2-ontleding beïnvloed door kopersulfaat CuSO4. Ontleding van waterstofperoxide verloopt veel effectiever in de buurt van de stukjes CuSO4 die voldoende tijd hebben om lichtjes in water op te lossen. Daarom zijn er veel Cu2+ ionen, die verantwoordelijk zijn voor de afbraak van H2O2, beschikbaar rond deze stukjes in de oplossing. De ontbinding zelf verloopt volgens een vrij eenvoudige reactie: 2H2O2 → 2H2O + O2 (gas) Zo wordt zuurstof verkregen, een van de twee hoofdcomponenten van lucht. Gasbellen worden verzameld rond de kopersulfaatstukken, waar de reactie bijzonder intensief is, waardoor de bellen uit de oplossing springen. Omdat de luminol-oxidatiereactie tegelijkertijd plaatsvindt, wordt de show vergezeld door een mooie blauwe gloed. Een specifieke omgeving in de oplossing moet worden gehandhaafd voor waterstofperoxide, H2O2 om luminol te oxideren. Deze omgeving kan worden gecreëerd met natriumcarbonaat Na2CO3. Zonder dit gebeurt alleen gasontwikkeling, zonder gloeiing.
In het oxidatieproces transformeert de luminol-molecule in een ion 3-aminohydrophthalate. Dit ion is in geëxciteerde toestand is, wat betekent dat het buitensporige energie draagt die overblijft na de reactie.
5.Onderwerpen
- luminescentie
- oscillerende reactie
- redoxreactie
- werking van een katalysator
6.Bron






