Ipaldles Fotometrie en Vlamproeven
Experiment Bohr
Onderzoeksvraag:
Welke verschillende kleuren verkrijg je bij het toevoegen van energie aan stoffen?
Ondertussen weet je al hoe het atoommodel van Bohr is opgebouwd. Ter verfrissing kan je je even baseren op de bijhorende afbeelding
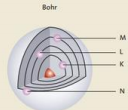
Hypothese
Welke verschillende kleuren kan je te bekomen bij het verhitten van verschillende stoffen?
Uitvoering
Benodigdheden
- Bunsenbrander
- Labojas
- Veilgheidsbril
- Spuitflesjes met verschillende zoutoplossingen (BaCl2, CaCl2, NaCl)
- Ipad
- Computer
Werkwijze
- Taakverdeling: Iemand trekt de labo-jas aan en zet zijn veiligheidsbril op. Iemand anders ontgrendeld de Ipad en zal ook met de Ipad werken.
- Open de app ‘colorpicker’.

- Sluit de bunsenbrander correct aan en laat controleren
- Ontsteek de bunsenbrander en spuit een beetje oplossing in de vlam. De andere leerling neemt nu de Ipad en gebruikt de app om de kleur in beeld te brengen en maakt er een screenschot van.
- Herhaal de vorige stap voor alle andere oplossingen. Noteer hieronder de kleur van de vlam:

- Ga vervolgens naar een website met deze QR-code en vul de RGB-codes van de verschillende vlammen in.
- Je zal zien dat je de kleur van de vlam exact kunt bepalen met je gegevens en deze site.
- Vergelijk de bekomen kleuren van de site met de kleur die je hebt waargenomen.

Waarneming
Welke verschillende kleuren heb je waargenomen?
Kwamen de kleuren die je op de website had ingevuld overeen met de kleur die je genoteerd had bij je eerste waarneming?
Besluit
Welke kleuren van vlammen hebben we verkregen? Hoe verkrijgen we deze kleuren?
http://www.efg2.com/Lab/ScienceAndEngineering/Spectra.htm
Experiment dosering kopersulfaat/rode oplossing
https://www.youtube.com/watch?v=LzYhyXYcs0M


Gebruikte APP:
https://itunes.apple.com/us/app/colorometer/id509865412?mt=8
Bron Experiment: http://www.scienceinschool.org/content/smartphones-lab-how-deep-your-blue
App: https://itunes.apple.com/nl/app/colorassist-freeedition/id495034867?mt=8
Materiaal:
- 30 g kopernitraattrihydraat (Cu(NO3)2∙3H2O)
- gedestilleerd water
- 3 maatkolfjes van 100 ml
Uitvoering:
- Label de 3 maatkolfjes.
- Weeg respectievelijk 5, 10 en 15 g Cu(NO3)2∙3H2O en noteer de exacte massa’s m1, m2 en m3 van de zuivere koper in elk kolfje.
- Leng aan tot de maatstreepjes.
Meten van de H-waarden met een smartphone
Materiaal:
-Gebruik het aangegeven programma
-Wit papier
-potlood
Uitvoering

- Zet het eerste staal op het witte papier wat ook de verticale achtergrond wordt en duid aan wat de exacte positie is van het kolfje.
- Zet de smartphone zo dat het centrum van de camera gericht is op het langste deel van de maatkolf. De afstand tussen de achtergrond en de kolf bedraagt ongeveer 4cm en tussen de smartphone en de kolf ongeveer 14 cm.
- Gebruik de app en lees de H-waarde af van de HSV/HSL en noteer.
- Herhaal het voorgaande met dezelfde opstellingen Grafiek
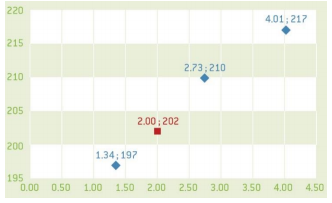
- Gebruik deze waarden voor de stalen en zet m1, m2, m3 uit in fuctie van H-waarde. Deze H-waarde is evenredig met de concentratie koper in de oplossing. Gebruik deze curve om de massa koper in het onbekende staal te bepalen.






