Ipadles Ionbindingen en ionenroosters
Om op onderstaande vraag een antwoord te kunnen geven, gaan we beginnen met enkele voorbeelden.
Wat zijn ionen?
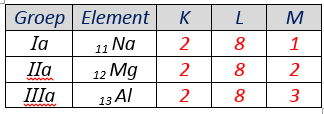
Vul de elektronenconfiguraties aan van onderstaande elementen.
Omcirkel het juiste antwoord.
Na, Mg en Al uit bovenstaande tabel zijn allen METALEN / NIET-METALEN.
Die drie elementen zijn niet stabiel omdat ze geen edelgasconfiguratie bezitten. Ze hebben namelijk slechts enkele elektronen op hun buitenste schil zitten.
Hoe kunnen Na, Mg en Al toch aan een edelgasconfiguratie (8 e– op de buitenste schil) raken?
Duidt de optie aan die het minste energie vereist.
Na, Mg en Al bekomen de edelgasconfiguratie door: HET TEKORT AAN ELEKTRONEN OP DE M-SCHIL OP TE NEMEN / HET TEVEEL AAN ELEKTRONEN OP DE M-SCHIL AF TE GEVEN.
Conclusie:
Omcirkel het correcte antwoord.
Na zal 1 e– OPNEMEN / AFGEVEN.
het afgeven van 1 e– vereist minder energie dan het opnemen van 7 e–.
Mg zal 2 e– OPNEMEN /AFGEVEN.
het afgeven van 2 e– vereist minder energie dan het opnemen van 6 e–.
Al zal 3 e– OPNEMEN / AFGEVEN.
het afgeven van 3 e– vereist minder energie dan het opnemen van 5 e–.

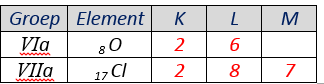
Vul de elektronenconfiguraties aan van onderstaande elementen
Omcirkel het juiste antwoord.
O en Cl uit bovenstaande tabel zijn beiden METALEN / NIET-METALEN.
Wat valt op als je hier de aantallen valentie elektronen (elektronen op de buitenste bezette schil) vergelijkt met de aantallen die we gezien hebben bij de metalen (Na, Mg en Al)?
Duid het teken aan dat het juiste verband aantoont.
Aantal valentie e– bij metalen ![]() aantal valentie e– bij niet-metalen.
aantal valentie e– bij niet-metalen.
Omcirkel het juiste antwoord.
Als gevolg hiervan zullen niet-metalen de edelgasconfiguratie bekomen door elektronen AF TE GEVEN / OP TE NEMEN.

Na (metaal) wordt na de afgifte van 1 e– een positief geladen deeltje.
Verklaar:
Doordat er een negatief deeltje verdwijnt, zijn er netto meer positieve dan negatieve deeltjes.
Cl (niet-metaal) wordt na opname van 1 e– een negatief geladen deeltje.
Verklaar:
Doordat er een negatief deeltje bijkomt, zijn er netto minder positieve dan negatieve deeltjes.
atomen zijn elektrisch neutraal: aantal protonen (+) = aantal elektronen (-)
Nu ben je in staat om een antwoord te formuleren op nevenstaande vraag.

Antwoord: Ionen zijn geladen atomen
Antwoord: Ionen ontstaan door de opname of afgifte van elektronen.
Open de app ‘’Chem Pro’’

Je krijgt onderstaand beginscherm
Klik links op ‘’3 Ionic Compounds’’
Start het filmpje door op de ´´Play/Pause’’ knop te duwen. (Je kan het filmpje ook pauzeren door opnieuw op deze knop te duwen)
Bekijk het filmpje vanaf het begin (0:00) tot aan 0:52 en antwoord daarna op onderstaande vragen.
Doorspoelen in het filmpje kan door het witte bolletje te verslepen.
Je kan het filmpje op volledig scherm weergeven door op de pijltjes rechts te duwen. (volledig scherm verlaten, doe je door opnieuw op dezelfde knop te duwen)
Wat is een synoniem voor de positieve ionen die gevormd worden wanneer metalen één of meerdere elektronen afgeven?
Wat is een synoniem voor de negatieve ionen die gevormd worden wanneer niet-metalen één of meerdere elektronen opnemen?
We kunnen ionen symbolisch weergeven. In het filmpje werden hiervan enkele voorbeelden getoond.
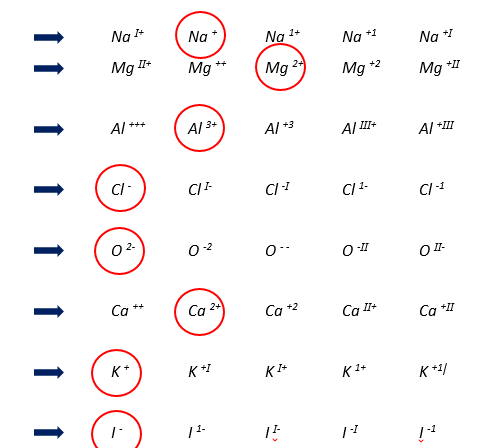
In onderstaande rijtjes is telkens slechts één schrijfwijze correct, omcirkel de juiste.
Rangschik onderstaande onderdelen in de juiste volgorde door de bijhorende letters in de juiste volgorde op de lijntjes te plaatsen. (Vb: D E F )
Zie voorgaande oefening en filmpje.
A. Aantal opgenomen/afgegeven elektronen
B.Symbool van het element
C.Ladingsteken
B A C
Op deze manier kan je alle mono-atomische ionen (ionen die uit slechts 1 element bestaan) symbolisch weergeven.
Ga opnieuw naar het filmpje in de app ‘’Chem Pro’’ en bekijk dit keer vanaf 1:20 tot 2:30.

Verbindoefening: (Verbind een beschrijving uit de linkerkolom met het juiste type ion uit de rechterkolom)
Elementen uit groep 2 Vormt/vormen 1- ionen
Elementen uit groep 1 Vormt/vormen 1+ ionen
O en S Vormt/vormen 3+ ionen
Elementen uit groep 7 Vormt/vormen 2+ ionen
Al Vormt/vormen 2- ionen
Open de app ‘’Element Matching’’

Je krijgt onderstaand beginscherm

Druk op ‘’What’s My Charge?’’ Je krijgt volgend scherm.
Ken aan alle elementen de juiste lading toe totdat je score 30 hebt behaald.
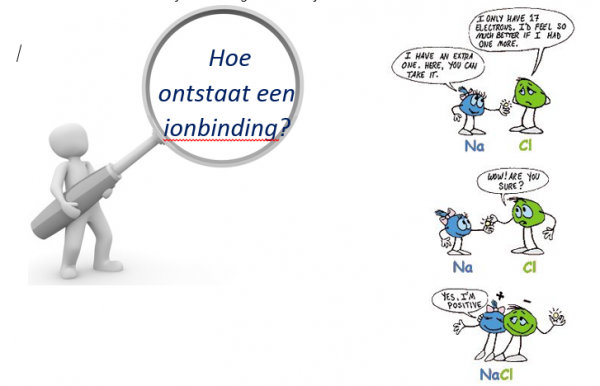
In bovenstaande afbeelding zie je wat er gebeurt tijdens de vorming van een ionbinding.

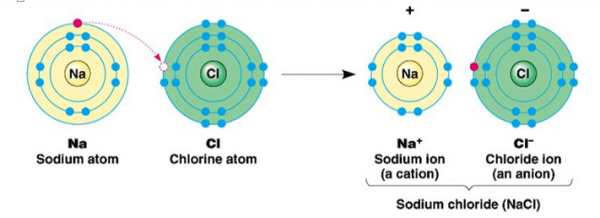
Wat gebeurt in onderstaande afbeelding? Vul onderstaande tekst aan met ‘’Na’’ of ‘’Cl’’.
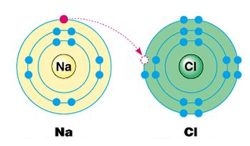
Na geeft 1 e– af aan Cl . Hierdoor heeft Na 1 e– minder dan voorheen en Cl 1 e- meer. Cl is nu dus negatief geladen en Na is positief geladen.
Dit positieve en negatieve ion blijven bij elkaar en vormen de ionbinding!
Omcirkel het juiste.
Uiteraard, want TEGENGESTELDE / GELIJKE ladingen trekken elkaar aan.
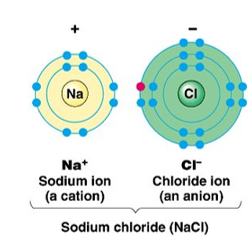
We kunnen zulke ionbindingen ook schematisch noteren

Formuleer nu in eigen woorden een antwoord op nevenstaande vraag

Antwoord:
Door een elektronenoverdracht tussen een metaal en een niet-metaalatoom. Het gevormde positieve ion en het negatieve ion trekken elkaar aan en blijven samen.


Open de app ‘’Arloon Chemistry’’

Je krijgt onderstaand scherm.Volg onderstaande richtlijnen.
Na het volgen van bovenstaande stappen bekom je opnieuw het ionrooster van NaCl.
Beantwoord!
Door hoeveel Cl – – ionen wordt elk Na + – ion in het ionrooster omgeven?






