H11 – Film: eigen oefeningen
-
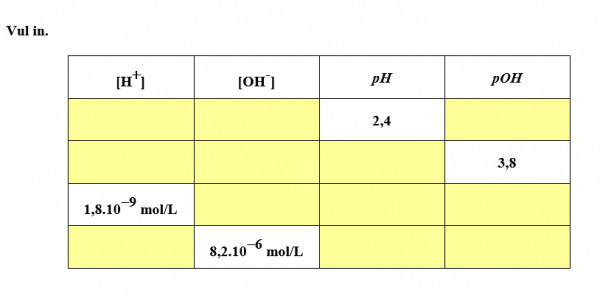
pH berekenen: [H+], [OH–], pH en pOH
1.
-
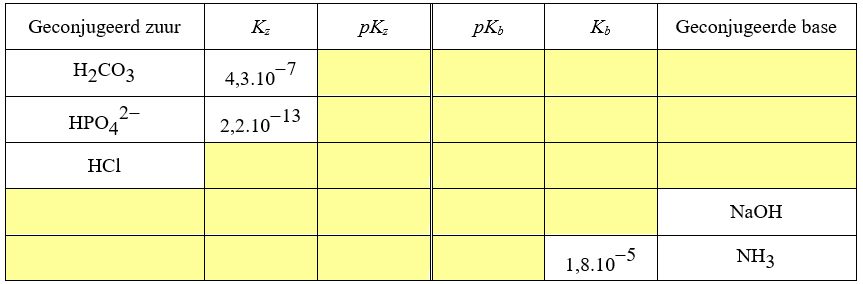
Kz, Kb, pKz, pKb
-
pH sterk zuur
pH sterke base
pH zwak zuur
- Bereken de pH van volgende oplossingen:H2S 0,1 mol/
- Bereken de pH van volgende oplossingen: HAc 0,10 mol/L
pH zwakke base
pH van een mengsel
- Bereken de pH van volgende oplossing: HNO3 0,10 mol/L + HF 0,20 mol/L
- Bereken de pH van volgende oplossingen: 1 L oplossing die 10,00 g KOH en 10,00 g Ca(OH)2 bevat
- Bereken de pH van volgende oplossingen: NH3 0,12 mol/L + NaOH 0,24 mol/L
- Bereken de pH van volgende oplossingen: H2SO4 0,010 mol/L + HCl 0,010 mol/L
- Bereken de pH van volgende oplossingen: HNO2 0,020 mol/L + HCN 0,040 mol/L
- Bereken de pH van volgende oplossingen. HCOOH 0,15 mol/L + CH3COOH 0,25 mol/L
pH zouten
- Bereken de pH van volgende oplossing: K2CO3 1,500 g / 100 mL
- Bereken de pH van volgende oplossing: NH4Ac 0,100 mol/L
- Bereken de pH van volgende oplossing: C6H5COONa 0,080 mol/L
- Bereken de pH van volgende oplossing: NH4F 0,100 mol/L
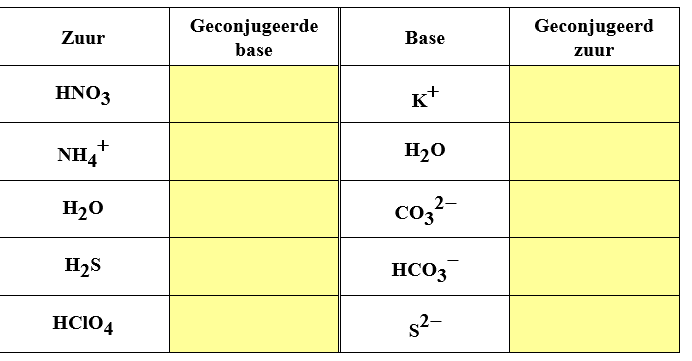
Zuurbase koppels
3.Schrijf de protolysereactie van volgende zuren:

4. Schrijf de protolysereactie van volgende basen:

Zuur-basegedrag zouten
pH van amfolyten
- Bereken de pH van de volgende oplossingen en mengsels: 100 ml NaHCO3 0,100 mol/l
- Bereken de pH van volgende oplossingen en mengsels: 100 ml Na2CO3 0,200 mol/l met 40 ml HCl 0,500 mol/l
- Bereken de pH van volgend mengsel: 100 ml Na2HPO4 0,200 mol/l met 200 ml 0,100 mol/l HCl
- Bereken de pH van 200 ml 0,0800 mol/l H2CO3
- Bereken de pH van het volgend mengsel: 250 ml Na2CO3 0,200 mol/l met 150 ml NaHCO3 0,300 mol/l
- Bereken de pH van het mengsel 20,0 ml 0,100 mol/l H3PO4 en 20 ml 0;250 mol/l NaOH
Buffers
- Bereken de pH van volgende buffer: 24,560 g HCN en 32,816 g KCN in 500 mL oplossing
- Bereken de pH van volgende buffer: 0,125 mol NaH2PO4 en 0,210 mol K2HPO4 in 1 L oplossing
- Bereken de pH van volgende buffer: mengsel van 250 mL NH3 2,12 mol/L en 500 mL NH4Cl 1,78 mol/L
- Hoeveel gram ammoniumchloride moet je bij een halve liter NH3 0,1 mol/L voegen om een buffer met pH 9,00 te bekomen? (volumetoename mag verwaarloosd worden)
- Je wenst 2 L HCOOH/HCOONa-buffermengsel te maken met pH = 4. Je beschikt over 30,000 g Hoeveel mL HCOOH-oplossing 2 mol/L heb je nodig?
- Bereken de pH als je aan de buffer uit oefening 16 toevoegt: 25 druppels HNO3 0,5 mol/L (1 druppel = 0,05 mL)
- Bereken de pH als je aan de buffer uit oefening 16 toevoegt: een korreltje KOH met massa 0,612 g
- Bereken de pH als je aan de buffer uit oefening 17 toevoegt: 12 mL H2SO4 0,20 mol/L
- Bereken de pH als je aan de buffer uit oefening 17 toevoegt: 1 g Ca(OH)2
- Bereken de pH als je aan de buffer uit oefening 17 toevoegt: 10,000 g HCOONa
Titratiecurven
- Geef de titratiecurve van 25,00 ml 0,10 mol/l zoutzuur dat getitreerd wordt met 0,10 mol/l NaOH-oplossing.
- Geef de titratiecurven van 25,00 ml 0,10 ml CH3COOH dat getitreerd wordt met 0,100 mol/l NaOH (Na+ + OH–)
- Bij de titratie van 25 mL HAc-oplossing wordt het equivalentiepunt bereikt na toevoegen van 30 mL NaOH-oplossing 0,110 mol/L. Bereken de concentratie van de azijnzuuroplossing
- Bij de titratie van 25 mL HAc-oplossing wordt het equivalentiepunt bereikt na toevoegen van 30 mL NaOH-oplossing 0,110 mol/L. Hoe groot is de pH tijdens de titratie na toevoegen van 15 mL NaOH 0,110 mol/L?
- Bij de titratie van 25 mL HAc-oplossing wordt het equivalentiepunt bereikt na toevoegen van 30 mL NaOH-oplossing 0,110 mol/L. Hoe groot is de pH als we 50 ml NaOH 0,110 mol/L hebben toegevoegd?
- In een erlenmeyer bevindt zich 25,0 mL HAc 0,1 mol/L. Uit een buret voegen we NaOH 0,1 mol/L toe. Bereken de pH na toevoegen van 10 mL uit de buret.
- In een erlenmeyer bevindt zich 25,0 mL HAc 0,1 mol/L. Uit een buret voegen we NaOH 0,1 mol/L toe. Bereken de pH na toevoegen van 25 mL uit de buret.
- In een erlenmeyer bevindt zich 25,0 mL HAc 0,1 mol/L. Uit een buret voegen we NaOH 0,1 mol/L toe. Bereken de pH na toevoegen van 30 mL uit de buret.
Titratieberekeningen
- Je voert een titratie uit. Je gaat onderzoeken wat de concentratie zoutzuur in een onbekende oplossing is. Hiervoor verdun je de oplossing eerst 20 keer en de je daarvan 10,0 ml in de erlenmeyer. Vervolgens ga je dit titreren met 0,215 mol/l natronloog. Je blijkt 7,15 ml natronloog nodig te hebben. Bereken de concentratie zoutzuur in mol/l
- 20 mL KOH 0,02 mol/L wordt getitreerd met 28,2 mL HNO3. Bereken de concentratie van deze
- Men lengt 10 mL geconcentreerd H2SO4 aan tot 1 L. 20 mL van deze oplossing wordt getitreerd met NaOH 0,2 mol/L. Het equivalentiepunt wordt bereikt na toevoegen van 36,2 mL. Bereken de concentratie van het geconcentreerde H2SO4.