H6 – Film: toelatingsexamen
Bron: Examenvragen – Toelatingsexamen arts & tandarts (toelatingsexamenartstandarts.be)
Bron: Ijkingsproeven HOME – IJkingstoets.be
- Een ernstig magnesiumtekort kan bij volwassenen worden behandeld door dagelijkse intraveneuze toediening van 2,4 g MgSO4 in 1,00 L van een glucose-oplossing. Hoeveel mmol Mg2+ wordt op die manier dagelijks toegediend?
2. De samenstelling van een oplossing wordt in volgende tabel weergegeven:
| Ionsoort | Na+ | Mg2+ | Al3+ | NO3– | Cl– |
| Hoeveelheid (mol) | 0,40 | 0,10 | 0,20 | 0,30 | ? |
Wat is de hoeveelheid chloride-ionen in deze oplossing?
4. Een oplossing van waterstofperoxide (H2O2) kan gebruikt worden als ontsmettingsmiddel.
2 MnO4–(aq) + 5 H2O2 (aq) + 6 H+ (aq) –> 2 Mn2+(aq) + 5 O2 (g) + 8 H2O (l)
35,0 mL van een aangezuurde KMnO4-oplossing met concentratie 0,100 mol.L-1 zijn nodig om al het waterstofperoxide te laten wegreageren in 50,0 mL ontsmettingsmiddel. Wat is de concentratie van waterstofperoxide in dit ontsmettingsmiddel?
5. Gegeven is volgende evenwichtsvergelijking:
SO2 (g) + NO2 (g) ⇌ SO3 (g) + NO (g) met Kc = 3,0 bij 450 °C
Welke hoeveelheid SO2 (g) moet toegevoegd worden aan 6,0 mol NO2 (g) om in het evenwichtsmengsel bij 450 °C 3,0 mol NO (g) te bekomen?
6. 5,0.10-4 mol van een metaalchloride wordt opgelost in water. Er is 60 mL van een 2,5.10-2 mol.L-1 zilvernitraatoplossing nodig om alle chloride- ionen neer te slaan onder de vorm van zilverchloride. Wat is de formule van het metaalchloride waarin M het symbool van het metaal voorstelt?
7. Een koolwaterstof met een normaal kookpunt van 174 °C heeft bij 227 °C en 1000 hPa een dichtheid van 3,42 g.L-1. Hoeveel bedraagt de molaire massa van deze stof?
8. Men voegt 1,00 mol HCl toe aan 1,00 mol Al2O3 waardoor AlCl3 en water worden gevormd. Welke hoeveelheid Al2O3 blijft over na deze reactie?
9. Aan gelijke massa’s van de hierna gegeven stoffen wordt telkens een HCl- oplossing in overmaat toegevoegd. Met welke stof wordt het grootste aantal mol CO2 gevormd?
Bij een bepaalde temperatuur T stelt zich in de gasfase volgend evenwicht in:
2 SO3 (g) ⇌ 2 SO2 (g) + O2 (g) .
Bij dat evenwicht bedraagt de hoeveelheid zuurstofgas een vierde van de oorspronkelijke hoeveelheid zwaveltrioxide. Wat is de waarde van de evenwichtsconstante Kc voor dit evenwicht bij temperatuur T?
| <A> | 0,40 |
| <B> | 0,35 |
| <C> | 0,25 |
| <D> | 0,20 |
11. 120 g van een bepaald gas neemt bij 27°C en 1000 hPa een volume in van 75,0 L. Welk gas is dit?
Fe(s) + 2 HCl(aq–> FeCl2(aq) + H2(g)

- <A> NaHCO3(s) –> NaOH(s)+ CO2(g)
- <B> 2NaHCO3(s) –> Na2O2(s)+ CO2(g) + HCOOH(g)
- <C> 2NaHCO3(s) –> Na2O(s)+ 2CO2(g) + H2O(g)
- <D> 2NaHCO3(s) –> Na2CO3(s)+ CO2(g) + H2O(g)
Welke massa KI is opgelost in 500 mL van een 15,0 massaprocent KI-oplossing?
2 Ca3(PO4)2 + 6 SiO2 + 10 C –> 6 CaSiO3 + 10 CO + P4
17. Men brengt 1,0 mol Cu in 200 mL H2SO4-oplossing met c = 6,0 mol L-1. Door verwarming van dit mengsel wordt er SO2-gas gevormd volgens de aflopende reactie:
Cu (s) + 2 H2SO4 (aq) –> CuSO4(aq) + SO2 (g) + 2 H2O (I)
Welke hoeveelheden SO2 wordt er gevormd?
21. X2 en Y worden gemengd en reageren tot XY volgens onderstaande reactie:
Welke van volgende beweringen is waar?
- a. In deze reactie is reagens Y altijd in
- b. Als je 1 mol X2 en 1 mol Y mengt, kan er 2 mol XY gevormd
- c. Als X2 en Y gemengd worden, reageert X2 altijd volledig
- d. Als je 1 mol X2 en 1 mol Y mengt, kan er 1 mol XY gevormd
22. Welk van onderstaande oplossingen heeft de hoogste molaire concentratie?
- a. 100 ml van een oplossing die 0,2 mol NaOH
- b. 200 ml van een oplossing die 20 g NaOH bevat
- c. 200 ml van een oplossing die 0,4 mol NaOH bevat
- d. 100 ml van een oplossing die 4 g NaOH bevat
23. Welk volume van 12,0 mol/l HCl oplossing is er nodig voor het maken van 16,0 l 0.250 mol/l HCl?
24. Welke van de volgende natriumverbindingen heeft het laagste massaprocent natrium?
3 Cu + 8 HNO3 –> 3 Cu(NO3)2 + 2 NO + 4 H2O
- Salpeterzuur was in overmaat aanwezig bij de reactie
- Koper was het limiterend/beperkend reagens
- Er was net genoeg koper om de reactie uit te voeren
- Salpeterzuur was het limiterend reagens
27. Bij de fotosynthesereactie zetten planten anorganische stoffen zoals water en koolstofdioxide met behulp van
zonne-energie om in glucose. Hierbij komt er ook zuurstofgas vrij.
6H2O + 6CO2 –> C6H12O6 + 6O2
Hoeveel mol glucose en zuurstof kan er samen gevormd worden wanneer 18mol koolstofdioxide wegreageert
tijdens de fotosynthese?
(A) 7mol (B) 18mol (C) 19mol (D) 21mol
28. Hoeveel mol waterstof bevindt zich in 6,8 g ammoniumsulfide (NH4)2S?
(A) 0,10mol (B) 0,20mol (C) 0,40mol (D) 0,80mol
29. Aan 100mL van een 2,00mol/L Na2SO4-oplossing voeg je 50,0mL van een 1,00mol/L NaCl-oplossing toe. Daarna
leng je aan met water tot een totaalvolume van 0,500 L. Hoeveel bedraagt de concentratie van de natriumionen?
(A) 0,250mol/L
(B) 0,450mol/L
(C) 0,500mol/L
NH3 en 20 g O2 bevat, hoeveel NO kan er dan maximaal gevormd worden?
32. Het Haber-Boschproces is het meest gebruikte proces voor de chemische synthese van ammoniak (NH3).
Hierbij wordt een zuurstofvrij gasmengsel van stikstofgas (N2) en waterstofgas (H2) in contact gebracht met
een katalysator, in de vorm van deeltjes vaste ijzer, en onder hoge druk verhit. Dit verloopt volgens de
ongebalanceerde reactie:
N2 + H2 → NH3
Je wil 34,0 g ammoniak produceren door waterstofgas en stikstofgas te laten reageren.
Wat is dan de benodigde massa aan waterstofgas om 34,0 g ammoniak te produceren?
(A) 4 g
(B) 6 g
(C) 12 g
(D) 14 g
33. Het aanplanten van nieuw bos remt de klimaatopwarming af doordat bomen koolstofdioxide (CO2) vastleggen
door middel van fotosynthese. Dit verloopt via de ongebalanceerde reactie:
CO2 + H2O → C6H12O6 + O2
Hoeveel ton glucose (C6H12O6) moet geproduceerd worden door het nieuwe bos om 10 000 ton CO2 vast te
leggen?
(A) minder dan 103 ton
(B) tussen 103 en 106 ton
(C) tussen 106 en 109ton
(D) meer dan 109 ton
34. Beschouw twee containers met gelijk volume die gevuld zijn met gelijke massa’s van respectievelijk heliumgas
(He) en stikstofgas (N2). Beide gassen ondervinden dezelfde druk en verder kennen we de atoommassa’s van
helium en stikstof: M(He) = 4,0026 en M(N) = 14,007. Hoe verhoudt de temperatuur van helium (Thelium)
zich ten opzichte van de temperatuur van stikstof (Tstikstof)?
(A) Thelium < Tstikstof
(B) Thelium = Tstikstof
(C) Thelium > Tstikstof
(D) Je kan hier geen uitspraak over doen door een gebrek aan gegevens.
35. In vuurwerk wordt vaak buskruit gebruikt, dat bestaat uit zwavel (S), houtskool (bestaat voornamelijk uit
koolstof (C), maar bevat eveneens de noodzakelijke katalysator potas (K2CO3)) en salpeter of kaliumnitraat
(KNO3). Hierbij is het kaliumnitraat de zuurstofleverancier. Indien een krachtiger oxidator gewenst is
om het vuurwerk harder te laten knallen, wordt kaliumnitraat vervangen door kaliumchloraat (KClO3) en
verloopt dit via de ongebalanceerde reactie
KClO3 → KCl + O2
Je wil 6,0 g zuurstofgas (O2) produceren uit kaliumchloraat. Welke massa kaliumchloraat is dan nodig om
de vooropgestelde massa zuurstofgas te produceren?
(A) 15,3 g
(B) 18,4 g
(C) 21,0 g
(D) 23,0 g
36. Je bent verantwoordelijk voor de productie-eenheid van een aluminiumfabriek. Deze week wens je met je
team 17500 kg zuiver aluminium te produceren. Hierbij maak je gebruik van bauxiet, een aluminiumrijk
erts dat o.a. ontgonnen wordt in China. Om aluminium te verkrijgen wordt bauxieterts in een eerste
stap verwerkt tot aluinaarde (Al2O3). In een tweede stap wordt aluminium uit Al2O3 gesmolten via de
ongebalanceerde reactie:
Al2O3 → Al + O2 .
Tijdens de eerste stap wordt gemiddeld 60% rendement behaald, wat betekent dat je 60 kg Al2O3 per 100 kg
bauxieterts kan winnen. Hoeveel ton bauxieterts moet je als verantwoordelijke aankopen opdat de productie
van 17500 kg aluminium in je fabriek kan doorgaan?
(A) 20 ton
(B) 40 ton
(C) 55 ton
(D) 110 ton
37. In het internationaal ruimtestation (ISS) dient de uitgeademde CO2 te worden verwijderd voor de aanwezige
hoeveelheden giftig worden. Dit gebeurt door CO2 om te zetten in Li2CO3 en water door middel van LiOH:
CO2 + 2 LiOH −−→ Li2CO3 + H2O
Hoeveel gram Li2CO3 wordt er geproduceerd indien er initieel 1, 3 kg CO2 en 1, 35 kg LiOH aanwezig is?
(A) 4, 4 · 10² g (B) 2, 1 · 10³ g (C) 4, 2 · 10³ g (D) 2, 2 · 104 g
38. Welke hoeveelheid stof bevat het grootste aantal atomen?
(A) 36 gram koolstof (C)
(B) 2 mol zuurstofgas (O2)
(C) 18 gram water
(D) 0,5 mol zwavelzuur (H2SO4)
39. Eziclen® is een sterk laxerend geneesmiddel. De werkzame stoffen zijn drie zouten:
natriumsulfaat (Na2SO4), magnesiumsulfaat (MgSO4) en kaliumsulfaat (K2SO4).
Eén zakje Eziclen® bevat 0,125 mol Na2SO4, 0,018 mol K2SO4 en 0,013 mol MgSO4.
Wanneer dit zakje opgelost wordt in 1,00 L water, wat is de concentratie in mol/L aan natrium en sulfaationen in deze oplossing dan ?
(A) 0,125 mol/L Na+ en 0,156 mol/L SO42- ି
(B) 0,125 mol/L Na+ en 0,513 mol/L SO42-
(C) 0,250 mol/L Na+ en 0,156 mol/L SO42-
(D) 0,250 mol/L Na+ en 0,513 mol/L SO42-
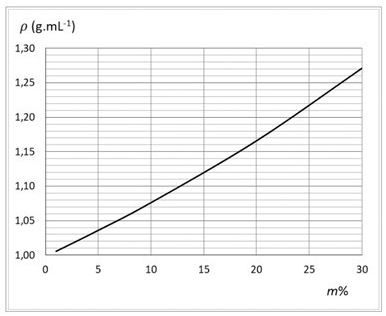
40. Een zuuroplossing met een concentratie van 12,0 mol.L-1 heeft een massapercentage van 75,0 % en een dichtheid van 1,57 g.mL1
Welk zuur is aanwezig in de oplossing?
- a. CH3COOH (M = 60,1 g/mol)
- b. H3PO4 (M = 98,1 g/mol)
- c. HCl (M = 36,5 g/mol)
- d. HBr (M = 80,9 g/mol)
45. Gegeven is de reactie 2 AgNO3 + CaCl2 → 2 AgCl + Ca(NO3)2
- a. Zilvernitraat is het beperkend (limiterend) reagens en calciumnitraat slaat neer.
- b. Zilvernitraat is het beperkend (limiterend) reagens en zilverchloride slaat neer.
- c. Calciumchloride is het beperkend (limiterend) reagens en calciumnitraat slaat neer.
- d. Calciumchloride is het beperkend (limiterend) reagens en zilverchloride slaat neer
48. Hoeveel mol waterstofatomen zijn er in 7,45 g ammoniumfosfaat?
51. Welke van de volgende oplossingen bevat het grootste aantal natriumionen?
- a. 500 mL NaNO3-oplossing met c = 0,012 mol.L-1
- b. 200 mL Na2CO3-oplossing met c = 0,020 mol.L -1
- c. 300 mL NaCl-oplossing met c = 0,010 mol.L -1
- d. 250 mL Na2SO4-oplossing met c = 0,010 mol.L -1