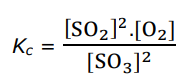H15 – Film: toelatingsexamen
Bron: Examenvragen – Toelatingsexamen arts & tandarts (toelatingsexamenartstandarts.be)
Bron: Ijkingsproeven HOME – IJkingstoets.be
- Het volume is verkleind bij constante temperatuur
- NO werd toegevoegd bij constante temperatuur en volume
- De temperatuur is verlaagd bij constant volume
- Het volume is vergroot bij constante temperatuur.
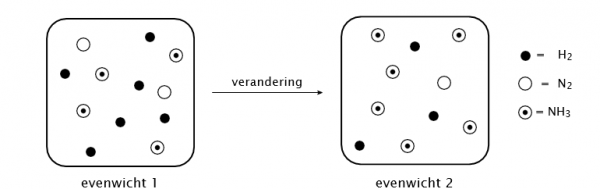
3 H2 (g) + N2 (g) <–> 2 NH3 (g)
Welke verandering werd er aan evenwicht 1 aangebracht om vervolgens evenwichtstoestand 2 te bekomen?
- b. PCl5(g) + warmte ⇌ PCl3(g) + Cl2(g)
- c. 2 SO2(g) + O2(g) ⇌ 2 SO3(g) + warmte
- d. CO(g) + H2O(g) ⇌ CO2(g) + H2(g) + warmte
4. In een gesloten reactievat van 1,0 liter brengen we bij 100 °C 1,0 mol NO2 en 1,0 mol N2O4.
Welke geldige bewering in verband met de evenwichtsconcentraties volgt uit deze gegevens?
- a. Het vergroten van het volume bij constante temperatuur.
- b. Het toevoegen van H2(g) bij constant volume en constante temperatuur.
- c. Het afkoelen van het reactievat bij constant volume.
- d. Het toevoegen van C(v) bij constant volume en constante temperatuur
Welke van deze beweringen is/zijn juist?
- a. Kryptongas aan het reactievat toevoegen zonder dat het volume van het reactievat hierdoor gewijzigd wordt.
- b. Een gedeelte van de evenwichtshoeveelheid chloorgas verwijderen uit het reactievat.
- c. Het reactievat afkoelen zonder dat het volume van het reactievat hierdoor gewijzigd wordt.
- d. Het volume van het reactievat driemaal groter maken waarbij de temperatuur van het reactiemengsel constant blijft.
8. In een leeg reactievat worden gelijke molhoeveelheden SO2 (g) en SO3 (g) gebracht.
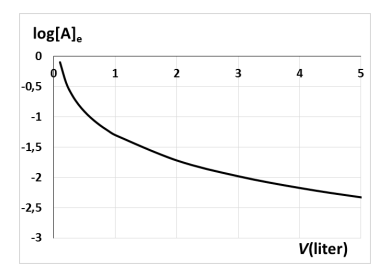
9. In onderstaande grafieken wordt de (logaritme van de) evenwichtsconcentratie van stof A weergegeven:
a) in functie van het volume van het reactievat bij constante temperatuur;
b) in functie van de temperatuur bij constant volume van het reactievat
Met welke evenwichtsreactie zijn deze beide grafieken in overeenstemming?
- a. A (g) + warmte ⇌ B (g) + C (g)
- b. A (g) ⇌ B (g) + C (g) + warmte
- c. A (g) + B (g) + warmte ⇌ C (g)
- d. A (g) + B (g) ⇌ C (g) + warmte
10. Een leeg reactievat met constant volume van 1,0 L werd gevuld met N2O4.