H11 – Film: toelatingsexamen
Bron: Examenvragen – Toelatingsexamen arts & tandarts (toelatingsexamenartstandarts.be)
Bron: Ijkingsproeven HOME – IJkingstoets.be
- Welke waarde heeft de pH van de oplossing die verkregen wordt door 40,0 mL van een 0,100 mol.L-1 waterstofchloride-oplossing samen te voegen met 40,0 mL van een 0,100 mol.L-1 bariumhydroxide-oplossing?
| <A> | 13,0 |
| <B> | 12,7 |
| <C> | 7,00 |
| <D> | 1,30 |
2. Een zuur-base-indicator, voorgesteld door HIn, is een zwak éénwaardig organisch zuur met pKz = 4,00.
Deze indicator kleurt een oplossing blauw als [HIn] >10 [In–] en geel als [In–] >10 [HIn].
Wat is het pH-omslaggebied met bijhorende kleurverandering van deze indicator?
| pH-omslaggebied | Kleurverandering | |
| <A> | 9,0 – 11,0 | geel – blauw |
| <B> | 9,0 – 11,0 | blauw – geel |
| <C> | 3,0 – 5,0 | geel – blauw |
| <D> | 3,0 – 5,0 | blauw – geel |
3. Chinaldinerood is een zuur-base-indicator die een rode kleur heeft in oplossingen met een pH > 3,5 en kleurloos is in oplossingen met een pH< 1,5.
Aan de volgende oplossingen voegt men enkele druppels van een oplossing van deze indicator toe.
I 1,0.10-1 mol.L-1 HCl II 1,0.10-1 mol.L-1 NaCl
In welke oplossing krijgt de indicator een rode kleur?
- <A> alleen in oplossing II
- <B> in oplossingen II en III
- <C> in oplossingen I en III
- <D> in geen van de drie
4. Een natriumhydroxide-oplossing heeft pH = 12,0. Wat is de concentratie van de Na+ -ionen in deze oplossing?
5. Gegeven zijn volgende zuurconstanten bij 25°C
Wat is bij 25°C de waarde van de evenwichtsconstante K voor de onderstaande reactie?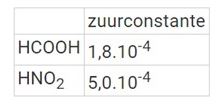
![]()
| <A> | 3,6 .10-1 |
| <B> | 6,8 .10-4 |
| <C> | 2,8 |
| <D> | 3,2 .10-4 |
6. Aan 100 mL van een waterstofchloride-oplossing met c = 1,00 mol.L-1 voegt men 100 mL van een natriumhydroxide-oplossing met c= 1,50 mol.L-1 toe. Welke volume waterstofchloride-oplossing met c = 2,00 mol.L-1 is er nodig om de pH van het mengsel op 7,00 te brengen?
7. Wat geldt voor elke waterige oplossing bij 25°C?
- a. pH pyrodruivenzuuroplossing > pH azijnzuuroplossing
- b. pH pyrodruivenoplossing < pH azijnzuuroplossing
- c. pH pyrodruivenzuuroplossing = pH azijnzuuroplossing, maar niet gelijk aan 7
- d. pH pyrodruivenzuuroplossing = pH azijnzuuroplossing = 7
9. Welke van de volgende oplossingen heeft de hoogste pH?
- Een 0,010 mol/l HCl-oplossing
- Een oplossing met concentratie H3O+ van 1,0 10-11 mol/l
- Een oplossing met pH van 10
- Een oplossing met concentratie van OH– 1,0 10-6 mol/l
10. De concentratie H3O+ in een oplossing bedraagt 10−3 mol/L. Wat is de pH van deze oplossing?
(A) −3 (B) 3 (C) 10 (D) 11
11. Een abnormaal hoge H+-concentratie in ons lichaam is nefast voor alle organen. Er moeten dus systemen zijn die
de H+-concentratie constant houden in het lichaam, namelijk de buffersystemen. Er bestaan zowel buffers in als
buiten de cel. Een belangrijke intracellulaire buffer is het fosfaat buffersysteem (HPO42 – /H2PO4– ), het is in staat H+ aan zich te binden en vervolgens weer los te laten volgens onderstaande zuur/base reactievergelijking.
HPO42– + H3O+ –> H2O + H2PO4–
Welke deeltjes in de gegeven reactievergelijking zijn geconjugeerde zuur/base paren?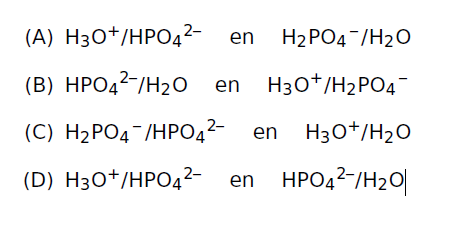
a. Die is kleiner dan die van de KOH-oplossing en kleiner dan 7.
b. Die is kleiner dan die van de KOH-oplossing en groter dan 7.
c. Die is gelijk aan die van de KOH-oplossing
d .Die is groter dan die van de KOH-oplossing.
16. In een tabel met gegevens over indicatoren vinden we:

- a. MR kleurt geel en FR rood.
- b. MR kleurt rood en FR geel.
- c. Zowel MR als FR kleuren geel.
- d. Zowel MR als FR kleuren rood.
18. Een oplossing met c = 0,10 mol/L heeft bij 25 °C een pH = 2,07. Wat kan de opgeloste stof in deze oplossing zijn?
Ter informatie
19. Een metaal wordt in 100 mL HCl-oplossing met pH = 1,0 gebracht.
Wat is de hoeveelheid waterstofgas die gevormd werd tijdens deze reactie?
20. Kz (CH3COOH) = 1,8.10-5 Kz (HCN) = 5,8.10-10
Welke van de onderstaande oplossingen heeft de hoogste pH?
Wat is de pH van het ontstane mengsel?
22. HCN is een zwak zuur (Kz = 5,0 x 10–10). NH3 is een zwakke base (Kb = 1,8 x 10–5).
c = 1,0 mol.L-1 om een buffermengsel te vormen? pKz(NH4+-1) = 9,25
24. Welk mengsel van de gegeven oplossingen vormt een buffermengsel?










