H14 – Film: toelatingsexamen
Bron: Examenvragen – Toelatingsexamen arts & tandarts (toelatingsexamenartstandarts.be)
Bron: Ijkingsproeven HOME – IJkingstoets.be
- Voor de reactie A + B –> C + D werd de reactiesnelheid v bepaald bij verschillende concentraties van de reagentia. De resultaten van het onderzoek staan in de onderstaande tabel.
| Experiment nr. | 1 | 2 | 3 | 4 | 5 |
| [A] (mol.L-1) | 0,10 | 0,20 | 0,30 | 0,20 | Y |
| [B] (mol.L-1) | 0,10 | 0,10 | 0,20 | 0,20 | 0,30 |
| v (mol.L-1.s-1) | 0,0015 | 0,0030 | X | 0,0060 | 0,018 |
Voor welke waarden staan X en Y?
| Experiment | [A]0 (mol.L-1) | [B]0 (mol.L-1) | v0 (mol.L-1.s-1) |
| 1 | 0,10 | 0,10 | 1,0 |
| 2 | 0,20 | 0,10 | 4,0 |
| 3 | 0,20 | 0,20 | 8,0 |
Wat is de beginsnelheid van de reactie als [A]0 = [B]0 = 0,40 mol.L-1 ?
| Experiment | Beginconcentratie (mol.L-1) | ||
| [Cr2O72-] | [I–] | ||
| #1 | 0,0040 | 0,010 | 0,00050 |
| #2 | 0,0080 | 0,010 | 0,0010 |
| #3 | 0,0120 | 0,020 | 0,0060 |
| orde t.o.v. Cr2O72- | orde t.o.v. I– | |
| <A> | 1 | 2 |
| <B> | 2 | 1 |
| <C> | 2 | 2 |
| <D> | 1 | 1 |
4. De temperatuur heeft meestal een merkbare invloed op de snelheid van een chemische reactie.
In verband met die invloed worden volgende uitspraken gedaan:
- Of een reactie bij veranderen van de temperatuur sneller, dan wel trager zal verlopen, hangt af van het feit of ze exotherm of endotherm
- Bij verhogen van de temperatuur neemt de gemiddelde kinetische energie van de botsende deeltjes
- Bij verlagen van de temperatuur neem de activeringsenergie toe. Welke van deze uitspraken zijn correct?
- <A> enkel 2
- <B> enkel 2 en 3
- <C> enkel 1 en 2
- <D> 1, 2 en 3
5. Gegeven is de reactie 2A(aq) + B(aq) –> C(aq) + 2D(aq)
De gemiddelde reactiesnelheid vgem voor deze reactie in een tijdsinterval
∆t wordt als volgt gedefiniëerd:
Hoeveel bedraagt de gemiddelde reactiesnelheid gedurende deze eerste minuut?
- <A> 2,5.10-2 mol.L-1.min-1
- <B> 5,0.10-2 mol.L-1.min-1
- <C> 0,10 mol.L-1.min-1
- <D> 4,2.10-4 mol.L-1.min-1

8. Wat is de eenheid van de reactieconstante in een reactie van de derde orde?
9. Hemoglobine in de rode bloedcellen zorgt in het lichaam voor het binden en transporteren van dizuurstof van de longen naar de weefsels. Koolstofmonoxide kan zich eveneens aan het hemoglobine binden om zo
carboxyhemoglobine te vormen. De reactiesnelheid wordt gemeten voor de reactie tussen hemoglobine
(Hb) en koolstofmonoxide waarbij carboxyhemoglobine (COHb) wordt gevormd. Hieronder staan de meetresultaten van drie metingen:
De binding tussen koolstofmonoxide en hemoglobine is echter 250 keer sterker dan de binding tussen dizuurstof en hemoglobine. Eens
hemoglobine zich gebonden heeft aan koolstofmonoxide is het niet langer beschikbaar om dizuurstof te vervoeren en komt het lichaam in
zuurstofnood. Vandaar de giftige werking van koolstofmonoxide.
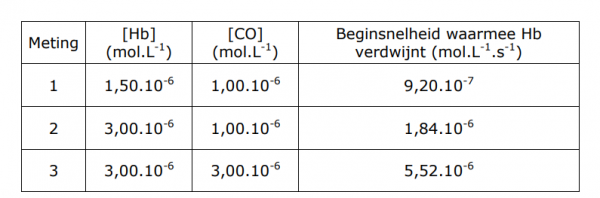
Met welke vergelijking kan de snelheid v van deze reactie worden berekend?

10. Voor volgende chemische reactie
Cr2O72-(opl) + 9 I–(opl) + 14 H+(opl) –> 2 Cr3+(opl) + 3 I–3(opl) + 7 H2O(vl) worden bij verschillende beginconcentraties de gegeven reactiesnelheden gemeten. H+is telkens in grote overmaat aanwezig en de temperatuur is steeds dezelfde.
- a. De reactiesnelheid wordt acht keer groter.
- b. De reactiesnelheid wordt verdubbeld.
- c. De reactiesnelheid wordt gehalveerd.
- d. De reactiesnelheid blijft onveranderd
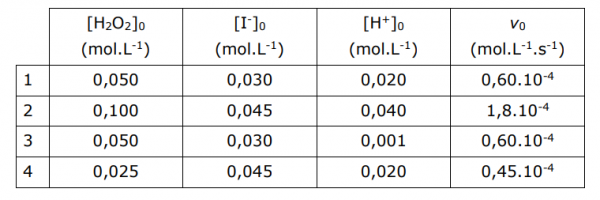
12. Voor de reactie H2O2(aq) + 3 I–(aq) + 2 H+(aq) –> I3–(aq) + 2 H2O(l)
werd bij constante temperatuur maar verschillende beginconcentraties van de reagentia de reactiesnelheid bij het begin van de reactie bepaald. Onderstaande tabel laat je de verschillende meetresultaten zien.
Wat is de orde van de reactie wat betreft H+ en wat is de totale orde van de reactie?
- a. orde 1 wat betreft H+ en orde 3,5 voor de totale reactie
- b. orde 1 wat betreft H+ en orde 3 voor de totale reactie
- c. orde 0 wat betreft H+ en orde 3 voor de totale reactie
- d. orde 0 wat betreft H+ en orde 2 voor de totale reactie
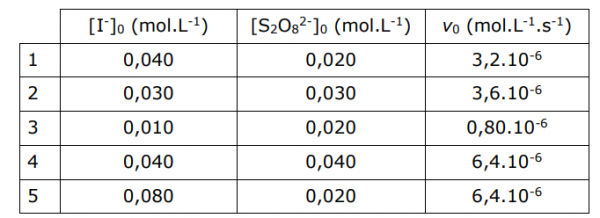
13.Peroxodisulfaationen reageren met jodide-ionen volgens de reactie
S2O82-(aq) + 2 I–(aq) 2 SO42-(aq) + I2 (aq)
Voor die reactie werd bij constante temperatuur maar verschillende beginconcentraties van de reagentia de reactiesnelheid bij het begin van de reactie bepaald. Onderstaande tabel laat je de verschillende meetresultaten zien.
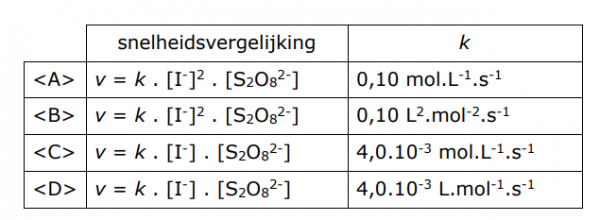
Welke snelheidsvergelijking en welke waarde van de reactiesnelheidsconstante leid je hieruit af?
a A + b B –> c C + d D geldt volgende snelheidsvergelijking:
v = k . [A] . [B]² . Hierover worden volgende beweringen gedaan:
1) de waarde van k is onafhankelijk van de temperatuur;
3) de waarde van k is onafhankelijk van de concentraties van A en B.