H12 – Film: toelatingsexamen
Bron: Examenvragen – Toelatingsexamen arts & tandarts (toelatingsexamenartstandarts.be)
Bron: Ijkingsproeven HOME – IJkingstoets.be
- <A> OF2 – O2 – H2O2 – H2O
- <B> H2O2 – O2 – H2O – OF2
- <C> H2O – H2O2 – O2 – OF2
- <D> O2 – H2O – OF2 – H2O2
Gegeven zijn de E°-waarden bij 25°C voor volgende halfreacties:
Sn2+ (aq) + 2 e– ⇌ Sn (s) E° = – 0,14 V
Ni2+ (aq) + 2 e– ⇌ Ni (s) E° = – 0,23 V
Welke uitspraak in verband met de concentratie van de Ni2+-ionen en de aard van de Ni-elektrode is correct wanneer de cel stroom levert?
| [Ni2+] | Ni-elektrode | |
| <A> | neemt af | kathode |
| <B> | neemt af | anode |
| <C> | neemt toe | kathode |
| <D> | neemt toe | anode |
3. Lachgas (N2O) kan worden bereid door verhitten van ammoniumnitraat met ijzer als katalysator.
Welk deeltje vervult de rol van oxidator bij de deze bereiding van lachgas?
4. In welke verbinding heeft mangaan het oxidatiegetal +III?
5. In een 0,25 mol L-1 oplossing van de base strychnine (rattenvergif, C21H22N2O2) is bij 25°C de [𝑂𝐻−]= 7,0.10-4 mol L-1. Welke waarde heeft de baseconstante Kb van strychnine bij 25°C?
| <A> | 2,0.10-6 |
| <B> | 6,7.10-4 |
| <C> | 2,7.10-3 |
6. Hieronder staan vier reactievergelijkingen:
- CaCO3 –> CaO + CO2
- Fe + 2 HCl –> FeCl2 + H2
- 2 NH4Cl + Ca(OH)2 –> 2NH3 + 2 H2O + CaCl2
- 6 H2O + 6 CO2 –> 6 O2 + C6H12O6
Welke van deze reacties zijn redoxreacties?
8. Gegeven is de niet-uitgebalanceerde redoxreactie:
|
| <A> | 6 |
| <B> | 12 |
| <C> | 24 |
| <D> | 30 |
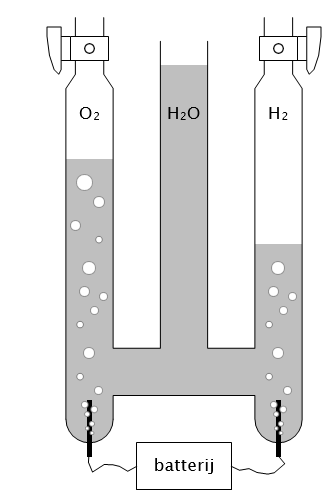
2 H2O (vl) –> 2 H2 (g) + O2 (g)
- a. Elektronen worden opgenomen in het H2-compartiment. Dit is de reductie
- b. Elektronen worden afgegeven in het H2-compartiment. Dit is de reductie
- c. Elektronen worden opgenomen in het H2-compartiment. Dit is de oxidatie
- d. Elektronen worden afgegeven in het H2-compartiment. Dit is de oxidatie
10. Bepaal het oxidatiegetal van mangaan voor en na de reactie:
2 MnO4– + 3 NO2– + H2O –> 2 MnO2 + 3 NO3– + 2 OH–
11. Natriumhypochloriet (NaOCl) is een effectief middel voor reiniging en ontsmetting. De stof heeft een hoge reactiviteit
en kan verschillende reacties ondergaan. Welke van de gegeven reacties zijn redoxreacties?
(1) NaOCl + 2Cu –>Cu2O + NaCl
(2) NaOCl + 2HCl –> Cl2 + H2O + NaCl
(3) NaOCl + H2O –>HOCl + NaOH
(A) Reacties (1) en (2).
(B) Reacties (2) en (3).
(C) Enkel reactie (3).
(D) Reacties (1), (2) en (3).
12. Een oplossing die gelijke molhoeveelheden opgelost NiCl2 en SnBr2 bevat, wordt geëlektrolyseerd met behulp van een 9 V-batterij en inerte grafietelektroden. Neem aan dat de concentratie van beide zouten voldoende hoog is, zodat er geen elektrolyse van water plaatsvindt.
Gegeven zijn de onderstaande halfreacties met hun E°-waarden:
a. Sn(v) aan de kathode en Br2(vl) aan de anode
b. Ni(v) aan de kathode en Br2(vl) aan de anode
c. Sn(v) aan de kathode en Cl2(g) aan de anode
d. Ni(v) aan de kathode en Cl2(g) aan de anode
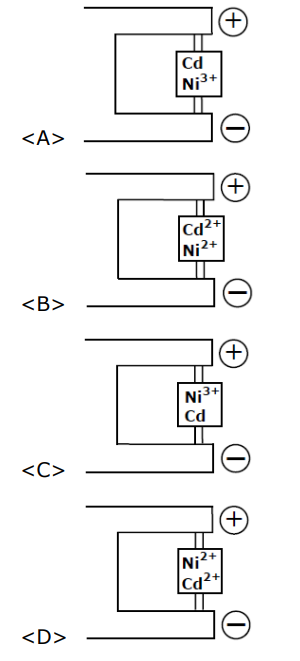
Welke voorstelling geeft een nikkel-cadmiumbatterij weer nadat een uitgeputte batterij volledig werd herladen?
… ClO2 + … KOH → … X + … Y + …H2O
18. Gegeven zijn de halfreacties:
Twee mogelijke uitspraken over veranderingen nadat het plaatje uit de oplossing gehaald werd, zijn:
I. de massa van het plaatje is toegenomen;
II. de intensiteit van de blauwe kleur van de oplossing is afgenomen.
Welke verandering(en) I en/of II is/zijn werkelijk waar te nemen?
19. Gegeven zijn de volgende reactievergelijkingen:
2 NH4Cl + Ca(OH)2 –> 2 NH3 + 2 H2O + CaCl2
6 H2O + 6 CO2 –> 6 O2 + C6H12O6
Br2 + SO2 + 2 H2O –> 2 HBr + H2SO4
2 HNO2 + 2 HClO2 –> N2O + 2 HClO3 + H2O
Welke stof is in één van deze reacties de oxidator?
20. In welke reactie speelt de watermolecule de rol van oxidator?
- a. In de reactie 2 NaCl + F2 → 2 NaF + Cl2 wordt het natriumion in NaCl geoxideerd.
- b. In de reactie Fe + S → FeS neemt het ijzeratoom elektronen op.
- c. In de reactie CuO + H2 → Cu + H2O is H2 de reductor.
- d. In de reactie 2 HI + H2O2 → 2 H2O + I2 is HI de oxidator.
22. Gegeven zijn volgende reactievergelijkingen: