Hoofdstuk 15 – Experimenten
1. Invloed van deeltjesgrootte
1.1. Het regent vuur

- Info: Oxalaten zijn soms thermisch instabiel: de zouten kunnen onder verhitting ontleden in het metaal horende bij het kation onder afgifte van 2 moleculen kooldioxide. Het op deze wijze ontleden van fijn verdeeld ijzeroxalaat is een manier om zogenaamd pyrofoor ijzer te maken. Het ijzer onder poedervorm brandt spontaan door de wrijvingskracht met lucht.
- Moeilijkheid:gemiddeld
- Chemische stoffen:ijzeroxalaat
- Thema: chemische reacties – energetische aspecten – reactiesnelheid
- Tijd: 15 min
- Begrippen: exo-energetische reacties – lichtvorming – invloed deeltjesgrootte
1.2. Invloed van de oppervlaktevergroting op brand

- Info: Welke invloed heeft oppervlaktevergroting op brand? In het horlogeglas kan de alcohol enkel ontbranden aan het bovenste oppervlak. Enkel daar komt zuurstof en is er dus een kleine vlam. Bij de verstuiver kan er langs alle zijden zuurstof bij de alcohol en is het contactoppervlak enorm vergroot. Dus krijgen we een grote vlam.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje – 98% alcoholoplossing
- Thema: organische stoffen – redoxreacties – reactiesnelheid
- Tijd: 15 min
- Begrippen: brandbaarheid – invloed van deeltjesgrootte
1.3. Welke factoren beïnvloeden de snelheid van een chemische reactie met krijt?

- Info: Welke factoren beïnvloeden de snelheid van een chemische reactie? Hoe groter de verdelingsgraad, hoe sneller de chemische reactie optreedt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 40 ml HCl-oplossing 2 mol/L – stukjes schoolkrijt
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte

- Info: Hoe beïnvloedt de concentratie van reagentia de reactiesnelheid? Hoe minder verdund de zoutzuur oplossing, hoe reactiever de oplossing troebel kleur
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumthiosulfaat – Verdund zoutzuur van 0,1 mol/l , 1,0 mol/l, 6,0 mol/l en 8,0 mol/l
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte – invloed van concentratie
1.5. Mate van verdeling van ijzer

- Info: Hoe beïnvloedt de verdelingsgraad van ijzer het verbrandingsproces? Het feit dat een ijzeren nagel niet verbrandt, het ijzerwol traag en ijzerpoeder wel in de bunsenbrander is te verklaren door de verdelingsgraad.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Ijzeren wol – Ijzerpoeder – Ijzeren plaat
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte
1.6. Mate van verdeling van rode biet

- Info: Hoe beïnvloedt de verdelingsgraad het diffusieproces? Omdat de verhouding van oppervlak tot volume het grootst is in de gesneden rode biet, wordt het water sterker gekleurd dan in de beker met de hele biet en met de gehalveerde rode biet. Dit fenomeen kan ook worden overgedragen op chemische reacties, omdat deze altijd plaatsvinden aan de interfase. Als de interfase groot is, kunnen er meer chemische reacties plaatsvinden.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Gedemineraliseerd water – Drie rode bieten
- Thema: reactiesnelheid – diffusie
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte – verdelingsgraad

- Info: Wat gebeurt er als lycopodium wordt opgedwarreld en ontstoken? De sporen kunnen in de verdampingskom niet worden ontstoken. Verbranding treedt alleen op als de sporen over een kaars worden uitgegoten. Je verbrandt plotseling met veel rook. Er zijn altijd vlammen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 spatelpunt lycopodium – 1 kaars
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte – verdelingsgraad
1.8. Factoren die een invloed hebben op de reactiesnelheid bij olifantenpasta vorming

- Info: Hoe beïnvloeden temperatuur, concentratie en katalysator de reactiesnelheid bij de vorming van olifantenpasta?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Waterstofperoxide 30% – Kaliumjodide – Dreft
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte – verdelingsgraad – temperatuur – concentratie
2. Invloed van een katalysator
2.1. Brandende suiker

- Info: Hoe kun je met modellen chemische stoffen ruimtelijk voorstellen? Het verbranden van een suikerklontje is een chemische reactie. Wanneer je het suikerklontje met as inwrijft, brandt het wel. Dit komt doordat de as meehelpt bij het verbranden van de suiker.
- Moeilijkheid: eenvoudig
- Chemische stoffen: paar suikerklontjes – beetje sigaretteas
- Thema: chemische reacties – energetische aspecten – redoxreacties – reactiesnelheid
- Tijd: 10 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
2.2. Rood ijs

- Info: Hoe kunnen we ijs maken met bloed? Het waterstofperoxide ontleedt zich in water en zuurstof. De vrijgekomen zuurstof heeft een sterk oxiderende kracht. De eiwitten in het bloed houden die zuurstof vast. Hierdoor krijgen we schuim.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bloed – Waterstofperoxide 30%
- Thema: chemische reacties – redoxreacties – reactiesnelheid
- Tijd: 10 min
- Begrippen: activeringsenergie – katalysator – warmte – exo-energetische reactie
2.3. Exotherme reactie met gedroogde gist

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van gist.Het gist bevat namelijk het catalase enzyme. Deze ontbinding is exotherm
- Moeilijkheid: eenvoudig
- Chemische stoffen: 1 pakketje of koffielepel gedroogde gist – 5% H202
- Thema: chemische reacties – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – katalysator
2.4. Inhibitiereactie bij het ontleden van zuurstofwater
- Info: Hoe kunnen we het ontleden van zuurstofwater versnellen en vertragen? Door gebruik te maken van katalysatoren
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0.1 mol/l Fe(NO3)3.9H2O – 30% H2O2 – 0.1 mol/l Na3PO4.10H2O
- Thema: chemische reacties – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – katalysator
2.5. Invloed van een katalysator bij ontbranding

- Info: Welke invloed heeft een katalysator op ontbranding? De assen werken hier als katalysator, ze zorgen dat de reactie opgaat zonder er zelf deel aan te nemen. Zonder katalysator gaat de reactie niet op.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje – Lucifer – Suikerklontjes – Assen
- Thema: chemische reacties – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – katalysator
2.6. Katalyse redoxreactie met koperionen

- Info: Hoe katalyseren koperionen de reactie tussen Fe3+ en thiosulfaatoplosing? Katalysatoren zijn stoffen die een reactie kunnen versnellen zonder zelf gebruikt te worden. Met koperionen (Cu2+) kan men een breed scala van redoxreacties versnellen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: IJzernitraat (Fe(NO3)3.9H2O) : 0.05 mol/l – Natriumthiosulfaat (Na2S2O3.5H2O) : 0.1 mol/l – Kopersulfaat (CuSO4.5H2O) : 5% kopersulfaat oplossing
- Thema: chemische reacties – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: exo-energetische reacties – mechanische energie – katalysator
2.7. Maak de meeste olifantenpasta

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van
gist.Het gist bevat namelijk het katalase enzyme. - Moeilijkheid: eenvoudig
- Chemische stoffen: KI-oplossing (10 g in 10 ml water); – detergent; – gedestilleerd water; – H2O2 (30%).
- Thema: enkelvoudige stoffen – redoxreactie – chemische reactie – reactiesnelheid
- Tijd: 15 min
- Begrippen: enkelvoudige stoffen – katalyse
2.8. Negatieve katalyse
- Info: Hoe beïnvloeden fosfaationen de ontleding van zuurstofwater gekatalyseerd door ijzerionen? Ijzer(III) ionen werken als katalysator bij de ontleding van waterstoperoxide. Fosfaten bouwen met de ijzer(III)ionen een complex, zodat het niet meer katalytisch actief is. Dit geldt eveneens met Mn(IV). Om deze reden wordt fosforzuur toegevoegd voor de stabilisering van H2O2
- Moeilijkheid: gemiddeld
- Chemische stoffen: Waterstofperoxide-oplossing (10%) – Fosforzuuroplossing (10%) – Geconcentreerde FeCl3-oplossing
- Thema: anorganische stoffen – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
2.9. Olifantenpasta voor kinderen

- Info: H2O2 ontbindt in H2O en O2. Het proces wordt gekatalyseerd door de aanwezigheid van gist.Het gist bevat namelijk het katalase enzym. Deze ontbinding is exotherm. Het gevormde zuurstofgas doet de oplossing schuimen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 10% H202 oplossing (eventueel te bekomen bij de apotheker. Let wel dat de oplossing redelijk vers is en minstens een 6% H2O2 )bevat – Actieve gist – Vloeibaar afwasmiddel
- Thema: anorganische stoffen – energetische aspecten – reactiesnelheid
- Tijd: 20 min
- Begrippen: peroxiden – exo-energetische reacties –katalysator
2.10. Vuurvaste ballon

- Info: Een ballon is gemaakt van rubber. Rubber smelt wanneer het wordt verwarmd, daarom knapt de ballon. Omdat het water in de ballon de warmte van de vlam opneemt, smelt het rubber niet en blijft de ballon heel.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 balonnen – een weinig water
- Thema: anorganische stoffen – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: katalysator
2.11. Hoe beïnvloedt mangaandioxide de snelheid van een chemische reactie?

- Info: Welke factoren beïnvloeden de snelheid van een chemische reactie? MnO2 katalyseert de reactie. Het bruisen van de reactie gebeurt door het gevormde dizuurstof. Je kan de dizuurstof aantonen met een gloeiende houtspaander.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 2 keer een spatelpuntje mangaandioxide (MnO2) – 6 ml zuurstofwateroplossing (H2O2) 3%
- Thema: anorganische stoffen – energetische aspecten – reactiesnelheid
- Tijd: 10 min
- Begrippen: katalysator
2.12. Katalase in een aardappel

- Info: Hoe kunnen we het enzym katalase in een aardappel aantonen? In de aardappelen zit het enzym katalase. De katalase werkt als enzym/katalysator voor de ontleding van waterstofperoxide in water en zuurstof. Zonder dit enzym kan waterstofperoxide zich niet zomaar splitsen
- Moeilijkheid: eenvoudig
- Chemische stoffen: aardappel – waterstofperoxide 5%
- Thema: biochemie – reactiesnelheid
- Tijd: 20 min
- Begrippen: katalysator
2.13. Babyolifantentandpasta

- Info: Kunnen we de reactiesnelheid verhogen? De gistcellen bevatten namelijk het enzym catalase wat de reactie katalyseert. Hierdoor wordt er dizuurstof gevormd, wat de grote schuimproductie verklaart.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Pakje gist – Vloeibaar detergent – Zuurstofwater (H2O2) 5 % – Suiker – Water
- Thema: biochemie – reactiesnelheid
- Tijd: 20 min
- Begrippen: katalysator
2.14. Olifantentandpasta

- Info: Hoe kunnen we de werking van een katalysator aantonen? Kaliumjodide (KI) is in deze reactie de katalysator die het proces versnelt waarbij waterstofperoxide (H2O2) wordt omgezet in water (H2O).
- Moeilijkheid: eenvoudig
- Chemische stoffen: 30 ml waterstofperoxide 8% (H2O2) – 10 ml afwasmiddel – 0,5 g kaliumjodide (KI) – Voedingskleurstof
- Thema: reactiesnelheid
- Tijd: 20 min
- Begrippen: katalysator
2.15. Geactiveerd complex

- Info: Wat gebeurt er met de paars gekleurde oplossing van natriumkaliumtartraat en waterstofperoxide als we kobaltchloride toevoegen? Het Co2+ dient als katalysator en wordt tijdelijk geoxideerd tot Co3+ en dan terug tot Co2+.Bij de reactie ontstaan O2 en CO2 en zorgen in de oplossing voor een troebel.Indien de proef uitgevoerd wordt bij lage temperatuur, is de groene kleur langer zichtbaar
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200 ml natriumkaliumtartraat 0,3 mol/l; – 65 ml 6% H2O2; – 15ml CoCl2 oplossing 0,3 mol/l.
- Thema: anorganische stoffen – redoxreactie – chemisch evenwicht – reactiesnelheid
- Tijd: 30 min
- Begrippen: zouten – oscillerende reactie – katalysator
2.16. Verbranding van suiker

- Info: Hoe kunnen we suiker verbranden in plaats van te ontleden via thermolyse? Door de mengverhouding van het suikerklontje met het as kan het suikerklontje gaan branden tijdens dit verbrandingsproces zal de suiker afnemen als brandbare stof en de sigarettenas/CuO dienen als de katalysator en houdt het vuurtje brandend.
- Moeilijkheid: gemiddeld
- Chemische stoffen: koperoxide – suiker
- Thema: chemische reacties – energetische aspecten – redoxreactie – reactiesnelheid
- Tijd: 20 min
- Begrippen: endo-energetische reacties – thermolyse – verbrandingsreactie
2.17. Factoren die een invloed hebben op de reactiesnelheid bij olifantenpasta vorming

- Info: Hoe beïnvloeden temperatuur, concentratie en katalysator de reactiesnelheid bij de vorming van olifantenpasta?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Waterstofperoxide 30% – Kaliumjodide – Dreft
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte – verdelingsgraad – temperatuur – concentratie
3. Invloed van temperatuur
3.1. De invloed van temperatuur op de brandbaarheid van stoffen

- Info: Welke invloed heeft temperatuur op brandbare stoffen en waar ontbranden ze? Bij de alcoholoplossing en bunsenbrander begint de vlam direct aan het oppervlak. Bij het theelichtje begint de vlam hoger dan het oppervlak.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Theelichtje – 98% alcoholoplossing
- Thema: reactiesnelheid – redoxreactie
- Tijd: 15 min
- Begrippen: verbranding – temperatuur
3.2. Ondergaande zon

- Info: Hoe kunnen we de een ondergaande zon voorstellen door een chemische reactie? We zien dat er duidelijk vertroebeling optreedt, dit is zo omdat er uiteindelijk zwavel wordt gevormd dat een neerslag is. Hierdoor wordt onze heldere oplossing troebel! We verkrijgen een colloïdale oplossing: de kleine zwaveldeeltjes blijven dus fijn verdeeld in de vloeistof.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 ml HCl 1 mol/l – 20 ml (0,1 mol/l) thiosulfaatoplossing
- Thema: reactiesnelheid – redoxreactie
- Tijd: 15 min
- Begrippen: temperatuur – invloed concentratie op reactiesnelheid
3.3. Welke factoren beïnvloeden de snelheid van een chemische reactie?

- Info: Welke factoren beïnvloeden de snelheid van een chemische reactie? Hoe hoger de temperatuur, hoe sneller de reactie optreedt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 3 ml HCl 1 mol/l – 20 ml (0,1 mol/l) thiosulfaatoplossing
- Thema: reactiesnelheid – redoxreactie
- Tijd: 25 min
- Begrippen: temperatuur
3.4. Factoren die een invloed hebben op de reactiesnelheid bij olifantenpasta vorming

- Info: Hoe beïnvloeden temperatuur, concentratie en katalysator de reactiesnelheid bij de vorming van olifantenpasta?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Waterstofperoxide 30% – Kaliumjodide – Dreft
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van deeltjesgrootte – verdelingsgraad – temperatuur – concentratie
4. Invloed van concentratie
4.1. Onderzoek van de invloed van concentratie op de reactiesnelheid
- Info: Hoe beïnvloedt concentratie de reactiesnelheid in de reactie? De tijd nodig opdat de S neerslag verschijnt geeft een rechtstreeks verband tussen reactiesnelheid en bij vaste concentraties zuur en de concentratie S2O32-.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Na2S2O3 0,1 mol/l – HCl 1 mol/l
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van concentratie
4.2. De ondergaande zon, uitgebreide versie
- Info: Hoe snel gebeurt een chemische reactie? Hoe kunnen we reactiesnelheid beïnvloeden? We zien dat er duidelijk vertroebeling optreedt, dit is zo omdat er uiteindelijk zwavel wordt gevormd dat een neerslag is. Hierdoor wordt onze heldere oplossing troebel. Des te hoger de concentratie thiosulfaat, des te sneller de neerslagvorming zichtbaar wordt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Natriumthiosulfaat – 0,5 mol/l HCl
- Thema: reactiesnelheid
- Tijd: 25 min
- Begrippen: invloed van concentratie
4.3. Egyptische nacht

- Info: Hoe kunnen we een kleurverandering bij een chemische reactie op commando uitvoeren?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Waterstofperoxide (H2O2) – Kaliumjodide (KI) – Natriumthiosulfaat (Na2S2O3) – Natriumwaterstofsulfaat (NaHSO4)
- Thema: reactiesnelheid
- Tijd: 35 min
- Begrippen: invloed van concentratie – katalysator
4.4. Invloed van de concentratie op de reactiesnelheid van calciumcarbonaat met zoutzuur
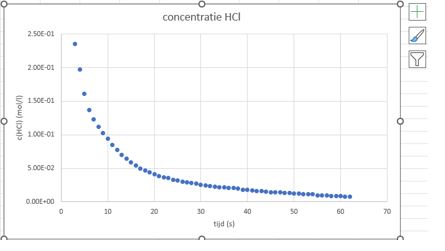
- Info: Wat is de invloed van de concentratie op de reactiesnelheid van calciumcarbonaat met zoutzuur? Tijdens ons experiment daalt snelheid omdat zoutzuur wordt opgebruikt en de concentratie daalt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl 2,0 mol/l -calciumcarbonaat
- Thema: reactiesnelheid
- Tijd: 35 min
- Begrippen: invloed van concentratie
4.5. Factoren die een invloed hebben op de reactiesnelheid bij olifantenpasta vorming

- Info: Hoe beïnvloeden temperatuur, concentratie en katalysator de reactiesnelheid bij de vorming van olifantenpasta?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Waterstofperoxide 30% – Kaliumjodide – Dreft
- Thema: reactiesnelheid
- Tijd: 15 min
- Begrippen: invloed van concentratie
5. Klokreacties
5.1. Blauw en oranje

- Info: Op welke manier katalyseren Cu(II)ionen de reactie tussen tartraat en zuurstofwater? Het tartraat reduceert Cu2+ tot het rode Cu+. Vervolgens wordt het Cu+ door het waterstofperoxide terug geoxideerd. Een deel van het tartraat valt daarbij uiteen in koolzuurgas en mierenzuur. Met soda wordt het aldus ontstane al te zure milieu wat geneutraliseerd waardoor ook weer het koper actief kan worden.
Uiteindelijk oxideert het peroxide al het tartraat. Op het eind kan men ook zwart koper(II)oxide in de beker waarnemen. - Moeilijkheid: gemiddeld
- Chemische stoffen: 110 ml ged. water (H2O) – 0,1 g Koper(II)sulfaat (CuSO4•5H2O) – 2,7 g Kaliumnatriumtartraat (KNaC4H4O6•4H2O) – 5 ml Waterstofperoxide 30% (H2O2) – 1 g Natriumcarbonaat (Na2CO3•nH2O) – KI oplossing 0,1 mol/l -CuSO4-oplossing 0,1 mol/l – Verzadigde Na2S2O3 oplossing
- Thema: Anorganische stoffen – redoxreacties – chemisch evenwicht – reactiesnelheid
- Tijd: 30 min
- Begrippen: peroxiden – oscillerende reactie
5.2. Briggs reactie

- Info: De Briggs-Rauscher oscillerende reactie volgens klassiek recept
- Moeilijkheid: gemiddeld
- Chemische stoffen: zetmeeloplossing 1% – vast malonzuur – H2O2 30% – aminosulfonzuur vast – mangaansulfaat vast – Natriumjodaat vast
- Thema: anorganische stoffen – chemisch evenwicht – reactiesnelheid
- Tijd: 40 min
- Begrippen: oscillerende reactie
5.3. Chemiluminescente klokreactie

- Info: Waterstofperoxide is een bijproduct in deze oxidatie. Koperionen vormen een complex met het cysteïne en zo lang cysteïne aanwezig is, zijn er onvoldoende koperionen aanwezig om de oxydatie tussen waterstofperoxide en luminol te starten. De inductieperiode kan verkort worden door een hogere concentratie van de koperionen of door een daling van het cysteïne.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 0,08 g cysteïne – 1500 ml water – 5 g KOH – 0,1 g luminol – 0,25 g CuSO4.5H2O – 10 ml verse 3% H2O2
- Thema: anorganische stoffen – chemisch evenwicht – reactiesnelheid
- Tijd: 40 min
- Begrippen: oscillerende reactie
5.4. De blauwe kolfproef

- Info: Methyleenblauw is een aromatische verbinding die opgelost in water blauw kleurt. Het is een redoxindicator die een duidelijke kleurverandering ondergaat op een specifieke potentiaal.Glucose wordt in een alkalische oplossing langzaam geoxideerd door zuurstof met vorming van gluconzuur. In aanwezigheid van natriumhydroxide is gluconzuur omgezet naar natriumgluconaat.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 10 g glucose – 12 g vast NaOH – 0.1 massa% methyleenblauwoplossing in ethanol
- Thema: anorganische stoffen – chemisch evenwicht – reactiesnelheid
- Tijd: 20 min
- Begrippen: oscillerende reactie

- Info: Methyleenblauw is een aromatische verbinding die opgelost in water blauw kleurt. Het is een redoxindicator die een duidelijke kleurverandering ondergaat op een specifieke potentiaal.Glucose wordt in een alkalische oplossing langzaam geoxideerd door zuurstof met vorming van gluconzuur. In aanwezigheid van natriumhydroxide is gluconzuur omgezet naar natriumgluconaat.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 10 g glucose – 12 g vast NaOH – 0.1 massa% methyleenblauwoplossing in ethanol
- Thema: anorganische stoffen – chemisch evenwicht – reactiesnelheid
- Tijd: 20 min
- Begrippen: oscillerende reactie
5.6. De paarse fles

- Info: Waarom verdwijnt de paarse kleur? Cysteïne (een aminozuur met een thiolgroep)heeft als systematische naam (2R)-2-amino-3-sulfanylpropaanzuur. In de reactie gaat het om twee complexen waarvan er een een kleur heeft:het cysteïne-Fe2+ complex is kleurloos, het cysteïne-Fe3+ complex paarsblauw.Cysteïne reduceert Fe(III) tot Fe(II). Daarbij ontstaat cystine, Cys-S-S-Cys.Door schudden lost zuurstof op, dat Fe(II) oxideert tot Fe(III). Hierbij ontstaat opnieuw het paarsblauwe complex.De reactie stopt als alle cysteïne is omgezet in cystine.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Cysteïne – NaHCO3 (= bakpoeder) – 1M FeCl3x 6 H2O-oplossing
- Thema: anorganische stoffen – chemisch evenwicht – reactiesnelheid
- Tijd: 20 min
- Begrippen: oscillerende reactie

- Info: Wat gebeurt er met de paars gekleurde oplossing van natriumkaliumtartraat en waterstofperoxide als we kobaltchloride toevoegen? Het Co2+ dient als katalysator en wordt tijdelijk geoxideerd tot Co3+ en dan terug tot Co2+.Bij de reactie ontstaan O2 en CO2 en zorgen in de oplossing voor een troebel.Indien de proef uitgevoerd wordt bij lage temperatuur, is de groene kleur langer zichtbaar
- Moeilijkheid: gemiddeld
- Chemische stoffen: 200 ml natriumkaliumtartraat 0,3 mol/l; – 65 ml 6% H2O2; – 15ml CoCl2 oplossing 0,3 mol/l.
- Thema: anorganische stoffen – redoxreactie – chemisch evenwicht – reactiesnelheid
- Tijd: 30 min
- Begrippen: zouten – oscillerende reactie – katalysator
5.8. Groen blauwe kolf

- Info:In het experiment wordt de geoxideerde vorm van methyleenblauw MB+ door ascorbinezuur gereduceerd naar MBH2+ en vervolgens door luchtzuurstof weer geoxideerd tot MB+. De zuurstof wordt door het schudden in de oplossing gebracht. Bij staan reduceert het ascorbinezuur MB+ terug naar zijn kleurloze vorm. Cu2+ ionen katalyseren deze laatste reactie
- Moeilijkheid: gemiddeld
- Chemische stoffen: zuiver vitamine C in poedervorm – oplossing van methyleenblauw in ethanol (0.1 g in 100ml ethanol 70%) – kopersulfaatoplossing 1,6 massa%
- Thema: chemische reacties – complexreactie – redoxreactie – chemisch evenwicht – reactiesnelheid
- Tijd:20 min
- Begrippen: stofveranderingen – complexreacties – oscillerende reactie
5.9. Klokreactie met indigocarmijn

- Info: Kunnen we een oplossing maken die in 3 kleuren kan veranderen? De natriumhydroxide maakt de oplossing basis. De glucose werkt als een reductiemiddel met indigokarmijn. Deze gedraagt zich als indicator bij de redoxproces. Indigokarmijn kan bestaan in geoxideerde, gereduceerde en
tussenvormen. - Moeilijkheid: gemiddeld
- Chemische stoffen: glucoseoplossing (0,1M), je hebt hiervan ongeveer 50 mL nodig – Natronloog (0,6M), hiervan heb je maximaal 100 mL nodig) – Indigokarmijn (een spatelpuntje volstaat)
- Thema: chemische reacties – redoxreactie — reactiesnelheid
- Tijd:20 min
- Begrippen: complexreacties – oscillerende reactie
5.10. Klokreactie met jood

- Info: Klokreactie met dijood en thiosulfaat
- Moeilijkheid: gemiddeld
- Chemische stoffen: OplossingA: 2 ml 30% H2O2 + 93 ml gedestilleerd water – Oplossing B: Breng 1 g zetmeel in 100ml water aan het koken. Kook eventjes door. Voeg nu 0,124 g Na2S2O3.5H2O aan de 100ml oplossing – OplossingC: 1,74 g KI, 1,4 g CH3COONa en 3ml 6M azijnzuur in 200 ml oplossing
- Thema: chemische reacties – redoxreactie — reactiesnelheid
- Tijd: 30 min
- Begrippen: complexreacties – oscillerende reactie
5.11. Reactie tussen zuurstofgas en methyleenblauw
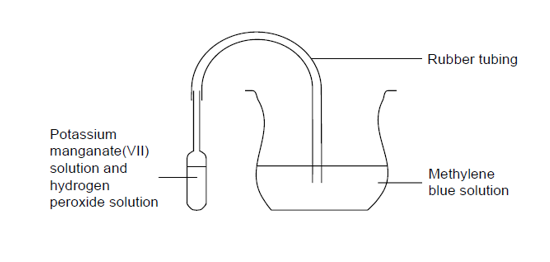
- Info: Eerst ontstaat in de pipet door reactie tussen H2O2 en KMnO4 O2 gas. De kleurloze oplossing van methyleenblauw wordt terug blauw door contact met zuurstofgas.
- Moeilijkheid: gemiddeld
- Chemische stoffen: H202 5% – KMnO4 0,1 mol/l – Methyleenblauwoplossing – Glucose
- Thema: reactiesnelheid
- Tijd: 20 min
- Begrippen: klokreactie
5.12. Synthetisch gouden uurwerk

- Info: Hoe kunnen we ineens een gouden neerslag tevoorschijn laten komen? Beide oplossingen worden samen gebracht. Geleidelijk ontstaat een goudgele kleuring, na ongeveer 30 seconden.
- Moeilijkheid: gemiddeld
- Chemische stoffen: natriumarseniet – azijn – Natriumthiosulfaat.5H2O
- Thema: reactiesnelheid
- Tijd: 20 min
- Begrippen: klokreactie
5.13. Zonsondergang
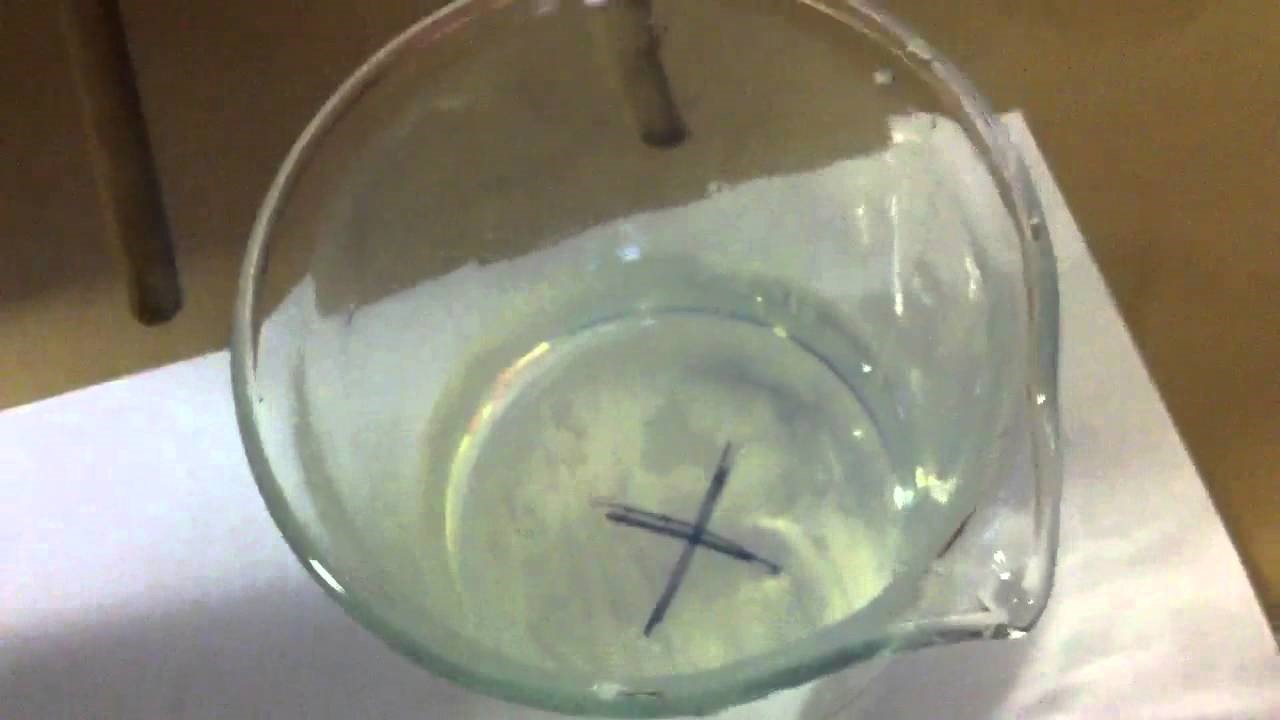
- Info:We zien dat er duidelijk vertroebeling optreedt. Dit is zo omdat er uiteindelijk zwavel wordt gevormd dat een neerslag is. Hierdoor wordt onze heldere oplossing troebel. Des te hoger de concentratie zoutzuur, des te sneller de neerslagvorming zichtbaar wordt.We verkrijgen een colloïdale oplossing: de kleine zwaveldeeltjes blijven dus fijn verdeeld in de vloeistof. Doordat er steeds meer zwavel ontstaat krijgen we dus een vertroebeling dat uiteindelijk ervoor zorgt dat het licht dat doorheen de beker schijnt, geblokkeerd wordt
- Moeilijkheid: gemiddeld
- Chemische stoffen: 20 g Na2S2O3 – 1 l water – HCl 2 mol/l 20 ml
- Thema: reactiesnelheid
- Tijd: 20 min
- Begrippen: klokreactie – invloed concentratie op reactiesnelheid
5.14. Egyptische nacht

- Info: Hoe kunnen we een kleurverandering bij een chemische reactie op commando uitvoeren?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Isobetadine – Huishoudazijn – Waterstofperoxide 30% – Zetmeeloplossing 1% – Vitamine C oplossing 5%
- Thema: reactiesnelheid
- Tijd: 35 min
- Begrippen: invloed van concentratie – katalysator
5.15. Joodklok

- Info: Hoe kun je een chemische reactie op een welbepaald tijdstip zichtbaar laten worden? Bij een stijgende concentratie bisulfiet duurt het langer eer de oplossing zwart kleurt. Jodaat reageert met het bisulfiet tot het Jodide ion
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaHSO3 0,025 mol/l – KIO3 0,025 mol/l – Zetmeeloplossing 1%
- Thema: reactiesnelheid
- Tijd: 35 min
- Begrippen: invloed van concentratie – klokreactie
5.16. Willem Tell en jodiumklok

- Info: Hoe kunnen we een oscillerende reactie op muziek laten lopen? De eerste vergelijking geeft aan dat jodide-ionen in een zure oplossing door waterstofperoxide worden geoxideerd tot trijodide-ionen. Deze trijodide-ionen worden door thiosulfaationen teruggebracht tot jodide-ionen, zoals aangegeven in vergelijking 2. Deze reactie is veel sneller dan de reactie van vergelijking 1; Het verbruikt trijodide-ionen net zo snel als ze worden gevormd. Dit voorkomt een direct zichtbare reactie van vergelijking 3.Nadat alle thiosulfaationen zijn verbruikt door de reactie van vergelijking 2, reageren trijodide-ionen met zetmeel om het blauwe zetmeel-pentaiodide-complex te vormen
- Moeilijkheid: eenvoudig
- Chemische stoffen: los 2,0 g KIO3 (kaliumjodaat) op in een liter water. Los 2,0 g oplosbaar zetmeel op in kokend water van 500 ml, laat afkoelen en voeg 0,40 g NaHSO3 (natriumbisulfiet) en 5,0 ml 6 M H2SO4 (zwavelzuur) of 1,7 ml geconcentreerd H2SO4 toe. Verdunnen tot 1 liter.
- Thema: reactiesnelheid
- Tijd: 35 min
- Begrippen: invloed van concentratie – klokreactie
5.17. Waterstofperoxide jodiumklok

- Info: Hoe kunnen we een oscillerende reactie kleurloos-zwart bekomen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: 0,6 gram Zetmeel – 30 ml azijnzuur – 4,1 gram natriumacetaat – 50 gram kaliumjodide – 4,7 gram natriumthiosulfaat
- Thema: reactiesnelheid
- Tijd: 35 min
- Begrippen: invloed van concentratie – klokreactie
6. Liesegangsche ringen
6.1. Liesegangsche ring met hexaaminokobalt

- Info: Op welke manier ontstaan Liesegangse ringen? Ringen met kobaltionen en ammoniak.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine – CoCl2 – Geconcentreerde ammoniak
- Thema: reactiesnelheid
- Tijd: 30 min
- Begrippen: complexreacties – liesegangse ringen
6.2. Liesegangsche ring met koperdichromaat

- Info: Op welke manier ontstaan Liesegangse ringen? Ringen met koper(II)ionen en chromaationen.
- Moeilijkheid: gemiddeld
- Chemische stoffen: natriumsilicaat – kaliumchromaat – azijnzuuroplossing – kopersulfaat
- Thema: reactiesnelheid
- Tijd: 30 min
- Begrippen: complexreacties – liesegangse ringen
6.3. Liesegangsche ring met magnesiumionen en natriumhydroxide

- Info: Op welke manier ontstaan Liesegangse ringen? Ringen met magnesiumionen en hydroxide ionen.
- Moeilijkheid: gemiddeld
- Chemische stoffen:
- magnesiumchloride gelatinepoeder – ammoniak geconc – natriumhydroxide
- Thema: reactiesnelheid
- Tijd: 30 min
- Begrippen: complexreacties – liesegangse ringen
6.4. Liesegangsche ringen met gelatinestalen

- Info: Op welke manier ontstaan Liesegangse ringen? Ringen met ionen en gelatine.
- Moeilijkheid: gemiddeld
- Chemische stoffen: magnesiumchloride 5 g gelatine en 2.5 g chemicaliën mengen met 50 ml water en laten reageren. Het 2de zout na gelvorming op de top plaatsen
- Thema: reactiesnelheid
- Tijd: 60 min
- Begrippen: complexreacties – liesegangse ringen
6.5. Liesegangsche ringen met gassen

- Info: Contact tussen zoutzuur en ammoniak geeft ammoniumchloride
- Moeilijkheid: gemiddeld
- Chemische stoffen: geconcentreerd ammoniak – geconcentreerd zoutzuur
- Thema: reactiesnelheid
- Tijd: 20 min
- Begrippen: liesegangse ringen – diffusie
6.6. Liesegangsche ringen

- Info: Wat gebeurt er als we in een mengsel van kaliumdichromaat en gelatinepoeder na geleren een druppel zilverchloride oplossing brengen? Als de chromaationen bevattende gel eenmaal vast is plaatsen we de zilvernitraat oplossing boven op de gel. De zilverionen diffunderen in de gel waar ze in contact komen met de chromaationen. Het gevormde zilverchromaat slaat neer
- Moeilijkheid: gemiddeld
- Chemische stoffen: Gelatine poeder – Kaliumdichromaat – Zilvernitraatoplossing 1 mol/l
- Thema: reactiesnelheid
- Tijd: 20 min
- Begrippen: liesegangse ringen – diffusie
7. Snelle en trage reacties
7.1. Afbraaksnelheid van bioplastics

- Info: Vul bekers met potgrond en met een bioplastic. Hoelang duurt de afbraak van het kunststofstaal?
- Moeilijkheid: eenvoudig
- Chemische stoffen: bioplastiek – grond – verpakkingsmateriaal (bio/niet bio)
- Thema: reactiesnelheid – kunststoffen
- Tijd: -min
- Begrippen: bioplastics
7.2. Gebeuren alle reacties even snel?
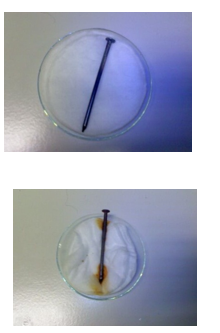
- Info: Gebeuren alle chemische reacties even snel? Vergelijk de snelheid van beide reacties met elkaar. Wat kun je vaststellen?
- Moeilijkheid:eenvoudig
- Chemische stoffen: IJzeren nagel – Staalwol – 2 ml CuSO4-oplossing 0,1mol/l – 2 ml NH3-oplossing 1,0 mol/l
- Thema: reactiesnelheid
- Tijd: -min
- Begrippen: corrosie – snelle en trage reacties
7.3. Kinetiekproef met onzichtbare inkt en oxaalzuur

- Info:Wat zou er met de paarse-blauwe inkt kunnen gebeuren als we hiermee op papier schrijven? De paars-blauwe kleur van de KMnO4-oplossing vervaagt en verkleurt naar bruin. Waarna het helemaal verdwijnt na een tijdje.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Verzadigde oxaalzuuroplossing 12g/l in ethanol en verdunningen – 0.090 mol/l KMnO4
- Thema: organische stoffen – redoxreactie – reactiesnelheid
- Tijd: 25 min
- Begrippen: carbonzuren – oxidatie






