De ondergaande zon, uitgebreide versie
1.Onderzoeksvraag
Hoe snel gebeurt een chemische reactie? Hoe kunnen we reactiesnelheid beïnvloeden?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Concentratie: De concentratie of sterkte van een oplossing geeft aan hoeveel stof er is opgelost per hoeveelheid oplossing. Het symbool voor concentratie is C.
- Zuur: Zuren zijn deeltjes die een proton kunnen afgeven. Het zijn protondonoren.
- Zout: Zouten zijn ion-verbindingen tussen één of meerdere metaal- of ammoniumionen en één of meerdere zuurrestionen.
b.Materiaal + stoffen
- 4 bekerglaasjes van 20 mL en 25mL inhoud
- 4 Petrischalen
- Zwarte servet
- Volumepipetten
- Demiwater
- Natriumthiosulfaat
- 0,5 mol/l HCl
c.Opstelling (foto)

d.Etiketten

COS brochure
3.Uitvoeren
a.Werkwijze
Leg de servet open op de labo-bank. Zet de 4 petrischalen hierop. Bereid een 20% natriumthiosulfaat-oplossing.Vul elke petrischaal met 18 mL 0,5mol/l HCl.
Vul de bekerglaasjes? Gemerkt A, B, C en D:
- 3mL 20% thiosulfaat + 9mL demiwater
- 6mL 20% thiosulfaat + 6mL demiwater
- 9 mL 20% thiosulfaat + 3mL demiwater
- 12 mL 20% thiosulfaat
Vraag hulp aan je labopartner, want de thiosulfaat-oplossing moet gelijktijdig toegevoegd worden.
b.Waarneming (+ foto’s)
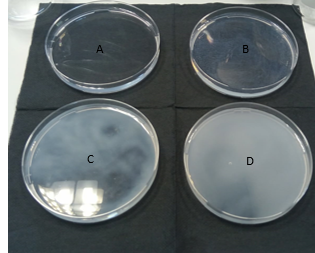
De vier “zonnen” gaan één voor één onder, eerst D .
4.Reflecteren
Na2S2O3 (aq)+ 2HCl(aq) –> 2 NaCl + H2S2O3
2 NaCl + H2S2O3 –> NaCl(aq) + H2O(l) + S(v) + SO2(g)
We zien dat er duidelijk vertroebeling optreedt, dit is zo omdat er uiteindelijk zwavel wordt gevormd dat een neerslag is. Hierdoor wordt onze heldere oplossing troebel. Des te hoger de concentratie thiosulfaat, des te sneller de neerslagvorming zichtbaar wordt.
We verkrijgen een colloïdale oplossing: de kleine zwaveldeeltjes blijven dus fijn verdeeld in de vloeistof. Doordat er steeds meer zwavel ontstaat krijgen we dus een vertroebeling dat uiteindelijk ervoor zorgt dat het licht dat doorheen de beker schijnt, geblokkeerd wordt
5. Aanvullingen
- Bureaulamp gebruiken.
- 1 schaaltje gebruiken dat in 4 delen verdeeld is.
- Dit experiment kan worden gebruikt in de lessen rond reactiesnelheid. We laten de leerlingen verschillende verdunningen maken van de natriumthiosulfaatoplossing. Hierbij voegen we dan steeds dezelfde hoeveelheid HCl met dezelfde concentratie. Zo zien leerlingen duidelijk de invloed van concentratie op de reactiesnelheid.






