Hoofdstuk 6 – Experimenten
1.Atoommassa – molecuulmassa-molmassa-molair gasvolume-mol

- Info:Hoe kunnen we experimenteel de molmassa van Mg bepalen? Wanneer je een beetje zoutzuur in de spuit voegt, begint het direct te reageren met het Mg-lint. .Er wordt een gas gevormd. Je ziet het aan het Mg-lint omdat er bellen rond ontstaan en aan de spuit zelf, omwille dat de hoeveelheid zich vermeerdert.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Zoutzuur 2mol/l – Mg-lint
- Thema: chemisch rekenen
- Tijd: 10 min
- Begrippen: molmassa – molaire massa
1.2. Kwantitatief volume gas maken

- Info:Wat is het molair volume van een gas?
- Moeilijkheid: eenvoudig
- Chemische stoffen: HCl – Magnesiumlint
- Thema: chemisch rekenen
- Tijd: 15 min
- Begrippen: molmassa – molair gasvolume
1.3. Mol voorstellen

- Info:Hoe kunnen we het verschil in molaire massa van verschillende stoffen zichtbaar maken? Deze proef maakt duidelijk dat stoffen drastisch kunnen verschillen van molaire massa. Van hieruit kan men verder nadenken en besluiten dat verschillende moleculen dus ook drastisch van grootte kunnen verschillen.
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaCl – Fe – Al – CaCO3 (marmer) – H2O – C2H5OH (ethanol)
- Thema: chemisch rekenen
- Tijd: 15 min
- Begrippen: begrip mol
1.4. Mol en molaire massa

- Info:Hoe kun aan de hand van dagdagelijkse stoffen het begrip mol en molaire massa aanbrengen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaCl – bakpoeder– H2O
- Thema: chemisch rekenen
- Tijd: 15 min
- Begrippen: begrip mol – molaire massa
1.5. Bepalen van aantal mol en moleculen van een stof

- Info:Hoe kun aan de hand van dagdagelijkse stoffen het begrip mol en molaire massa aanbrengen? Bereken massa van suikerklontje, bereken molaire massa van sucrose en bepaal mol van suikerklontje
- Moeilijkheid: eenvoudig
- Chemische stoffen: suikerklontje
- Thema: chemisch rekenen
- Tijd: 15 min
- Begrippen: begrip mol – molaire massa
2. Oplossingen – gassen
2.1. Maken van oplossingen met bepaalde concentraties

- Info: Hoe kunnen we kwantitatief een oplossing maken? Maken van een oplossing keukenzout en verdunnen
- Moeilijkheid: eenvoudig
- Chemische stoffen: NaCl
- Thema: chemisch rekenen
- Tijd: 15 min
- Begrippen: begrip mol – concentratie – verdunnen
2.2. Verband tussen mol/l en m% voorstellen

- Info: Hoe kunnen we kwantitatief oplossingen verdunnen? In het dagelijks leven moet je soms kwantitatief oplossingen verdunnen tot exacte concentraties.
- Moeilijkheid: eenvoudig
- Chemische stoffen:HCl
- Thema: chemisch rekenen
- Tijd: 15 min
- Begrippen: begrip mol – concentratie – verdunnen
2.3. Verdunnen van een oplossing kopersulfaat

- Info: Hoe kunnen we de concentratie van een bepaalde stof verlagen?
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4*5H2O
- Thema: chemisch rekenen
- Tijd: 20 min
- Begrippen: begrip mol – concentratie – verdunnen
3. Kwalitatief onderzoek
3.1. Kwalitatief onderzoek van melk

- Info: Hoe kunnen we de samenstelling van melk kwalitatief nagaan? Na scheiden in componenten gebeuren verschillende identificatiereacties
- Moeilijkheid: gemiddeld
- Chemische stoffen: volle melk – verdund azijnzur -verdund natriumhydroxide 0.5 M -kopersulfaatoplossing 1% -diethylether -ethanol 96% -indikatorpapier -natriumsulfaat -Fehling-oplossingen -SudanIII-oplossing 0.1% in methanol
-natriumdithionietoplossing 1% -ammoniumoxalaatoplossing 5% -ammoniummolybdaatoplossing 10% - Thema: chemisch rekenen – scheidingstechnieken
- Tijd: 120 min
- Begrippen: concentratie – identificatiereacties – scheidingsschema
4. Kwantitatief onderzoek
4.1. Alcohol bepalen van jenever

- Info: Bij welk alcoholpercentage kun je likeur laten ontbranden? Wanneer we in het donker werken, zien we dat zelfs bij alcoholpercentages van 30% à 40% het wattenstaafje vuur (vonken) vat. Dit betekent dat we likeuren vanaf 30% kunnen laten ontbranden.We testen dit met een kleine hoeveelheid rum.
- Moeilijkheid: gemiddeld
- Chemische stoffen: 98% alcoholoplossing (in de apotheek te verkrijgen) – rum
- Thema: chemisch rekenen
- Tijd: 20 min
- Begrippen: concentratie -verbranding
4.2. Bepalen van alcoholgehalte in alcopops

- Info: Hoeveel alcohol zit er in een alcopop? De alcopop bevat inderdaad iets van een 10 procent alcohol. De destillatie is vrij eenvoudig uit te voeren
- Moeilijkheid: gemiddeld
- Chemische stoffen:Alcoholpop
- Thema: chemisch rekenen
- Tijd: 20 min
- Begrippen: concentratie -verbranding
4.3. Koolzuurgas in soorten spa

- Info: Wat is het verschil in CO2 gehalte in kraantjeswater, bruiswater en gedemineraliseerd water? Men gaat kijken hoeveel zuur er nodig is om de indicator van kleur te doen veranderen. Door de bufferende werking van CO2 kunnen we zo vaststellen welk staal het meeste CO2 bevat. Hoe meer zuur we moeten toevoegen, hoe meer CO2 in het staal aanwezig is.In het bruiswater is het meeste CO2 aanwezig, in het gedemineraliseerd water het minste, het kraantjeswater zit er tussen in.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Bruiswater– Kraantjeswater– Gedemineraliseerd water
- Thema: chemisch rekenen
- Tijd: 20 min
- Begrippen: concentratie -buffer – dosering – indicator
4.4. Hoeveel koolzuurgas wordt er geproduceerd tijdens de reactie tussen bakpoeder en azijn?

- Info: Hoeveel CO2 wordt er geproduceerd tijdens de reactie tussen bakpoeder en azijn? Door afwegen voor en na de reactie
- Moeilijkheid: gemiddeld
- Chemische stoffen: Bakpoeder – Tafelazijn
- Thema: chemisch rekenen
- Tijd: 20 min
- Begrippen: concentratie -dosering
4.5. Hoeveel koolzuurgas komt er vrij bij het oplossen van een bruistablet?
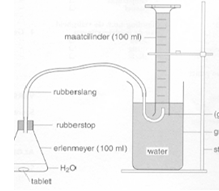
- Info: Hoeveel CO2 komt er vrij bij het oplossen van een bruistablet ?
- Moeilijkheid: eenvoudig
- Chemische stoffen: Bruistablet – Gedemineraliseerd water
- Thema: chemisch rekenen
- Tijd: 20 min
- Begrippen: concentratie -dosering
4.6. Onderzoek van bruisend mineraal water

- Info: Is er CO2 aanwezig in bruisend mineraalwater? Er ontstaat een neerslag in het kalkwater als er CO2 vrijkomt.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Flesje sprankelend mineraalwater
- Thema: chemisch rekenen
- Tijd:15 min
- Begrippen: concentratie -dosering
4.7. Onderzoek van ingeademde en uitgeademde lucht

- Info: Bevat uitgeademde lucht CO2? Er is CO2 aanwezig in uitgeademde lucht. Er is geen CO2 aanwezig in ingeademde lucht.
- Moeilijkheid: eenvoudig
- Chemische stoffen:Helder kalkwater
- Thema: chemisch rekenen
- Tijd:15 min
- Begrippen: concentratie -dosering – identificatie koolzuurgas
4.8. CO2 gehalte meten in ingeademde en uitgeademde lucht met de Ipad

- Info: In welke lucht (uitgeademde lucht, buitenlucht) is de CO2-concentratie het grootst en waar is deze het kleinst? De CO2-concentratie is het groots in uitgeademde lucht en het kleinst in buitenlucht.
- Moeilijkheid: eenvoudig
- Chemische stoffen: CO2– meetinstrument
- Thema: chemisch rekenen
- Tijd:15 min
- Begrippen: concentratie -dosering
4.9. Gehalte kristalwater in kopersulfaatpentahydraat bepalen

- Info: Hoeveel kristalwater bevat de waterhoudende kristallijne stof koper(II)sulfaat? Noteer nauwkeurig de massa van het kroesje met het gehydrateerd zout. Stop verwarming zodra al het kristalwater verdampt is. Laat het kroesje tot handwarm afkoelen.Bepaal opnieuw de massa van het kroesje gevuld met zout, waarvan het kristalwater nu verdampt is
- Moeilijkheid: eenvoudig
- Chemische stoffen: CuSO4 * x H2O
- Thema: chemisch rekenen
- Tijd:15 min
- Begrippen: concentratie -dosering
4.10. Gehalte Mg in bruistablet

- Info: Hoeveel magnesium zit in een Mg-bruistablet? Uit één mol MgCO3 ontstaat een mol CO2 . De vermindering van de massa is toe te schrijven aan het ontsnappen van CO2. Uit de massavermindering kan het aantal mol CO2 berekend worden en dus ook het aantal mol MgCO3 en mol Mg. Hieruit wordt de massa van Mg berekend.
- Moeilijkheid: eenvoudig
- Chemische stoffen: Mg-bruistablet
- Thema: chemisch rekenen
- Tijd:25 min
- Begrippen: concentratie -dosering
4.11. Gravimetrische bepaling van natriumhydroxide in ontstopper

- Info: Hoe kun je gravimetrisch de concentratie natriumhydroxide bepalen in vloeibare ontstopper? Door het hydroxide neer te slaan met koper(II)-ionen en dan gravimetrisch de neerslag te meten.
- Moeilijkheid: gemiddeld
- Chemische stoffen: Vloeibare ontstopper – Kopersulfaat 0,5 mol/l – Fenolfthaleïne 0,05%
- Thema: chemisch rekenen
- Tijd:25 min
- Begrippen: concentratie -dosering
5. Gaswetten
5.1. Plet het blikje

- Info: Hoe kunnen een blikje pletten zonder aan te raken? Het kookproces veranderde het water in damp. En omdat de waterdampmoleculen veel meer verspreid zijn dan de watermoleculen, nemen ze meer ruimte in beslag en dwingen ze de luchtmoleculen uit het blik. Toen het blik in het koude water kwam, koelde het ineens af. Die afkoeling zorgde ervoor dat de waterdamp in het blik condenseerde, waardoor een gedeeltelijk vacuüm ontstond. Daardoor werd de druk buiten het blikje veel groter dan de druk binnenin, en dat drukverschil verpletterde het blikje.
- Moeilijkheid: eenvoudig
- Chemische stoffen: warm water
- Thema: chemisch rekenen
- Tijd:25 min
- Begrippen: dichtheid gassen – deeltjesmodel
5.2. Antibubbels

- Info: Hoe kunnen we anti-bubbels maken? Anti-bubbels zijn gemakkelijk te herkennen omdat ze langzaam naar beneden bewegen en dan langzaam naar de oppervlakte klimmen en 1-2 minuten volledig onder het oppervlak blijven.
- Moeilijkheid: eenvoudig
- Chemische stoffen: 30-40 ml helder afwasmiddel – natriumchloride (alternatieve variatie) – Kleurstof voor levensmiddelen (afwisselende variatie)
- Thema: chemisch rekenen
- Tijd:20 min
- Begrippen: dichtheid gassen – gasbellen






