Waarnemen van stoichiometrisch punt via een zb titratie
1.Onderzoeksvraag
Welke verschillende mogelijkheden zijn er om een stoichiometrisch punt waar te nemen bij een zuur-base titratie?
a. Materiaal + stoffen
- Statief met voet
- Buretklem
- Buret
- 10 ml volpipet
- 250 ml bekerglas
- Trechter
- NaOH-oplosing 0,1 mol/l
- NaOH-oplossing 1,0 mol/l
- 0,05% fenolftaleïne-oplossing
- HCl-oplossing 0,1 mol/l
- HCl-oplossing 1,0 mol/l
b.Opstelling (foto)

3.Uitvoeren
a.Werkwijze
Werkwijze pH-meter:
- Maak de proefopstelling, wees voorzichtig met het
- Spoel de volpipet voor met HCl 0,1 mol/l.
- Pipetteer 10 ml met een volpipet HCl 0,1 mol/l in het
- Plaats het bekerglas op een roerplaat en zet deze
- Zet in het bekerglas de pH-meter, zet deze vast op het statief en zorg ervoor dat deze niet op de bodem van het bekerglas komen, zodat de roerder hier niet tegen
- Voeg in het bekerglas bij de HCl 0,1 mol/l 2 druppel fenolftaleïne-oplossing
- Spoel de buret voor met 0,1 mol/l
- Vul de buret met 0,1 mol/l
- Titreer de NaOH 0,1 mol/l in het bekerglas tot de oplossing van kleur
- Noteer het volume NaOH-oplossing dat je hebt
- Voer de titratie 3 keer in het totaal
Werkwijze geleidbaarheids- en temperatuurmeter:
- Maak de proefopstelling, wees voorzichtig met het
- Spoel de volpipet voor met HCl 1 mol/l.
- Pipetteer 10 ml met een volpipet HCl 1 mol/l in het
- Plaats het bekerglas op een roerplaat en zet deze
- Zet in het bekerglas de geleidbaarheids- en temperatuurmeter, zet deze vast op het statief en zorg ervoor dat deze niet op de bodem van het bekerglas komen, zodat de roerder hier niet tegen komt.
- Voeg in het bekerglas bij de HCl 1 mol/l 2 druppel fenolftaleïne-oplossing
- Spoel de buret voor met 1 mol/l
- Vul de buret met 1 mol/l
- Titreer de NaOH 1 mol/l in het bekerglas tot de oplossing van kleur
- Noteer het volume NaOH-oplossing dat je hebt
- Voer de titratie 3 keer in het totaal
b.Waarneming en besluit (+ foto’s)
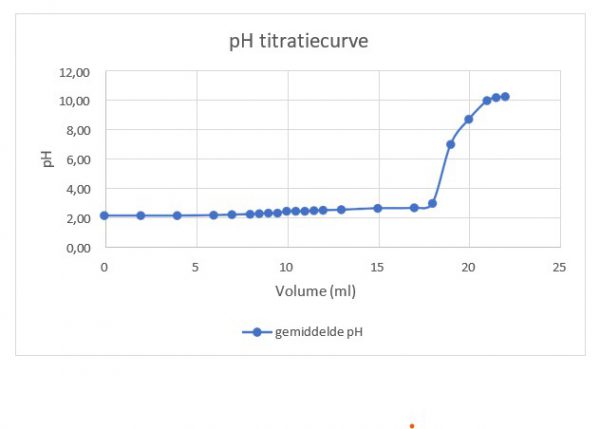
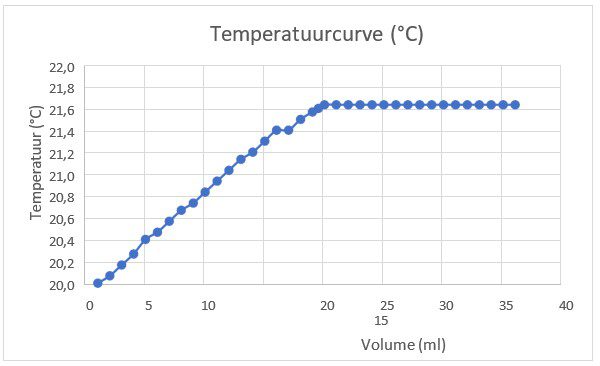
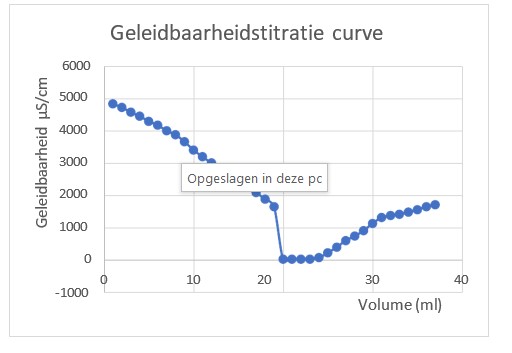
De geleidbaarheidscurve is een weergave van hoe de elektrische geleidbaarheid van een oplossing verandert naarmate er meer zuur of base wordt toegevoegd tijdens een titratie. Laten we dit verloop nader bekijken:
- Beginfase:
- Aan het begin van de titratie bevindt de oplossing zich in zijn oorspronkelijke toestand. In dit onderzoek zijn de ionen H+ en Cl– verantwoordelijk voor de geleidbaarheid.
- Eerste fase (afname):
- Naarmate de base wordt toegevoegd, reageert deze met HCl in de
- De concentratie van H⁺-ionen neemt af, door de neutralisatie met de toegevoegde OH– -ionen, wat resulteert in een afname van de geleidbaarheid.
- Dit wordt weergegeven in de geleidbaarheidscurve als een dalende
- Equivalentiepunt:
- Het stoichiometrisch punt of equivalentiepunt is het moment waarop de hoeveelheid base precies reageert met de hoeveelheid zuur.
- Op dit punt is de geleidbaarheid minimaal omdat alle reactieve deeltjes zijn geneutraliseerd. De geleidbaarheid wordt bepaald door aanwezige Cl– en Na+-ionen
- Dit punt komt overeen met het snijpunt van de twee lijnen in de
- Tweede fase (toename):
- Na het equivalentiepunt wordt er meer base toegevoegd dan nodig is voor neutralisatie.
- De concentratie van OH⁻-ionen neemt toe, wat resulteert in een stijging van de geleidbaarheid.
- Dit wordt weergegeven in de geleidbaarheidscurve als een stijgende
- Eindfase:
- Na het equivalentiepunt blijft de geleidbaarheid toenemen omdat er steeds overtollige base aanwezig is. De OH– -ionen die in overmaat worden toegevoegd bepalen de geleidbaarheid van de oplossing.






