Reducerende werking ascorbinezuur (vitamine C)
1.Onderzoeksvraag
Hoe kunnen we met een redoxreactie ascorbinezuur aantonen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Redoxreacties, indicatoren, pH-waarden
b.Materiaal + stoffen
- Ascorbinezuuroplossing 0,1%, kaliumpermanganaatoplossing 1%, zwavelzuur 1mol/l
- Maatbekers, pipetten en magneetroerder.
c.Bereiding oplossingen
Ascorbinezuuroplossing (0,1%)
0,1 gram per 100ml oplossing
Kaliumpermanganaatoplossing (1%)
1 gram per 100ml oplossing
n = m/M = 1 gram / 158 gram/mol c = n/V = 0,0063 / 0,100l
n = 0,0063 mol c = 0,063 mol/l
d.Opstelling (foto)

e.Etiketten

3.Uitvoeren
a.Werkwijze
- In twee maatbekers wordt in ieder 100ml gedestilleerd water gedaan en 2ml kaliumpermanganaatoplossing.
- Voeg hier wat zwavelzuur aan toe.
- Voeg aan de eerste erlenmeyer ascorbinezuur toe bij kamertemperatuur tot het mengsel kleurloos is geworden.
- Brengt 20 ml ascorbinezuur aan de kook en voeg dit druppelsgewijs toe aan de tweede erlenmeyer tot het mengsel kleurloos is geworden.
b.Waarneming (+ foto’s)
Door ascorbinezuur-oplossing toe te voegen aan kaliumpermanganaat (in oplossing) is er een uitwisseling van elektronen. Hierdoor verandert het mangaan van OT en verandert het kaliumpermanganaat van kleur.
Er is veel meer gekookte ascorbinezuur nodig om het mengsel te ontkleuren dan bij ascorbinezuur op kamertemperatuur. De verklaring ligt in het feit dat ascorbinezuur onstabiel is bij hoge temperatuur.
4.Reflecteren
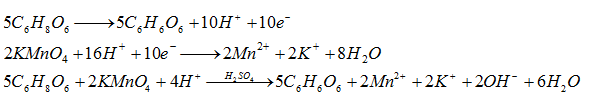
Het ascorbinezuur zit in citroenen. Het heeft een reducerend vermogen en reduceert daarom het mangaan in het kaliumpermanganaat. Door de verandering van OT en uitwisseling van elektronen verandert de oplossing van kleur.






