Reacties van zoutoplossingen
1.Onderzoeksvraag
Hoe reageren zouten in een waterige oplossing?
2.Voorbereiding
a.Materiaal + stoffen
- – proefbuizen
- – spatel
- – demiwater
- – universeel indicator
- – verschillende zouten: ijzerchloride, natriumcarbonaat, ammoniumchloride, natriumchloride, natriumwaterstofsulfaat, natriumwaterstofcarbonaat, natriumacetaat, kopersulfaat
b.Opstelling (foto)

c.Etiketten
3.Uitvoeren
a.Werkwijze
- Vul 9 proefbuizen half met demiwater.
- Voeg aan alle proefbuizen enkele druppels universeel indicator toe.
- De eerste proefbuis dient als referentie, voeg vanaf de 2de proefbuis een beetje van ieder zout toe.
- Schud ieder proefbuis lichtjes.
- Bestudeer de kleuromslag.
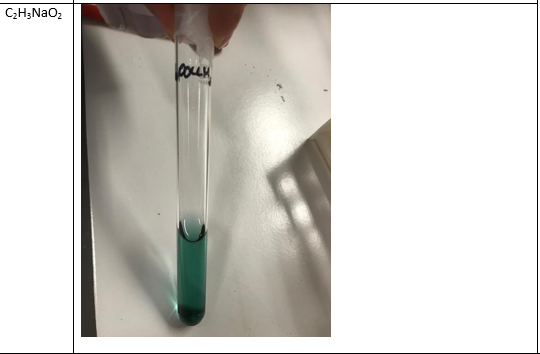
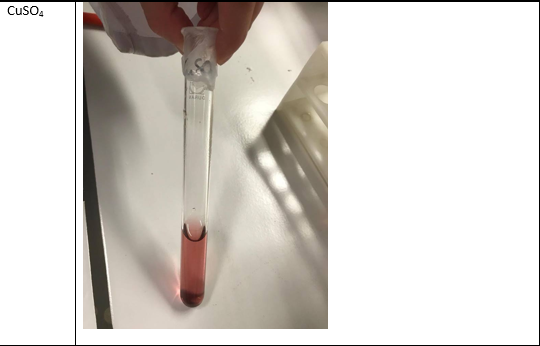
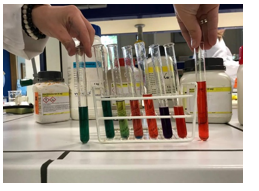
b.Waarneming (+ foto’s)



4.Reflecteren
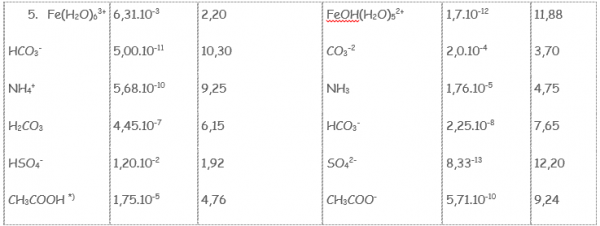
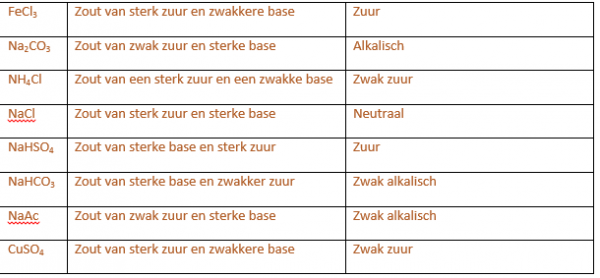
De kleur van de oplossing vertelt ons wat de pH waarde is van de zouten.
Ijzertrichloride –> rood –> zuur
Natriumcarbonaat –> blauw –> basisch
Ammoniumchloride –> geel/oranje –> zwak zuur
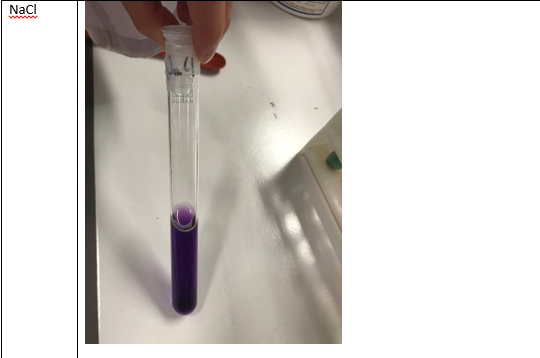
Natriumchloride –> geelgroen –> neutraal
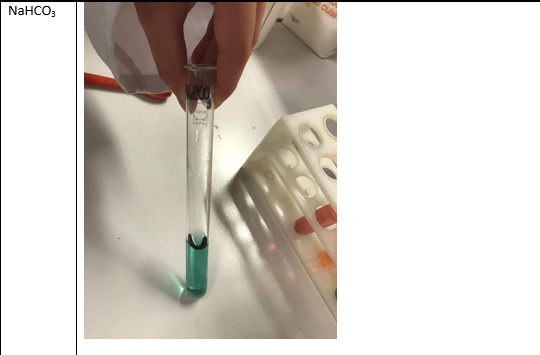
Natriumwaterstofcarbonaat –> blauwgroen –> zwak basisch
Natriumacetaat –> donker groen/blauw –> zwak basisch
Kopersulfaat –> oranje –> zwak zuur
pH waarden van zouten:
NaCl…7-8
KBr….6
NaNO3…6-7
K2SO4…8-9
NaC2H3O2…10
NH4Cl…4
K2CO3…13
(NH4)2SO4…2
CuSO4…1
FeCl3…1
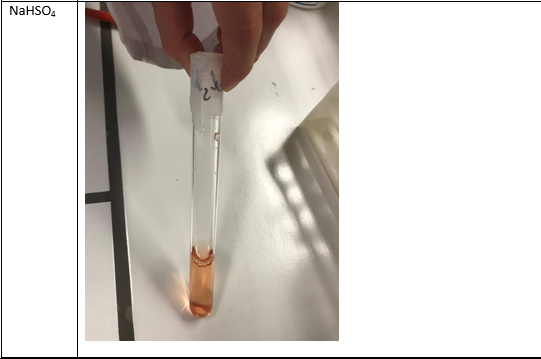
Een rode kleur betekent een zure omgeving. Dit is zo het geval bij FeCl3 en NaHSO4. Oranje betekent een zwak zure omgeving. Groen wijst op een neutrale pH, namelijk pH 7 en blauw betekent een base omgeving. Aan de hand van de reactievergelijkingen is al af te leiden welke kleur er zal ontstaan.
NaCl is afkomstig van een sterk zuur en sterke base
Na2CO3 is afkomstig van een zwak zuur en een sterke base: reageert basisch
NaHCO3 is afkomstig van een zwak zuur en een sterke base: reageert licht basisch
Na-acetaat is afkomstig van een zwak zuur en een sterke base: reageert zwak basisch
NH4Cl: is afkomstig van een zwakke base en een sterk zuur: reageert zuur
De Fe- en Cu-zouten:
Cu+2 (aq) + 2 H2O –> Cu(OH)2 (s) + 2 H+ (aq) : zet protonen vrij en reageert dus zuur.






