Reacties met zilverionen
1.Voorbereiding
a.Materiaal + stoffen
- NH3 3 mol/l
- FeSO4 0,2 mol/l
- KBr 0,2 mol/l
- KI 0,2 mol/l
- AgNO3 0,1 mol/l
- NaCl 0,2 mol/l
b.Opstelling (foto)

2.Uitvoeren
a.Werkwijze
- Print bijhorende tabel en plastificeer het blad
- Voeg 1 druppel AgNO3 oplossing in elk vak van de eerste twee rijen met AgNO3.
- Voeg 1 druppel chloride, bromide en jodideoplossing aan de AgNO3 oplossingen in de overeenkostige vakjes.
- Bedek de eerste rij van het blad met een stuk karton.
- Neem de karton na 15 minuten weg en vergelijk de stalen van rij 1 met die van rij2.
- Voeg telkens 1 druppel AgNO3 in de derde rij.
- Voeg hieraan respectievelijk 1 druppel chloride, bromide en jodide toe.
- Voeg nu 5 druppels NH3 aan elk vakje van de laatste rij.
- Meng met een pipet en observeer
- Print bovenstaande tabel en plastificeer het blad
- Voeg 1 druppel AgNO3 oplossing in het vak
- Voeg hieraan 1 druppel FeSO4
Meng en observeer met een vergrootglas
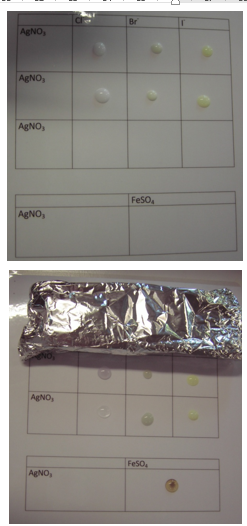
b.Waarneming (+ foto’s)
3.Reflecteren
Toevoeging van chloride, bromide en jodide aan AgNO3 geeft onmiddellijk een witte, licht gele en gele neerslag.
Deze neerslag blijft bestaan als de stalen worden afgeschermd van licht. De kleuren van AgCl en AgBr worden donkerder door de vorming van metallisch zilver, met jodide ontstaat weinig verschil.
AgCl lost onmiddellijk op in NH3 oplossing, AgBr gedeeltelijk, AgI niet
Toevoeging van Fe(II) oplossing aan AgNO3 geeft vorming van Ag wat vast te stellen is met een vergrootglas.
Reactie:
Ag+ + Fe2+ –> Ag + Fe3+
De verklaring is te vinden via de redoxpotentialen
Ag+ + e– –> Ag E° = +0,80V
Fe3+ + e– –> Fe2+ E°= +0,77V






