Reacties met kopersulfaat
1.Onderzoeksvraag
Hoe kun je verschillende kleurveranderingen bekomen met een kopersulfaatoplossing?
2.Voorbereiding
a. Materiaal + stoffen
- -geplastificeerde versie van het blad
- -pasteurpipetten
- -spatel
- -tandenstokertjes
- -kopersulfaatpentahydraat
- -magnesiumpoeder
- -NaOH-oplossing 0,4 mol/l
- -KI-oplossing 0,5 mol/l
- -Na2S2O3 0,1 mol/l
- -NaCl-verzadigde oplossing
- -NH3-oplossing 1 mol/l
b.Opstelling (foto)
3.Uitvoeren
a.Werkwijze
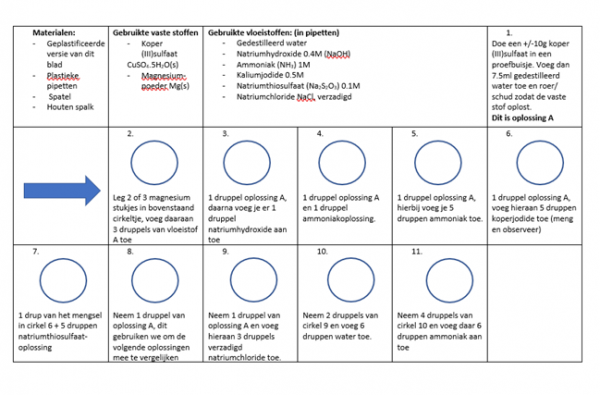
Volg het stappenplan op het geplastificeerde blad
b. Waarneming en besluit (+ foto’s)
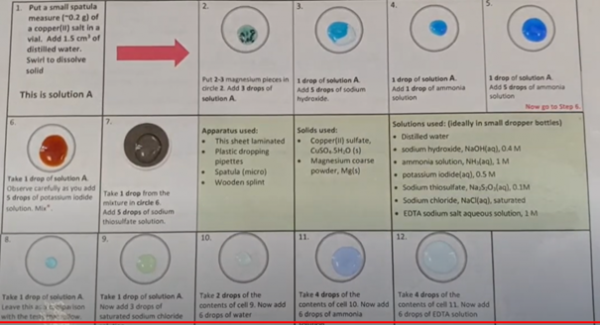
Vak2: CuSO4 + Mg –> Cu + MgSO4. In de oplossing ontstaan roodbruine korreltjes
Vak3: CuSO4 + 2 NaOH –> Cu(OH)2 + Na2SO4 blauwe neerslag
Vak4: CuSO4 + 2 NH4OH –> Cu(OH)2 + (NH4)2SO4 blauwe neerslag
Vak5: Cu2+ + 4 NH3 –> Cu(NH3)42+ complexvorming blauwe oplossing van kopertetramine door de overmaat ammoniak
Vak6: 2 CuSO4 + 4 KI –> 2 CuI + I2 + 2 K2SO4 vorming van bruine oplossing door het dijood en vorming van de rode neerslag van CuI
Vak7: I2 + 2 Na2S2O3 –> 2 NaI + Na2S4O6 De vorige oplossing wordt ontkleurd
Vak9: CuSO4 + 2 NaCl –> CuCl2 + Na2SO4 vorming van groene oplossing CuCl2
Vak10: de vorige oplossing wordt verdund en ontkleurt gedeeltelijk
Vak11: Cu2+ + 4 NH3 à Cu(NH3)42+ complexvorming blauwe oplossing van kopertetramine door de overmaat ammoniak
Bron Microscale copper sulfate chemistry – YouTube






