Reacties met chloorgas
1.Onderzoeksvraag
Hoe kunnen we redoxreacties visueel voorstellen in een chemische reactie? Hoe kunnen we chloorgas bereiden en aantonen?
2.Voorbereiding
a.Materiaal + stoffen
- Petrischaal met 4 vakjes
- Deksel voor petrischaal
- 6 pasteurpipetten
- Spatel
- 4 kleine maatbekertjes of proefbuizen
Tip! Je kan ook een gewone petrischaal gebruiken. Zorg wel dat de stoffen gescheiden blijven!
- NaClO (javel)
- H2SO4 1 mol/l
- NaOH 0,1 mol/l
- Fenolftaleïne/thymolftaleïne 0,05%
- KI 0,1 mol/l
- Zetmeel 1%
- Fe(II)SO4 0,1 mol/l
- KSCN 0,1 mol/l
b.Opstelling (foto)

c.Etiketten

3.Uitvoeren
a.Werkwijze
- Voeg de volgende stoffen samen in aparte proefbuizen tot 2 à 3 cm:
- NaClO
- NaOH + Fenolftaleïne
- KI + spatelpunt zetmeel
- Fe(II)SO4 + KSCN
- Breng een aantal druppels vanuit elke proefbuis in een apart vakje van de nucleonschaal of verdeelde petrischaal.
Tip! Duid goed aan wat in elk vakje zit! (Doe dit ook bij de proefbuizen!)
- Voeg enkele druppels H2SO4 toe aan NaClO in het schaaltje en sluit meteen af.
Laat een paar minuten rusten.
b.Waarneming (+ foto’s)
Voor de proef:

- Linksboven: NaOH + Fft –> roze kleur
- Rechtsboven: KI + zetmeel –> kleurloos
- Linksonder: NaClO –> kleurloos
- Rechtsonder: Fe(II)SO4 + KSCN –> kleurloos
Na de proef:
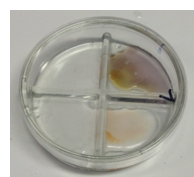
- Linksboven: NaOH + Fft –> kleurloos
- Rechtsboven: KI + zetmeel –> donker paarse kleur
- Linksonder: NaClO + H2SO4 –> Kleurloos
- Rechtsonder: Fe(II)SO4 + KSCN –> Oranje-rode kleur
4.Reflecteren
- 2 NaClO + 2 H2SO4 –> 2 NaSO4 + 2 H2O+ Cl2↑
- 2NaOH + Cl2 → NaCl + NaClO + H2O
- 2KI + Cl2↑ à 2KCl + I2↑
I-I – 1 e– → I0
Cl0 + e– → Cl-I
I2 + zetmeel –> paarse kleur
- 3 Cl2 + 6 FeSO4 –> 2 Fe2(SO4)3 + 2 FeCl3
Fe+II – 1 e– → Fe+III
Cl0 + e– → Cl-I
FeCl3 + 3 KSCN –> 3 KCl + Fe(SCN)3 –> Oranje-rode kleur
Het NaClO reageert met het zuur ter vorming van chloorgas. Door de beperkte concentratie is de geel-groene kleur van het gas minder duidelijk te zien. Het gas verspreidt zich in het petrischaaltje.
Doordat het chloorgas reageert met NaOH daalt de pH en ontkleurt de indicator.
Het chloorgas reageert met KI, reactiviteit van niet-metalen waardoor dijood ontstaat. Het dijood is aan te tonen met zetmeel.
Bij het samenvoegen van Fe(II)SO4 en KSCN zien we oorspronkelijk niets. Maar door de reactie met Cl2 zal Ijzer(II) oxideren, waardoor deze wel gaat reageren met KSCN ter vorming van Fe(SCN)3. Dit geeft uiteindelijk de oranje-rode kleur.
5. Aanvullingen
Zoals eerder opgemerkt bij de materialen kan je ook gebruik maken van een normaal petrischaal. Let wel op dat de stoffen elkaar niet raken! Een andere mogelijkheid is een nucleonschaal.
Let goed op met javel! Dit is erg irriterend en geeft vlekken op de kleren. Laat de leerlingen labo jas en bril dragen als ze dit zelfstandig doen.






