Reactie tussen natriumsulfiet, zwavelzuur en kaliumjodaat
1.Onderzoeksvraag
Welke reactie treedt erop tussen het gas van een natriumsulfiet, zwavelzuur oplossing en een kaliumjodaat oplossing?
2.Voorbereiding
a.Materiaal + stoffen
- Proefbuizen (2)
- Proefbuisstoppen (2) met opening
- Glazen gebogen buis (voor gas door te laten)
- Natriumsulfiet 0,1 mol/liter
- Zwavelzuur 2 mol/liter
- Kaliumjodaat 0,05 mol/liter
b.Etiketten

3.Uitvoeren
a.Werkwijze
Doe 3 ml 0,1 mol/liter natriumsulfietoplossing, voeg hierbij 1 ml 2 mol/liter zwavelzuuroplossing. Sluit de proefbuis met een proefbuisstop, zorg dat de glazenbuis door de stop zit en wordt geleid naar een andere proefbuis waar 3 ml 0,05 mol/liter kaliumjodaatoplossing zit. Verwarm de eerste proefbuis en zorg dat het ontsnappende gas door de kaliumjodaatoplossing borrelt. Schrijf je waarnemingen op.
b.Waarneming (+ foto’s)
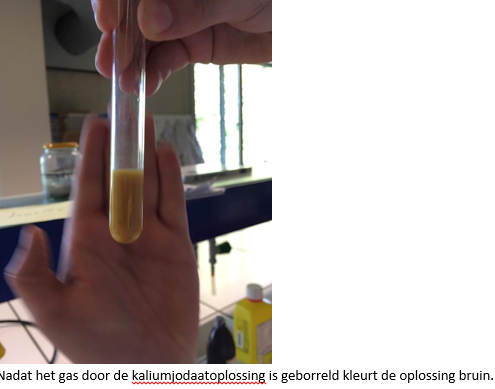
4.Reflecteren
SO32- + 2 H3O+ –> 3 H2O + SO2
4 SO2 + 2 IO3– + 12 H2O –> I2 + 8 H3O+ + 5 SO42-
Bij het verhitten ontwijkt het SO2-gas. Dit gas kleurt de jodaatoplossing bruin.
SO32- (aq) + 2 H3O+(aq) –> 3 H2O(l) + SO2(g)
Regel: Een sterk zuur (zwavelzuur) verdrijft een zwak zuur uit zijn zouten
4 SO2(g) + 2 IO3–(aq) + 12 H2O(l) –> I2(aq) + 8 H3O+(aq) + 5 SO42-(aq)
Bruin
Redoxreactie waarbij het jodaat optreedt als oxidator van zwaveldioxide.
5. Aanvullingen







