Pulserend glas
1.Onderzoeksvraag
Hoe kunnen we herhaaldelijk een “Drankje” laten schuimen?
2.Voorbereiding
a.Begrippen als achtergrond voor experiment
- Katalysator (stof die reactie snelheid doet toenemen, maar niet wordt verbruikt)
b.Materiaal + stoffen
- een champagne glas / glazen buisje ( laat deze 12 uur water in geconcentreerd 30% NaOH oplossing en spoel erna uit met gedestilleerd water. ) Een andere optie is een verzadigde oplossing maken van KOH en Ethanol dit werkt iets krachtiger als NaOH.
- Een bekerglas
- 2 Maatcilinders. 100ml
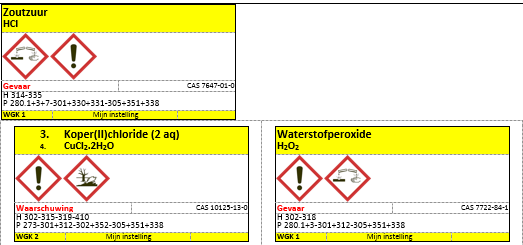
- Koperchloride.2H2O 10gram
- 10% of 30 % H2O2
- HCl 37 %
- Dreft
c.Bereiding oplossingen
Neem een bekerglas en doe hier 10 ml water in. Voeg hier 50 ml geconcentreerd zoutzuur aan toe (37%) en 10 gram koperchloride dihydraat.
d.Opstelling (foto)

e. Etiketten
3.Uitvoeren
a.Werkwijze
- Neem 10ml van de bereide oplossing en neem 10 ml van waterstofperoxide en doe deze elk in een maatcilinder.
- Voeg vervolgens deze 2 oplossingen in een bekerglas
- Voeg daarna deze oplossing in het champagne glas.
- Voeg eventueel een druppeltje Dreft toe.
- Observeer.
b.Waarneming (+ foto’s)

4.Reflecteren
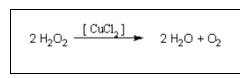
In het experiment blijft het vrijgekomen zuurstof in oplossing. Het glas is proper gemaakt met NaOH of KOH zodat er geen nucleatie plaats op de wanden waardoor de gasbellen niet vroegtijdig kunnen vrijkomen. Het zuurstofatoom in H2O2 is –I als OG. Het oxydatiegetal van zuurstof in water is –II.
Waterstofperoxide ontbindt traag maar wordt gekatalyseerd door katalysatoren als CuCl2. In het experiment blijft het vrijgekomen zuurstof in oplossing. Als de oplossing in een
verzadigde toestand het zuurstofgas bezit, schuimt het plotseling en komt een grote hoeveelheid vrij. Het verzadigingspunt wordt nu niet meer bereikt. Indien een nieuwe oververzadiging wordt bereikt komt terug gas vrij.






